Обоснование
Инвертированная папиллома (ИП) полости носа и околоносовых пазух (ОНП) известна под разными названиями: шнейдерианова папиллома, переходноклеточная папиллома, сосочковая фиброэпителиома, погружная папиллома и др. Это доброкачественная опухоль, обладающая инвазивноподобным ростом по отношению к слизистой оболочке, поскольку гистологически отмечается не разрушение, а инвагинация покровного эпителия в подлежащую строму [1]. Разрушение костных стенок может быть обусловлено масс-эффектом при ее значительных размерах или трансформацией в плоскоклеточную карциному, что отмечается у 7–15% больных [2]. Опухоль чаще развивается у мужчин старше 50 лет и составляет 0,4–7,0% всех новообразований полости носа и ОНП. Одной из нерешенных хирургических задач, связанных с этим заболеванием, является высокая частота рецидивов после удаления опухоли, достигающая 50% [3]. В связи с этим выделяют три основные характеристики, отличающие ИП от других синоназальных опухолей: сравнительно высокий потенциал локальной деструкции, рецидивирования и злокачественной трансформации.
Этиология заболевания остается неизвестной, установлен лишь ряд факторов, вероятно вовлеченных в патогенез ИП. В течение последних 30 лет активно изучалась связь ИП с вирусом папилломы человека (ВПЧ), но данные литературы все еще остаются противоречивыми. В больших исследованиях и мета-анализах уровень диагностики ВПЧ у пациентов с ИП составляет от 17 до 38 % с вариабельностью от 0 до 70% в индивидуальных сериях [1]. Эту вариабельность связывают не с различиями в методологии или географии пациентов, а с уровнем дисплазии слизистой оболочки. В тех сериях, где этот показатель был значительным (до 40%) или отмечалась трансформация ИП в плоскоклеточную карциному, чаще находили ДНК ВЧП. В целом ВПЧ 6-го и 110-го серотипов чаще обнаруживают при доброкачественной ИП, а 16-го и 18-го серотипов – при ИП с высокой степенью дисплазии или трансформации в карциному. Тем не менее уровень доказательности этих наблюдений остается невысоким и не позволяет установить четкую причинно-следственную связь [1]. Аналогично изучалась роль вируса Эпштейна–Барр и других факторов патогенеза – аллергии и хронического воспаления, однако к настоящему времени определенных выводов не существует [1].
Первичный очаг опухоли наиболее часто локализуется в слизистой оболочке решетчатого лабиринта (до 48%) и верхнечелюстной пазухи – ВЧП (до 28%). Реже первично поражаются другие ОНП и структуры полости носа [4]. Первичное поражение клиновидной пазухи – явление редкое и составляет около 7% [5]. Из области первичного очага опухоль распространяется в соседние ОНП и полость носа, вызывая соответствующие клинические симптомы. Изолированное поражение одной ОНП редко встречается и отмечается в 5% наблюдений [6].
Диагноз ИП устанавливается по данным осмотра, результатов применения методов визуализации – компьютерной (КТ) и магнитно-резонансной томографий (МРТ), а также морфологического исследования биоптата. Проведение предварительной биопсии у пациентов с подозрением на ИП обязательно для определения объема хирургического вмешательства. Что касается методов визуализации, то КТ и МРТ в этих случаях лишь дополняют друг друга. КТ является стандартом диагностики патологии ОНП, а МРТ – стандартом диагностики мягкотканных опухолей. В случае ИП на КТ определяется распространенность патологического процесса и целостность окружающих костных структур. При наличии гистологического заключения этого объема обследования оказывается достаточно, поскольку заподозрить инвазивный рост или злокачественное перерождение опухоли можно на основании КТ и только тогда дополнительно назначать МРТ. Что касается МРТ, то ряд авторов полагают, что это исследование позволяет установить первичную инвагинацию опухоли и предотвратить необходимость тотального удаления слизистой оболочки и внутриносовых структур, не вовлеченных в опухолевый процесс [1]. Другие авторы полагают, что при гистологически доказанной ИП достаточно выполнения только КТ, поскольку первичную инвагинацию опухоли можно установить только интраоперационно [7]. Вероятным признаком места инвагинации папилломы является участок гиперостоза стенки ОНП на КТ, что подтверждено в ряде исследований при сравнении с интраоперационными данными. Эти участки подлежат тотальной диссекции, поскольку клетки опухоли, остающиеся между костью, могут служить основой продолженного роста. Еще одним признаком первичной инвагинации опухоли является нарушение целостности слизистой оболочки или ее выраженная неровность, которую теоретически можно отметить на МРТ, но практически точно интерпретировать как первичный очаг сложно, поскольку опухоль, как правило, существует в условиях вторичного воспалительного процесса, который соответствующим образом ремоделирует слизистую оболочку пазухи [1]. В целом исследователи сходятся во мнении, будто установить первичный очаг дооперационно крайне затруднительно. Связан ли с этим факт высокой частоты рецидивов после удаления опухоли, достигающий 50%, неизвестно [7]. Однако объяснить рецидив опухоли только перерождением в злокачественный процесс также не удается, поскольку уровень злокачественной трансформации гораздо ниже. Таким образом, в задачу хирургического лечения входит максимально полное удаление опухоли вместе со слизистой оболочкой, окружающей предполагаемую зону первичной инвагинации [4].
В настоящее время стандартом хирургического лечения заболеваний полости носа и ОНП является эндоскопическая трансназальная хирургия, несмотря на то что открытые подходы сохраняют свою актуальность при невозможности осуществить все поставленные хирургические задачи эндоскопическим трансназальным способом [7–9]. Однако они чаще применяются не самостоятельно, а в комбинации с эндоназальными. Что касается непосредственно эндоназальных подходов, то традиционная эндоскопическая полисинусотомия при удалении ИП чаще модифицируется и персонализируется в зависимости от поставленных хирургических задач. Поскольку наиболее частым клиническим вариантом является ИП ВЧП с распространением или без в соседние ОНП, тотального удаления опухоли с ревизией всех стенок пазухи путем лишь расширения соустья в рамках традиционной полисинусотомии оказывается недостаточно, поскольку требуется определение места первичной инвагинации и, соответственно. более широкий доступ к ВЧП и лучший обзор. Методом выбора в этих случаях служит медиальная максиллэктомия, предусматривающая резекцию всей медиальной стенки ВЧП одним блоком, включая нижнюю носовую раковину. Эту методику можно выполнять в комбинации с открытым доступом, например по Denker, или эндоназально (модифицированный подход по Denker). В этом случае методика лишена наружных разрезов, сопровождается меньшим отеком мягких тканей щеки и нарушением их чувствительности [10]. В последнее время предложены методики эндоскопического прелакримального подхода и их модификации [10, 11], разработанных с целью осуществления менее агрессивного подхода в отношении нижней носовой раковины, однако их эффективность нуждается в дальнейшем изучении.
На примере представленного клинического случая проведена оценка эффективности и безопасности эндоскопического эндоназального модифицированного по Denker доступа к ВЧП.
Клинический случай
Больная М. 32 лет с жалобами на нарушение носового дыхания справа, постоянную заложенность правой половины носа и головную боль на стороне поражения поступила на плановое хирургическое лечение в оториноларингологическое отделение Клинического медицинского центра МГМСУ им. А.И. Евдокимова. Перечисленные симптомы отмечает на протяжении 3 лет. Два года назад проводилась полипотомия носа и микрогайморотомия, в результате чего была установлена гистологическая характеристика опухоли. Пациентка обратилась в связи с усилением симптомов. На КТ выявлено тотальное затемнение правой половины носа, правой ВЧП и решетчатых пазух, наличие участка оссификации в области заднелатеральных отделов ВЧП, что было расценено как место первичной инвагинации опухоли (рис. 1).

При осмотре слизистая оболочка полости носа справа резко отечна, заполнена тканью бледно-розового цвета, дольчатой структуры и мягко-эластичной консистенции (рис. 2). Имеется резкое искривление перегородки носа влево, вероятно, как результат сдавления опухолью, и циркулярное утолщение слизистой оболочки противоположной ВЧП, отражающее сопутствующее хроническое воспаление.
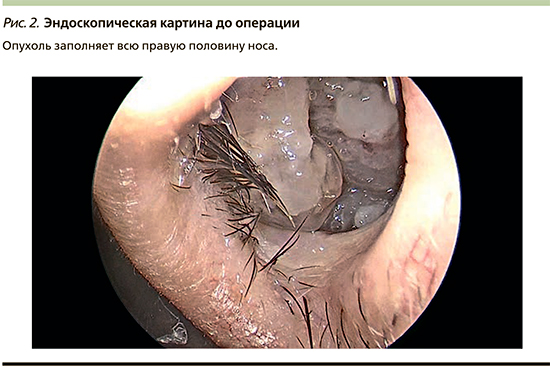
Учитывая результаты обследования, наиболее вероятным локусом первичной инвагинации в представленном наблюдении расценена латеральная стенка ВЧП, а именно протяженный участок оссификации. С целью полноценного удаления опухоли запланирован эндоназальный эндоскопический подход, предусматривающий удаление части передней и всей медиальной стенки ВЧП, включая нижнюю носовую раковину.
Операция проводилась в 4 руки, согласно современным стандартам трансназальной хирургии: эндоскоп в левой руке хирурга, рабочий инструмент – в правой, аспиратор и управление системой ирригации – у ассистента.
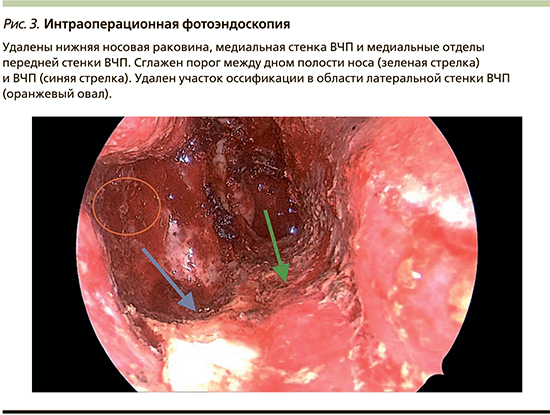
На первом этапе удалена интраназальная часть опухоли, это позволило осуществить адекватный дренаж интраоперационного отделяемого и оценить внутриносовую анатомию. Далее выполнен вертикальный разрез вдоль грушевидного отверстия справа и выполнена поднадкостничная диссекция передней и медиальной стенок лобного отростка верхней челюсти до слезной кости медиально и, не доходя до подглазничного отверстия, – спереди. Слизистая оболочка медиальной стенки ВЧП вместе с нижней носовой раковиной удалена одним блоком. При помощи бора выполнен доступ в ВЧП и истончена слезная кость. Обнаженный носослезный проток был резецирован на 1 см таким образом, чтобы не закрывать обзор латеральной и задней стенок ВЧП. Проведено удаление опухоли, всей слизистой оболочки ВЧП и нижнего отдела медиальной стенки ВЧП. Порог между дном пазухи и полостью носа сглажен при помощи бора. Таким же образом удален участок оссификации, исходящий из латеральной стенки ВЧП. Проведена правосторонняя эндоскопическая этмоидотомия (рис. 3). Средняя носовая раковина осмотрена интраоперационно и в связи с отсутствием признаков инвагинации опухоли в ее пределах сохранена. Передняя и верхняя стенки ВЧП были осмотрены с помощью угловой оптики, проведено удаление всей слизистой оболочки и коагуляция остатков в труднодоступных зонах радиоволновым методом монополярным электродом-шариком.
Общее время операции составило 86 минут. Общая кровопотеря – 270 мл. Во время операции отмечено кровотечение из нисходящей небной артерии на этапе удаления нижних отделов медиальной стенки ВЧП. Кровотечение было остановлено методом биполярной коагуляции.
Обсуждение
В представленном клиническом наблюдении пациентке с ИП правой половины носа, правой ВЧП и решетчатых пазух проведена эндоскопическая эндоназальная операция, включившая несколько этапов: удаление интраназальной части опухоли, эндоназальный эндоскопический модифицированный подход по Denker к ВЧП и эндоскопическая этмоидотомия. Среди перечисленных этапов особый интерес представляет эндоназальный эндоскопический модифицированный подход по Denker к ВЧП, предусматривающий удаление всей медиальной и части передней ее стенок, удаление опухолевой ткани, тотальное удаление слизистой оболочки ВЧП и диссекции участка оссификации в ее заднелатеральных отделах как наиболее вероятного локуса первичной инвагинации. Эта операция служит альтернативой как эндоскопическим методикам, например медиальной максиллэктомии, при которой широта открытия ВЧП значительно меньше, так и «открытым» вмешательствам, например традиционная операция по Denker, при которой в результате доступа под губой отмечается более длительный отек мягких тканей и нарушение чувствительности мягких тканей щеки. Кроме того, доступы к ВЧП через переднюю стенку могут стать причиной эстетического дефекта в результате сравнительно большого дефекта передней стенки. В последнее время предложены методики эндоскопического прелакримального подхода и их модификации [10, 11], разработанных с целью осуществления менее агрессивного подхода в отношении нижней носовой раковины, однако их эффективность нуждается в дальнейшем изучении. К ограничениям работы относится представление одного клинического наблюдения, поскольку в серии наблюдений возможна сравнительная оценка различных доступов.
Заключение
Планирование трансназальной операции начинается с установления клинического диагноза, подтвержденного в случаях подозрения на опухоль результатами гистологического исследования, анализа результатов необходимого метода визуализации и выбора адекватного доступа. Эндоскопический эндоназальный модифицированный по Denker доступ к ВЧП сопровождается возможностью прямой или опосредованной через угловую оптику визуализации всех стенок ВЧП, позволяет выполнять тотальное удаление опухоли и осуществлять безопасную контролируемую хирургию в аспектах кровопотери и повреждения критических сосудисто-нервных структур.


