Введение
Выбор фармакотерапии при ведении пациентов с хронической обструктивной болезнью легких (ХОБЛ) остается достаточно сложной задачей для практикующего врача, что во многом определяется многообразием клинических фенотипов заболевания. Терапевтическая стратегия при ХОБЛ предусматривает, что лечение должно быть направлено на снижение риска возникновения и тяжести обострений, а также на уменьшение влияния симптомов на повседневную активность пациентов [1]. Достижение указанных целей требует индивидуального подхода к выбору терапии с учетом особенностей течения заболевания. В 2019 г. на страницах Глобальной стратегии по диагностике, лечению и профилактике ХОБЛ (Global Initiative for Chronic Obstructive Lung Disease – GOLD) ведущими международными экспертами предложена концепция контроля ХОБЛ, призванная индивидуализировать лечение пациентов (рис. 1). Данная концепция предусматривает оценку степени выраженности симптомов ХОБЛ, частоты и тяжести обострений как показателей стабильности течения заболевания в результате проводимой терапии [2]. Следует отметить, что клинический контроль ХОБЛ в отличие от такового бронхиальной астмы (БА) не предполагает полного отсутствия симптомов у пациента и может определяться наименьшим количеством баллов по тесту оценки ХОБЛ (Chronic Obstructive Lung Disease Assessment Test – CAT) и/или модифицированной шкале одышки Британского совета медицинских исследований (modified British Medical Research Council Dyspnea Scale – mMRC), когда симптомы заболевания не ограничивают (или ограничивают минимально) повседневную активность больного. Кроме того, для определения клинического влияния симптомов ХОБЛ на пациента экспертами предложено использовать следующие клинические критерии: частота применения короткодействующих бронходилататоров (КДБД) для купирования симптомов, продолжительность повседневной физической активности, цвет и характер мокроты. При этом степень влияния проявлений заболевания на пациента соотносится с тяжестью течения ХОБЛ (см. таблицу).


Помимо клинических признаков ХОБЛ о стабильности течения заболевания свидетельствует отсутствие обострений (или развитие не более одного нетяжелого обострения в течение года), периодов значительного клинического ухудшения и/или наличие периодов улучшения (положительные изменения) [3]. Эксперты подчеркивают, что контроль ХОБЛ – динамическое понятие и эффективное ведение пациентов базируется на регулярной индивидуальной оценке выраженности симптомов и риска обострений, позволяющей определить дальнейшую стратегию ведения пациентов с учетом проводимой терапии [1]. В зависимости от степени контроля ХОБЛ объем фармакотерапии может быть сохранен, увеличен или уменьшен, кроме того, возможна замена ингалятора или препарата внутри одного класса лекарственных препаратов. Так, наименьшая выраженность симптомов и отсутствие обострений ХОБЛ свидетельствуют о наличии контроля над заболеванием, что позволяет сохранять существующую фармакотерапию. В отсутствие контроля рекомендуется проверить технику ингаляции препаратов и оценить приверженность пациента назначенному лечению. Широкое использование таких нефармакологических методов, как физическая активность, легочная реабилитация и программы самообразования, а также выявление и лечение сопутствующей патологии могут значительно повысить вероятность достижения и поддержания контроля ХОБЛ без изменения фармакотерапии. Наиболее частым вариантом ее коррекции будет наращивание объема (эскалация). В первую очередь речь идет об усилении бронходилатации путем назначения фиксированных комбинаций длительно действующих β2-адреноагонистов (ДДБА) и длительно действующих антихолинергических препаратов (ДДАХ). Необходимость применения комбинации ДДБА/ДДАХ определяет тот факт, что использование только одного механизма бронходилатации, реализуемого при назначении ДДБА или ДДАХ, для значительной части пациентов с ХОБЛ оказывается недостаточным. Доказано, что фиксированные комбинации ДДБА/ДДАХ демонстрируют терапевтические преимущества по сравнению с монотерапией бронходилататором в отношении влияния на легочную функцию, частоту обострений и такие симптомы заболевания, как одышка, потребность в КДБД, переносимость физической нагрузки. Помимо выраженной бронходилатации увеличению физической активности способствует и эффект дефляции, наблюдающийся при использовании ДДБА/ДДАХ [4]. В настоящее время в РФ зарегистрировано четыре фиксированных комбинированных препарата данного класса: вилантерол/умеклидиний (ВИ/УМЕК), олодатерол/тиотропий, индакатерол/гликопирроний для однократного применения и формотерол/аклидиний, режим дозирования которого предусматривает прием препарата 2 раза в сутки. Первым представителем фиксированных комбинаций ДДБА/ДДАХ на отечественном фармацевтическом рынке стал ВИ/УМЕК, оказывающий выраженное влияние на функцию дыхания и качество жизни пациентов с ХОБЛ [5]. В случае отсутствия контроля над заболеванием при использовании ДДБА/ДДАХ эксперты рекомендуют попытаться заменить ингаляционное устройство и/или молекулу внутри данного класса лекарственных средств, не прибегая к наращиванию объема терапии. Вместе с тем части пациентов с ХОБЛ требуется назначение противовоспалительных препаратов. Данная фармакологическая стратегия реализуется преимущественно путем назначения ингаляционных глюкокортикостероидов (ИГКС). Применение данных препаратов при стабильном течении заболевания осуществляется либо в виде фиксированных комбинаций с ДДБА (ИГКС/ДДБА; двойная терапия), либо при сочетании ИГКС/ДДБА с ДДАХ в рамках тройной терапии. «Классическими» представителями ИГКС/ДДБА являются широко используемые при лечении ХОБЛ салметерол/флутиказона пропионат и будесонид/формотерол (БУД/ФОРМ). Новым представителем фиксированных комбинированных препаратов ИГКС/ДДБА стал вилантерол/флутиказона фуроат (ВИ/ФФ). Помимо высокоселективного ДДБА вилантерола, вызывающего быструю и длительно сохраняющуюся бронходилатацию, препарат содержит флутиказона фуроат, обладающий выраженным противовоспалительным действием. Оба компонента ВИ/ФФ характеризуются 24-часовой активностью, что определяет возможность его однократного приема и выгодно отличает новый препарат от уже существующих фиксированных комбинаций ИГКС/ДДББА. В последние годы роль и место данных препаратов в лечении ХОБЛ стали предметом активной дискуссии. Основным терапевтическим преимуществом применения ИГКС/ДДБА является достоверное уменьшение частоты обострений ХОБЛ, сопровождающее их назначение [6]. Особо следует отметить влияние на частоту обострений заболевания комбинированного использования ИГКС/ДДБА и ДДАХ. Так, в ходе сравнительного исследования эффективности и безопасности комбинированной терапии БУД/ФОРМ и тиотропием при тяжелой ХОБЛ помимо благоприятного влияния тройной терапии на показатели легочной функции и качество жизни пациентов было показано снижение частоты тяжелых обострений заболевания на 62% по сравнению с таковой в группе пациентов, получавших монотерапию тиотропием [7]. Вместе с тем следует отметить, что терапевтическая эффективность ИГКС/ДДБА при ХОБЛ не всегда однозначна [8]. Кроме того, их применение при данном заболевании сопровождается повышением риска возникновения пневмоний [9]. В настоящее время выделен фенотип пациентов, для которых назначение ИГКС/ДДБА будет наиболее оправданным. Доказанным предиктором успешного применения данных препаратов при ХОБЛ служит количество эозинофилов крови. Было показано, что наибольшее влияние на частоту обострений заболевания отмечается при уровне эозинофилов крови вне обострения ≥300 кл/мк и, напротив, эффект от противовоспалительной терапии маловероятен при значении данного показателя <100 кл/мкл.
Эффективность препаратов при количестве эозинофилов крови от 100 до 300 кл/мкл в настоящее время остается недостаточно изученной [10]. Согласно современным подходам к лечению ХОБЛ, назначение ИГКС/ДДБА рекомендуется пациентам с высоким содержанием эозинофилов в крови и частыми обострениями на фоне монотерапии бронходилататором [11]. При наличии эозинофилии крови и сопутствующей БА ИГКС/ДДБА могут рассматриваться в качестве варианта стартовой терапии заболевания. Эскалация терапии до тройной (ДДБА/ДДАХ/ИГКС) показана при сохраняющихся выраженных симптомах ХОБЛ пациентам, принимающим ИГКС/ДДБА, и при повторных обострениях заболевания на фоне базисной терапии ДДБА/ДДАХ [1]. Успешной реализации данной фармакологической стратегии будет способствовать появление на отечественном фармацевтическом рынке фиксированных комбинаций ДДБА/ДДАХ/ИГКС в одном ингаляторе. В рамках предложенной концепции контроля ХОБЛ предусматривается и возможность уменьшения объема фармакотерапии (деэскалация) путем отмены ИГКС пациентам с редкими обострениями заболевания, низким уровнем эозинофилов крови и в отсутствие сопутствующей БА. Причиной отмены ИГКС могут служить нежелательные реакции, ассоциирующиеся с их приемом, и недостаточная эффективность препаратов [1]. С учетом невозможности полного восстановления функциональных показателей легочной вентиляции у пациентов с ХОБЛ объем бронходилатационной терапии уменьшать не рекомендуется.
Ниже рассмотрены клинические примеры ведения пациентов с недостаточным уровнем контроля ХОБЛ.
Клинический случай 1
Пациент Т. 1957 г. рождения. Обратился к пульмонологу с жалобами на одышку при физической нагрузке, снижение физической активности, кашель с отхождением умеренного количества вязкой слизистой мокроты, ощущение хрипов в грудной клетке в горизонтальном положении, на выраженную слабость и утомляемость.
В течение нескольких месяцев отмечает постепенное нарастание вышеуказанных симптомов. Потребность в применении КДБД (сальбутамол) возникает 3–4 раза в неделю. Степень выраженности одышки по шкале mMRC средняя (2 балла). При оценке выраженности симптомов по тесту оценки ХОБЛ (CAT) количество баллов составило 17.
В течение многих лет беспокоит продуктивный кашель, 5 лет назад появилась одышка при умеренной физической нагрузке, по поводу чего обратился за медицинской помощью. После проведенного обследования установлен диагноз ХОБЛ, назначена постоянная бронхолитическая терапия: тиотропий 18 мкг в сутки через ингалятор HandiHaler®. На фоне приема ДДАХ выраженность симптомов ХОБЛ уменьшилась. Вместе с тем в связи с сохраняющейся одышкой физическая активность пациента снизилась. В течение нескольких месяцев состояние ухудшилось: усилилась одышка при физической нагрузке, появились хрипы в грудной клетке в горизонтальном положении. Обострения заболевания отмечаются 1–2 раза в год, с целью купирования симптомов обострений принимает антибактериальные препараты (последний прием азитромицина – 3 месяца назад). Госпитализаций по поводу обострений ХОБЛ не было. В 2017 г. перенес внебольничную правостороннюю пневмонию.
Курил в течение 30 лет по 20 сигарет в день. Не курит с 2015 г. Аллергических реакций отмечено не было. В 2012 г. диагностирована гипертоническая болезнь, регулярно принимает лозартан 100 мг в сутки. В 2014 г. выполнена холецистэктомия.
При физическом осмотре состояние удовлетворительное. Рост – 172 см, вес – 95 кг. Насыщение гемоглобина артериальной крови кислородом (SaO2) в покое 96%. Тест с 6-минутной ходьбой (6МТ) – 480 метров, SaO2 во время теста – 94%. При перкуссии органов грудной клетки над всей поверхностью легких легочный звук. При аускультации легких дыхание жесткое, при форсированном выдохе выслушиваются единичные свистящие хрипы. Частота дыхательных движений (ЧДД) – 18 в минуту. При аускультации сердца ритм правильный, тоны приглушены. Частота сердечных сокращений (ЧСС) – 70 в минуту, артериальное давление (АД) – 120/75 мм рт.ст. Значимой патологии со стороны органов и систем не выявлено.
При гематологическом исследовании отклонений показателей от должных значений не выявлено, количество эозинофилов крови – 120 кл/мкл (2,1%).
При исследовании функции внешнего дыхания выявлены генерализованные нарушения вентиляционной функции легких по обструктивному типу средней степени тяжести (по классификации GOLD): объем форсированного выдоха за 1 секунду (ОФВ1) после применения бронхолитика (сальбутамол 400 мкг) составил 2,14 литра (68% от должного значения), соотношение ОФВ1 к форсированной жизненной емкости легких (ФЖЕЛ) – 55,2%. Бронходилатационный тест отрицательный (прирост ОФВ1 составил 150 мл, или 5%).
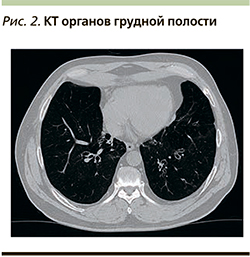 При компьютерной томографии (КТ) органов грудной клетки определяется неравномерная воздушность легочной ткани нижних долей обоих легких с наличием участков пневмосклероза и повышенной воздушности. В базальных сегментах обоих легких наблюдаются цилиндрические бронхоэктазы, некоторые из которых заполнены содержимым. В S5 справа определяется парамедиастинальная зона консолидации легочной ткани, на фоне которой прослеживаются просветы бронхоэктазов. Стенки бронхов утолщены (рис. 2).
При компьютерной томографии (КТ) органов грудной клетки определяется неравномерная воздушность легочной ткани нижних долей обоих легких с наличием участков пневмосклероза и повышенной воздушности. В базальных сегментах обоих легких наблюдаются цилиндрические бронхоэктазы, некоторые из которых заполнены содержимым. В S5 справа определяется парамедиастинальная зона консолидации легочной ткани, на фоне которой прослеживаются просветы бронхоэктазов. Стенки бронхов утолщены (рис. 2).
Cуществующий уровень контроля ХОБЛ признан недостаточным: несмотря на умеренные нарушения легочной вентиляции, симптомы заболевания, в первую очередь одышка, оказывают выраженное влияние на повседневную активность пациента. При КТ органов грудной полости определяются признаки повышения воздушности легочной ткани, что свидетельствует о наличии эмфиземы легких. Кроме того, выявлены бронхоэктазы, ассоциирующиеся с высокой вероятностью частых инфекционных обострений заболевания. Все указанные признаки свидетельствуют о необходимости увеличения объема проводимой терапии. Согласно существующим подходам к лечению ХОБЛ, приоритетным способом эскалации фармакотерапии в данной клинической ситуации является усиление бронходилатации путем назначения ДДБА/ДДАХ. Пациенту назначен ВИ/УМЕК в дозе 22/55 мкг 1 раз в сутки. Дополнительно с целью облегчения отхождения мокроты назначена муколитическая терапия.
Клинический случай 2
Пациент Л. 1958 г. рождения. Отмечает возникновение одышки при физической нагрузке (подъем по лестнице до 3-го этажа, быстрая ходьба), периодически беспокоит кашель с отхождением небольшого количества слизистой мокроты. Потребность в применении КДБД возникает 1–2 раза в месяц. Степень выраженности одышки по шкале mMRC низкая (1 балл). При оценке выраженности симптомов по тесту оценки ХОБЛ (CAT) количество баллов составило 10. Уменьшения повседневной активности не отмечает.
Диагноз ХОБЛ поставлен в 2008 г. В течение длительного времени принимает тиотропий, в настоящее время режим дозирования препарата – 5 мкг в сутки через ингалятор Респимат®. На фоне проводимой бронхолитической терапии сохраняются частые (2–3 раза в год) обострения заболевания, для купирования симптомов которых требуется назначение антибактериальных препаратов или системных ГКС. Предшествовавшее обострение ХОБЛ, сопровождавшееся применением преднизолона в дозе 30 мг в сутки внутрь, отмечено 4 недели назад. Госпитализаций не было.
Курил в течение 35 лет по 20 сигарет в день. Не курит с 2010 г. Аллергических реакций отмечено не было. Установлен диагноз «гипертоническая болезнь», с целью контроля АД регулярно принимает лизиноприл 5 мг 1 раз в сутки и бисопролол 2,5 мг 1 раз в сутки.
При физическом осмотре состояние удовлетворительное. Рост – 185 см, вес – 103 кг. SaO2 в покое – 97%. 6МТ – 600 метров, SaO2 во время теста – 96%.
При перкуссии органов грудной клетки над всей поверхностью легких легочный звук. При аускультации легких дыхание жесткое, хрипы не выслушиваются. ЧДД – 16 в минуту. При аускультации сердца ритм правильный, тоны ясные. ЧСС – 65 в минуту, АД – 135/75 мм рт.ст. Значимой патологии со стороны органов и систем не выявлено.
При гематологическом исследовании отклонений показателей от должных значений не выявлено, количество эозинофилов крови – 360 кл/мкл (5%).
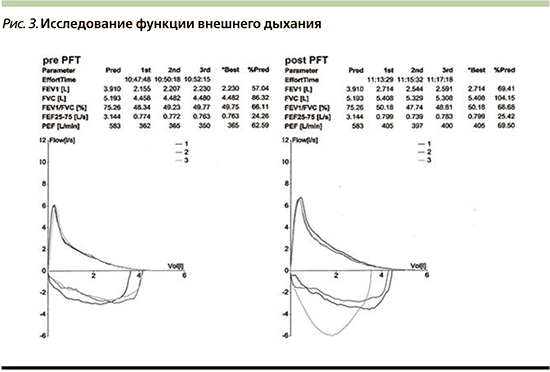
При исследовании функции внешнего дыхания выявлены умеренные генерализованные нарушения вентиляционной функции легких по обструктивному типу: ОФВ1 после применения бронхолитика (сальбутамол 400 мкг) составил 2,71 литра (69% от должного значения), ОФВ1/ФЖЕЛ – 50,1%. Результат бронходилатационного теста демонстрирует высокую обратимость бронхиальной обструкции: прирост ОФВ1 составил 480 мл, или 21% (при оценке результатов спирометрии особое внимание следует обратить на качество выполнения исследования: дыхательные маневры должны быть технически приемлемыми и воспроизводимыми (разница между двумя наибольшими значениями ФЖЕЛ и двумя наибольшими значениями ОФВ1 не должна превышать 150 мл; рис. 3).
При рентгеновском исследовании органов грудной полости очаговых и инфильтративных изменений не выявлено, легочный рисунок деформирован в нижне-базальных отделах с обеих сторон.
Таким образом, несмотря на незначительное влияние симптомов на повседневную активность пациента, проводимая терапия не обеспечивает достаточного уровня контроля ХОБЛ, о чем свидетельствуют сохраняющиеся частые обострения заболевания. Обращает внимание наличие у пациента выраженной обратимости бронхиальной обструкции и высокое содержание эозинофилов в крови. Согласно существующим рекомендациям [1, 11], в данной клинической ситуации (повторные обострения ХОБЛ на фоне монотерапии бронхолитиком у пациента с эозинофилией крови) объем терапии следует увеличить путем назначения ИГКС/ДДБА. Пациенту рекомендован прием ВИ/ФФ в дозе 22/92 мкг 1 раз в сутки.
Заключение
Разнообразие клинических фенотипов ХОБЛ, выраженная гетерогенность заболевания определяют необходимость индивидуального подхода к лечению пациентов. Инструментом для оптимизации выбора фармакотерапии, определения необходимости изменения ее объема может служить концепция контроля ХОБЛ, предусматривающая динамическую оценку степени выраженности симптомов, частоты и тяжести обострений как показателей стабильности течения заболевания в результате проводимого лечения. Приоритетной фармакотерапевтической стратегией при ХОБЛ является использование длительно действующих бронходилататоров, в первую очередь фиксированных комбинаций ДДБА/ДДАХ, обеспечивающих оптимальный контроль над симптомами и уменьшение частоты обострений заболевания у основной популяции пациентов. Вместе с тем при повторных обострениях ХОБЛ на фоне бронхолитической терапии следует рассматривать вопрос о включении в программу терапии заболевания ИГКС.


