Хорошо известно классическое определение внебольничной пневмонии (ВП) – это острое инфекционное заболевание, возникшее вне больничных условий либо в первые 48 часов пребывания в стационаре с момента госпитализации, которое проявляется симптомами инфекционного поражения нижних дыхательных путей и рентгенологическими признаками «свежих» очаговых и инфильтративных изменений в легких в отсутствие очевидной диагностической альтернативы. Тяжелая внебольничная пневмония (ТВП) – особая форма заболевания, которая проявляется выраженной дыхательной недостаточностью и/или признаками тяжелого сепсиса или септического шока, характеризуется плохим прогнозом и требует проведения интенсивной терапии. Объективная оценка тяжести состояния больного позволяет выявлять риски неблагоприятных исходов, осложнений и смерти, а также сводить к минимуму ненужные госпитализации, т.е. необходима для принятия решения о тактике ведения пациента и об оптимальном месте проведения терапии (на дому, в отделении общего профиля или отделении реанимации и интенсивной терапии – ОРИТ). Наибольшее распространение в мире получила шкала PORT (Pneumonia Outcomes Research Team), предполагающая определение 20 переменных, на основании которых устанавливается т.н. индекс тяжести пневмонии (PSI – pneumonia severity index), прогнозируется риск летального исхода и формулируются рекомендации по выбору места лечения и приоритетным направлениям эмпирической антимикробной терапии (АМТ). Шкала PSI включает демографические параметры, нахождение в доме престарелых, сопутствующие заболевания, физикальные характеристики и спектр биохимических показателей, определение которых затруднительно в амбулаторно-поликлинических учреждениях. Более простыми и доступными для рутинного использования являются прогностические шкалы CURB-65/CRB-65. Критерии CURB-65 включают 5 переменных, каждая из которых оценивается в 1 балл: нарушение сознания (С); мочевина >7 ммоль/л (U); частота дыхательных движений (ЧДД)≥30 в минуту (R); артериальное давление систолическое (САД)≤90 мм рт.ст. или диастолическое (ДАД)≤60 мм рт.ст. (B) и возраст ≥65 лет (65). Также существует упрощенная шкала без определения мочевины – CRB-65, учитывающая только физикальные параметры. На основании суммы набранных баллов решается вопрос о госпитализации пациента.
Шкалы CURB-65/CRB-65 имеют свои ограничения:
- не учитываются показатели, характеризующие дыхательную недостаточность (например, уровень сатурации);
- не учитываются сопутствующая патология и социальные факторы;
- недооценивается тяжесть состояния у пациентов до 65 лет с сопутствующими заболеваниями;
- недостаточная эффективность по выделению случаев ВП, требующей госпитализации в ОРИТ.
Шкала SMART-COP (Systolicblood-pressure – систолическое артериальное давление, Multilobarinfiltration – мультилобарная инфильтрация на рентгенограмме органов грудной клетки, Albumin – уровень альбумина, Respiratoryrate – частота дыхания,Tachycardia – частота сердечных сокращений – ЧСС>125/мин, Confusion – нарушение сознания, Oxygenation и pH) предусматривает балльную оценку клинических, лабораторных, физикальных и рентгенологических признаков, по сумме баллов которой решается вопрос о месте дальнейшего лечения пациента (0–1 балл – амбулаторное лечение; 2 – госпитализация в стационар; 3 балла и выше – госпитализация в ОРИТ; табл. 1).
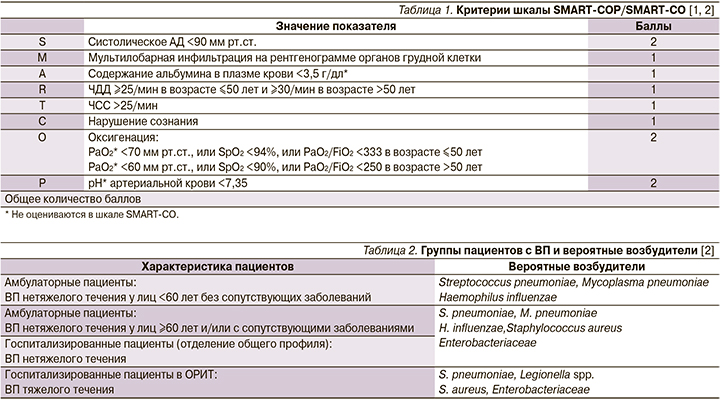
Модифицированный вариант шкалы SMRT-CО может использоваться в амбулаторной практике и приемных отделениях стационаров, т.к. не требует определения таких параметров, как уровень альбумина, PaO2 и pH артериальной крови.
Вне зависимости от того, какая система используется, эти объективные критерии всегда должны рассматриваться индивидуально в отношении каждого конкретного пациента с учетом факторов риска, сопутствующих заболеваний, уверенности в комплаенсе и медицинских ресурсах, доступных пациенту вне стационара [2–4]. Для определения необходимости госпитализации в ОРИТ лучше всего подходят критерии, предложенные Американским обществом инфекционных заболеваний (IDSA – Infectious Diseases Society of America) и Американским торакальным обществом (ATS – American Thoracic Society) – наличие одного «большого» критерия: выраженная дыхательная недостаточность (ДН), требующая искусственной вентиляции легких, или септический шок с необходимостью введения вазопрессоров, или трех «малых» критериев: ЧДД=30 в минуту, РаО2/FiO2 ≤250, мультилобарная инфильтрация, нарушение сознания, уремия (остаточный азот мочевины ≥20 мг/дл), лейкопения (лейкоциты <4×109/л), тромбоцитопения (тромбоциты <100×1012/л), гипотермия (<36◦C), артериальная гипотензия, требующая интенсивной инфузионной терапии [2–4].
Факторы, влияющие на этиологию и риски заболеваемости ВП
Важными определяющими факторами в этиологии ВП являются возраст, сопутствующие заболевания, а также предшествовавшая антибактериальная терапия (АБТ) в течение последних 3 месяцев и/или предшествовавшие обращения за медицинской помощью в течение 6 месяцев. Именно эти особенности способны влиять на спектр возбудителей (табл. 2) и, соответственно, на эмпирический выбор стартовой АМТ.
Среди больных ВП необходимо выделить следующие категории пациентов, требующих модифицированного подхода к диагностике и лечению [5]:
- больные пожилого и старческого возраста;
- больные с недостаточной массой тела либо имеющие вредные привычки (курение, злоупотребление алкоголем, наркомания);
- пациенты с наличием коморбидности;
- больные с высоким риском антибиотикорезистентности.
Уровень распространенности ВП и летальности выше у пожилых пациентов по сравнению с более молодым населением и будет увеличиваться с учетом старения населения в развитых странах. Пневмония у лиц старше 60 лет обычно развивается в условиях измененной легочной ткани, нарушенных вентиляции и перфузии, обусловленных не только возрастной инволюцией, но и коморбидностью. К морфофункциональным инволютивным изменениям бронхолегочной системы относятся снижение объема и силы сокращений дыхательной мускулатуры, снижение эластичности легочной ткани и реберного каркаса, перестройка сосудистого компонента, деформация позвоночника, что существенно влияет на функцию дыхания. Пневмония у лиц пожилого возраста часто протекает на фоне сопутствующих заболеваний – нередко в стадии декомпенсации, имеет скудную или атипичную клиническую картину, что затрудняет ее своевременную диагностику, задерживает назначение антимикробных препаратов (АМП) и ухудшает прогноз. Разумеется, у любого пациента, но в большей степени у людей преклонного возраста маскировать клинические проявления пневмонии способна фоновая патология, чаще всего бронхообструктивные заболевания: хроническая обструктивная болезнь легких (ХОБЛ) и бронхиальная астма (БА); ишемическая болезнь сердца (ИБС) и хроническая сердечная недостаточность (ХСН); заболевания печени, почек, злокачественные новообразования, декомпенсированный сахарный диабет (СД). К развитию пневмонии также предрасполагают острые нарушения мозгового кровообращения, когнитивные расстройства, сенильная деменция, аспирация желудочного содержимого при поперхивании, эндотрахеальная интубация, зондовое питание, угнетение кашлевого рефлекса, гастроэзофагеальная рефлюксная болезнь и злоупотребление алкоголем. Еще одним фактором риска является прием препаратов, способствующих микроаспирации (седативные, миорелаксанты, наркоз, ингибиторы протонной помпы) и прием препаратов, вызывающих иммуносупрессию (глюкокортикоиды, цитостатики, ингибиторы фактора некроза опухоли). Частые госпитализации, предшествовавшее использование АМП, повышают риск наличия полирезистентных микроорганизмов. К дополнительным факторам инфицирования нижних дыхательных путей относится аспирация из полости рта содержимого с измененным видовым составом микробной флоры при заболеваниях пародонта, кариозных зубах, когда начинают преобладать аэробные грамотрицательные энтеробактерии и золотистый стафилококк [6].
С одной стороны, риски возникновения ВП увеличиваются при наличии коморбидности, с другой – пневмония, как и любой иной инфекционный процесс, способна отягощать и декомпенсировать сопутствующие заболевания, увеличивая летальность (табл. 3), что, по-видимому, связано с влиянием инфекционных токсинов, повышением уровня воспалительных цитокинов, усилением перекисного окисления липидов, интоксикацией, способной приводить к прогрессированию эндотелиальной дисфункции и дестабилизации атеросклеротических бляшек, а также повышению агрегации тромбоцитов [7–9].

Связь между сопутствующими заболеваниями и риском ВП отражена практически во всех руководствах по лечению пневмонии. Отягощенный анамнез по респираторным заболеваниям ассоциировался с повышенным риском ВП. Так, пациенты с хроническими респираторными заболеваниями, включая ХОБЛ, бронхит или БА, имели соответственно двукратное или четырехкратное увеличение риска ВП [11]. Хронические сердечно-сосудистые заболевания увеличили риск ВП в 3 раза, а цереброваскулярная болезнь/инсульт и слабоумие приблизительно удваивали эти риски (табл. 4). Данные нескольких исследований показали, что СД ассоциировался с умеренным увеличением риска ВП: ОШ=1,43 (1,11–1,92) до 1,54 (1,44–1,65) [12], рак также способен повышать риски развития ВП: ОШ=1,42 (1,04–1,92) и 1,70 (1,58–1,82) [12]. Хроническая болезнь печени или почек увеличивают риск ВП примерно в 2 раза [12, 13].

Таким образом, пневмония и фоновая патология являются взаимоотягощающими факторами, что диктует необходимость решать в стратегии ведения таких пациентов сразу две задачи: адекватное применение АМП и коррекцию декомпенсированных сопутствующих заболеваний.
Выбирая стартовую АБТ, мы обращаемся к международным и национальным рекомендациям, в основе которых лежат эпидемиологический анализ и результаты рандомизированных клинических исследований (РКИ). Однако возможность использования рекомендаций в клинической практике лимитирована рядом факторов: во-первых, однородность исследуемых групп в РКИ ограничивает включение пациентов с сопутствующей патологией, во-вторых, региональные или локальные особенности резистентности инфекционных агентов, что в совокупности может значительно повлиять на эффективность рекомендуемой терапии. Все вышеизложенные факты способствуют тому, что сегодня мы стали чаще использовать комбинации антибиотиков, вынуждены проводить смену АМТ, увеличивать дозу и длительность приема в рамках рекомендаций (табл. 5).
В 2012 г. вышли первые Российские национальные рекомендации по Стратегии Контроля Антимикробной Терапии (СКАТ) в стационарах России, в 2016 г. они были пересмотрены и усовершенствованы.
В этих рекомендациях основное значение при выборе АМП отведено стратификации пациента по риску наличия резистентных возбудителей:
- внебольничные инфекции без факторов риска полирезистентных возбудителей – тип I;
- внебольничные инфекции с факторами риска полирезистентных возбудителей – тип II;
- нозокомиальные инфекции – тип III (разделены на 2 подтипа в 2016 г.):
- IIIa – вне ОРИТ без предшествовавшего применения АБТ;
- IIIb – длительная госпитализация (более 7 дней) и/или нахождение в ОРИТ (более 3 дней), и/или предшествовавшее применение АБТ;
- нозокомиальные инфекции с риском инвазивного кандидоза – тип IV.
Стратификация пациентов по группам риска в зависимости от возраста, сопутствующих заболеваний, предшествовавшей АМТ, контакта с лечебными учреждениями вместе с определением эпидемиологической ситуации для каждого отделения позволяет создавать локальные протоколы стартовой эмпирической АМТ не только на госпитальном, но и на амбулаторном этапе. Таким образом, для решения вопроса о выборе АМП необходимо также учитывать локальную эпидемиологическую ситуацию.
Обратной стороной терапевтической эффективности АМТ могут быть риски развития нежелательных побочных реакций (НПР) и межлекарственных взаимодействий. По статистике, в РФ при анализе 1000 спонтанных сообщений о НПР 25% приходится на АМП [19]. Вероятность развития побочных эффектов АМП возрастает в связи с недооценкой анамнеза (непереносимость различного класса антибиотиков), нарушением элиминации АМП (функциональные нарушения почек у пожилых или хроническая болезнь почек). Возрастает также риск лекарственных взаимодействий среди больных, получающих различные медикаменты по поводу сопутствующей патологии (табл. 6).

При проведении любой терапии, в т.ч. и антимикробной, необходимо учитывать фармакокинетические характеристики применяемых препаратов и возможные межлекарственные взаимодействия с участием цитохрома Р450 и Р-гликопротеина. Некоторые АМП являются субстратами для изоферментов цитохрома Р450 и в то же время сами способны либо ингибировать, либо индуцировать те же изоферменты. В кишечнике Р-гликопротеин выполняет роль насоса, отвечающего за эффлюкс лекарственных препаратов в просвет кишечника; в почках и желчных путях способствует их экскреции. Ингибиторы Р-гликопротеина при их совместном применении с препаратами-субстратами этого белка усиливают всасывание, ограничивают распределение и замедляют экскрецию последних, что приводит к увеличению плазменных концентраций. Обратный эффект оказывают индукторы Р-гликопротеина. Ингибирование микросомальных ферментов и Р-гликопротеина обычно носит конкурентный характер и является дозозависимым процессом, который развивается достаточно быстро – практически после первого прима ингибитора, поэтому не следует рассчитывать, что короткий курс приема АМП позволит избежать межлекарственных взаимодействий. Для предотвращения НПР, обусловленных межлекарственными взаимодействиями, дозу метаболизируемого лекарственного средства необходимо уменьшать либо увеличивать интервал между введениями. Прогнозирование межлекарственных взаимодействий АМП с другими лекарственными средствами чрезвычайно важно для пациентов с сопутствующей патологией, которым необходима терапия антикоагулянтами, сердечными гликозидами, противоопухолевыми, психотропными, противогрибковыми препаратами, ингибиторами протонной помпы и т.д. Так, например, необходимо учитывать, что совместное применение макролидов с антикоагулянтами (варфарином) способно увеличивать риски кровотечения (ингибирующее влияние макролидов на CYP3A4), те же механизмы работают и в отношении новых антикоагулянтов; ингибирующее влияние макролидов на Р-гликопротеин приводит к увеличению концентрации дигоксина при их совместном применении, рифампицин хорошо известен как мощный индуктор большинства цитохромов, ответственных за метаболизм ЛС. Ознакомиться с межлекарственными взаимодействиями можно в специальных справочниках или в интернет-ресурсах (табл. 7) [33, 34].

Исследование фармакокинетических профилей левофлоксацина у пациентов с ВП
Для изучения взаимодействия левофлоксацина и препарата сухого экстракта зверобоя продырявленного на пациентах с нетяжелой ВП проведено фармакокинетическое исследование, выполненное в два этапа.
На первом этапе у здоровых добровольцев (5 мужчин и 5 женщин, возраст – 37±6,5 лет) изучалась фармакокинетика воспроизведенного левофлоксацина, принятого в дозе 500 мг до и после 7-дневного приема стандартизированного сухого экстракта зверобоя в дозе 850 мг/сут в виде капсул. Для второго этапа отбирались пациенты с клинико-рентгенологической картиной ВП нетяжелого течения, которые не получали АБТ и каких-либо препаратов по поводу сопутствующих заболеваний на догоспитальном этапе. Научно-исследовательская работа была одобрена ЛЭК при ГБУЗ ГКБ им. И.В. Давыдовского ДЗМ. Были включены 18 пациентов, возраст – 42±16,2 года, из них 8 мужчин и 10 женщин. Перед исследованием все участники подписали информированное согласие на проведение фармакокинетического исследования. По показаниям, с целью коррекции эмоционального фона, 10 больных применяли препарат растительного происхождения, содержащий стандартизированный сухой экстракт зверобоя продырявленного в дозе 850 мг/сут. Фармакокинетические кривые представлены на рис. 2 и 3.
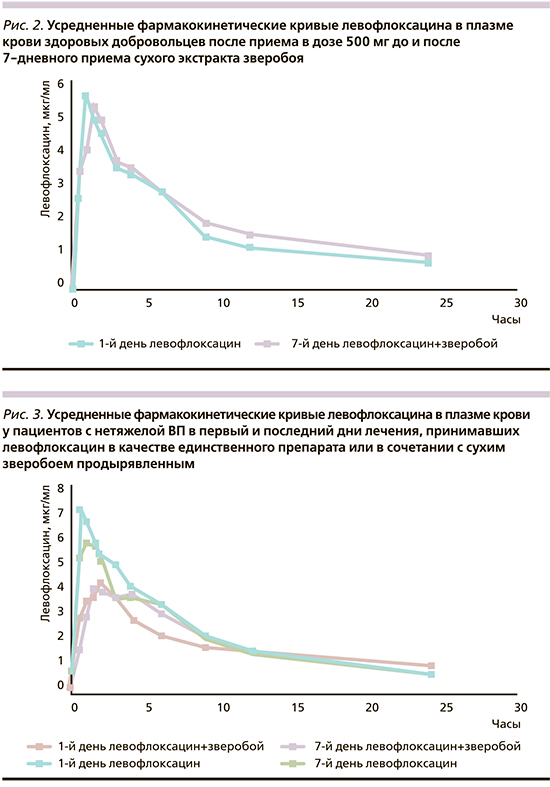
Анализ усредненных фармакокинетических кривых (рис. 2) показал, что профили практически совпадают и статистически достоверно не различаются (р>0,05) после приема левофлоксацина (500 мг) у здоровых добровольцев до и после 7-дневного приема сухого экстракта зверобоя продырявленного. Максимальный уровень концентрации достигался через 1,0–1,5 часа и составил 5,63±2,81 и 5,23±0,57 соответственно, что согласуется с литературными данными [35, 36].
У пациентов с нетяжелой ВП, принимавших левофлоксацин, на 7-й день наблюдалась тенденция к снижению максимальной концентрации препарата в плазме крови (рис. 3), при этом наблюдались статистически значимые различия (р<0,05). При приеме пациентами левофлоксацина в сочетании с сухим зверобоем продырявленным значение максимальной концентрации статистически достоверно уменьшалось (р<0,05) и в 1-й и на 7-й день приема при сохраняющихся фармакодинамических эффектах.
Таким образом, применение препаратов, содержащих экстракт зверобоя продырявленного, препятствует повышению максимальной концентрации левофлоксацина у пациентов с воспалительными заболеваниями нижних дыхательных путей, что требует комплексной клинической оценки данного феномена и повышенной настороженности при сборе медицинского анамнеза.
Обсуждение
В нашем исследовании у здоровых добровольцев профили фармакокинетических кривых левофлоксацина до и после приема препарата зверобоя продырявленного не различались, что в дальнейшем послужило основанием для совместного использования этих препаратов пациентами. В ходе исследования были получены статистически достоверные фармакокинетические различия при приеме левофлоксацина в комбинации со зверобоем и без него у пациентов с ВП, которые сохранялись на протяжении всего исследования. Левофлоксацин не метаболизируется с помощью изоферментов цитохрома Р450 и не является ингибитором его изоформ, но Р-гликопротеин является его субстратом. Вероятной причиной полученных результатов послужила индукция Р-гликопротеина гиперфорином, содержащимся в зверобое продырявленном, что привело к снижению концентрации левофлоксацина в крови у пациентов с ВП [3, 38]. Клинико-рентгенологическое разрешение пневмонии было достигнуто в одинаковые сроки в обеих группах пациентов независимо от совместного приема левофоксацина и зверобоя продырявленного.
Заключение
Во всех рекомендациях выделяются клинические ситуации, когда изменяется обычный спектр возбудителей пневмонии и, соответственно, возникает необходимость в модификации подходов к эмпирической терапии. Если учитывать ряд факторов, таких как локальные особенности микробного пейзажа, наличие или отсутствие коморбидности, возможно назначать антибиотик более избирательно с учетом стратификации по факторам риска, что является наиболее рациональным с микробиологической и клинической точек зрения. Назначая АМП, важно учитывать клинически значимые межлекарственные взаимодействия, которые могут как быть причиной развития НПР, так и полностью нивелировать ожидаемые терапевтические эффекты.


