Введение
Актуальность реабилитации детей с позвоночно-спинномозговой травмой (ПСМТ) обусловлена неуклонным ростом числа пациентов этой группы.
В России количество взрослых инвалидов с последствиями ПСМТ ежегодно увеличивается на 7000–8000 человек [1]. ПСМТ у детей встречается гораздо реже, чем у взрослых, но их реабилитация сложнее вследствие возрастных особенностей. Эпидемиологические исследования ПСМТ у детей в России не проводились. По данным НИИ неотложной детской хирургии и травматологии, повреждения позвоночника у детей составляют от 1,5 до 3% всех повреждений опорно-двигательного аппарата. Травмы спинного мозга и его корешков встречаются в 4–14% случаев всех травм позвоночника у детей [2].
ПСМТ – сложный комплекс структурно-функциональных изменений центральной и периферической нервной системы, запускающий каскад морфологических изменений мышечной ткани в виде атрофии волокон I и II типов скелетных мышц, потери контрактильных белков и уменьшения окислительной ферментативной активности. Это в свою очередь приводит к развитию гипотрофии, а затем к атрофии мышц и как следствие – к снижению мышечной силы и выносливости [3]. При обследовании через 6 недель после травмы у 18–44% взрослых пострадавших выявлено снижение площади поперечного сечения мышц ниже уровня поражения [4].
Основные причины потери мышечной массы у пациентов с ПСМТ: гиперкатаболизм острого периода, нарушение проводимости по спинному мозгу и его корешкам ниже уровня поражения, гипостатическое положение, отсутствие активной двигательной нагрузки, феномен «non-use». Гиперметаболизм острого периода тяжелой травмы запускает каскад патологических процессов, приводящих к нутритивной недостаточности, что в свою очередь способствует развитию вторичного иммунодефицита и инфекционных процессов, дистрофических нарушений в органах и тканях, органной дисфункции [5].
Наиболее доступными анаболическими факторами, способствующими снижению катаболизма у пациентов, перенесших критическое состояние, являются адекватная нутритивная поддержка и аэробные физические нагрузки. При аэробных нагрузках в организме действует аэробный или кислородный механизм энергообеспечения, являющийся энергетически менее затратным и способствующим сохранению кислотно-щелочного равновесия [6].
По данным ВОЗ, физическая активность определяется как любое телесное движение, создаваемое скелетными мышцами, требующее затрат энергии. Гипостатическое положение ребенка после травмы усугубляет имеющиеся функциональные изменения со стороны всех органов и систем, способствует развитию метаболических нарушений: мышечной гипотрофии, ожирению, остеопорозу с угрозой возникновения впоследствии патологических переломов. Все это приводит к снижению толерантности к физической нагрузке (ТФН), степень которого напрямую коррелирует с тяжестью течения основного заболевания.
В последнее десятилетие многие исследователи пришли к мнению, что начинать реабилитационные мероприятия после ПСМТ нужно как можно раньше – лучше сразу после стабилизации витальных функций пациента в целях предотвращения развития феномена «non-use» (неиспользования), который наряду с проявлениями самой травмы служит дополнительной причиной развития как функциональных, так и (со временем) органических нарушений [7, 8].
Для того чтобы максимально сохранить угасающие естественные двигательные функции, не дать сформироваться патологическим двигательным стереотипам и вторичным соматическим осложнениям, существует ограниченный временной промежуток (узкий адаптивный коридор). Согласно литературным данным, у взрослых пациентов с угрозой формирования саркопении адекватная физическая нагрузка в пределах аэробного коридора на фоне субстратного обеспечения белковых потерь способствует сохранению мышечной массы [9].
Основным критерием дозирования физических нагрузок в системе подготовки спортсменов служит определение ТФН, а основным критерием оценки эффективности физического воспитания является характер ответной реакции на нагрузку и результативность. С помощью функциональных проб можно выявить не только функциональные особенности, но и отклонения от нормы, т.е. скрытые пред- и патологические состояния [10].
Еще несколько десятилетий назад для определения эффективности влияния физических упражнений на организм пациента использовались только антропометрические измерения, динамометрия, гониометрия, миотонометрия и др. [11]. Сейчас помимо перечисленных методов для учета функционального состояния организма под влиянием физических упражнений применяются специфические функциональные пробы и двигательные тесты: субъективные шкалы (Шестибалльная шкала оценки мышечной силы L. Mcpeak, 1996, М. Вейсс, 1986; Шкала оценки мышечной силы Harrison) и др. Кроме того, в настоящее время существует достаточно большое количество методов оценки ТФН, среди которых наиболее популярные тест с 6‑минутной ходьбой, тредмил-тест и велоэргометрия. Однако имеются ограничения в использовании этих методов пациентами с последствиями ПСМТ в силу двигательного дефицита, который не позволяет проводить обследование в полном объеме и объективно оценить ТФН.
Еще в 1929 г. Гиллом определено, что способность мышц к выполнению механических усилий может быть оценена с помощью измерения количества кислорода, поглощенного ими в процессе выполнения работы. Для определения ТФН в кардиологии и спортивной медицине используется нагрузочное тестирование под контролем эргоспирометрии [12]. Пиковое потребление кислорода (maxVO2), измеренное во время сердечно-легочных нагрузочных тестов, признано в качестве общего показателя кардиореспираторного состояния здоровья [13].
Методика определения потребления кислорода основана на выполнении пациентом дозированной физической нагрузки, во время которой проводится измерение концентрации кислорода во вдыхаемом воздухе и углекислого газа в выдыхаемом. Изменение поглощения кислорода линейно связано с интенсивностью выполняемой работы в единицу времени до достижения уровня (maxVО2). Снижение потребления кислорода на фоне дальнейшего увеличения нагрузки служит показателем достижения анаэробного порога и косвенным критерием достижения максимальных возможностей пациента [14].
Травма спинного мозга приводит к значительному снижению активной мышечной массы ниже уровня поражения, и при тестировании активной двигательной нагрузки потребление кислорода значимо меньше, чем у здорового человека [15]. По сравнению с малоподвижными, но в остальном здоровыми взрослыми людьми (например, ампутантами) у взрослых пациентов с последствиями ПСМТ анаэробный порог и уровень пикVО2 ниже на 25% [13].
Обязательное условие ранней двигательной реабилитации: дозированность усилий, недопустимость утомления и перетренированности, постепенное увеличение нагрузок. Чрезмерная двигательная нагрузка может усугублять метаболические нарушения в сторону катаболизма, способствуя истощению функциональных систем энергообеспечения организма [15].
Реабилитационные мероприятия наиболее эффективны в первые 6 месяцев после травмы [16]. Соответственно, существует узкий временной промежуток для того, чтобы предотвратить вторичные осложнения, максимально полно восстановить естественные двигательные функции, не дать сформироваться патологическим двигательным стереотипам.
Для составления индивидуальной двигательной программы необходимо определить количество нагрузки, которое пациент может переносить с учетом особенностей травмы, а также продолжительность нагрузки во время одного или нескольких занятий в течение дня как по объему, так и по интенсивности [17].
Пациенты с повреждением спинного мозга могут расширить двигательную активность только за счет усиления нагрузки на мускулатуру выше уровня поражения, а это значительно увеличивает риск травмы опорно-двигательного аппарата [18]. Получить объективную информацию о ТФН можно с помощью эргоспирометрического исследования. Это позволяет определить время начала реабилитационных мероприятий и безопасный адаптивный коридор, выявить индивидуальные пределы физической нагрузки, оценить эффективность выполненной реабилитационной программы [19]. Эргоспирометрия все чаще используется в широком спектре клинических исследований для объективной оценки функциональных возможностей и для раннего выявления переутомления [20].
Нарушение вегетативной иннервации вследствие травмы спинного мозга служит причиной развития брадикардии, поэтому частота сердечных сокращений не может служить достоверным критерием достижения анаэробного порога. Следовательно, для оценки интенсивности двигательной нагрузки необходим более сенситивный показатель [13].
Цель исследования: изучить возможность персонализации программы двигательной реабилитации у детей с тяжелой позвоночно-спинномозговой травмой на основании оценки толерантности к физической нагрузке.
Методы
В исследование были включены 25 пациентов с ПСМТ (10 девочек и 15 мальчиков) в возрасте от 6 до 18 лет, поступивших в НИИ НДХиТ в 2015–2017 гг. Средний возраст детей составил 12,1±5,0 лет.
В зависимости от уровня поражения спинного мозга и неврологического дефицита пациенты были разделены на две группы (табл. 1).

Первоначально участниками исследования были включены 28 пациентов с изолированной ПСМТ в возрасте от 2 до 18 лет. В зависимости от уровня поражения спинного мозга и неврологического дефицита они были разделены на три группы по уровню поражения (шейный, грудной, пояснично-крестцовый).
Однако после тестирования из обработки материалов решено было исключить одного пациента с тетраплегией, поскольку проведение теста с активной двигательной нагрузкой на верхние конечности было невозможно и результаты не были достоверными. Кроме того, были исключены 2 пациента в возрасте до 5 лет в связи с невозможностью адекватно выполнять требования тестов. А пациенты II и III групп были объединены в одну группу по неврологическому дефициту, и на тестировании нагрузки на верхние конечности это не отражалось.
Неврологическая оценка осуществлялась по шкале ASIA, предложенной Американской ассоциацией травмы спинного мозга и являющейся международным стандартом неврологической и функциональной классификации повреждений спинного мозга. Оценивались мышечная сила, болевая и тактильная чувствительность, рефлекторная активность в аногенитальной зоне.
Двигательная функция оценивалась проверкой силы 10 контрольных групп мышц, соотнесенных с сегментами спинного мозга по 6-балльной системе: от 0 – полный паралич до 5 – движения против полного сопротивления. Максимальное значение – 100 баллов.
Оценка чувствительности проводилась в 28 сегментах с двух сторон по 3-балльной системе: 0 – отсутствие, 1 – нарушенная, 2 – нормальная, расстройства чувствительности в аногенитальной зоне (да/нет). Максимальное значение для болевой и тактильной чувствительности – 112 баллов.
Для оценки качества жизни использовалась функциональная оценочная шкала для больных с травмой спинного мозга (Valutazione Fuczionale Mielolesi – VFM). Тестировалось выполнение пациентами заданий (всего – 61), разделенных на 8 блоков: перемещение в постели (5), прием пищи (6), перемещение вне постели (12), пользование креслом-коляской (4), начало движения (10), личная гигиена (7), одевание (8), социальные навыки (9). Выполнение каждого из заданий оценивалось по 5-балльной системе: 1 балл – больной не может выполнить задание и полностью зависим от окружающих, 5 баллов – больной может выполнить задание без затруднений и не требует никакой помощи.
Все пациенты участвовали в 25-дневной программе двигательной реабилитации.
До начала и по окончании реабилитационных мероприятий проведено исследование всех детей на предмет трофологического статуса: антропометрическое обследование (длины тела при помощи горизонтального ростомера, веса с использованием подкроватных весов), расчет индекса массы тела (ИМТ) по формуле Т. Дж. Коула.
Энергозатраты определены методом непрямой калориметрии с использованием газоанализатора Quark RMR.СРЕТ.
Исследование ТФН проведено дважды: перед назначением реабилитационных мероприятий и перед выпиской пациента через 23 дня под контролем эргоспирометрии с использованием газоанализатора Quark RMR СРЕТ.

В исследовании оценивались величина maxVO2 в мл/кг в минуту и дыхательный коэффициент (RQ), время достижения анаэробного порога (VCO2/VO2 >1,0), а также время восстановления всех параметров до исходного состояния. С учетом разного возраста пациентов, массы тела и физической подготовки для объективного анализа полученных данных мы использовали показатели потребления кислорода в мл/кг веса в минуту. Перед каждым исследованием, согласно инструкции производителя, проведена калибровка модуля.
Тестирование проводилось в трех режимах: I – в покое (рис. 1), II – при пассивной нагрузке (рис. 2, 4), III – при активной работе (рис. 3, 5). Исследование проводилось в положении лежа с использованием маски.
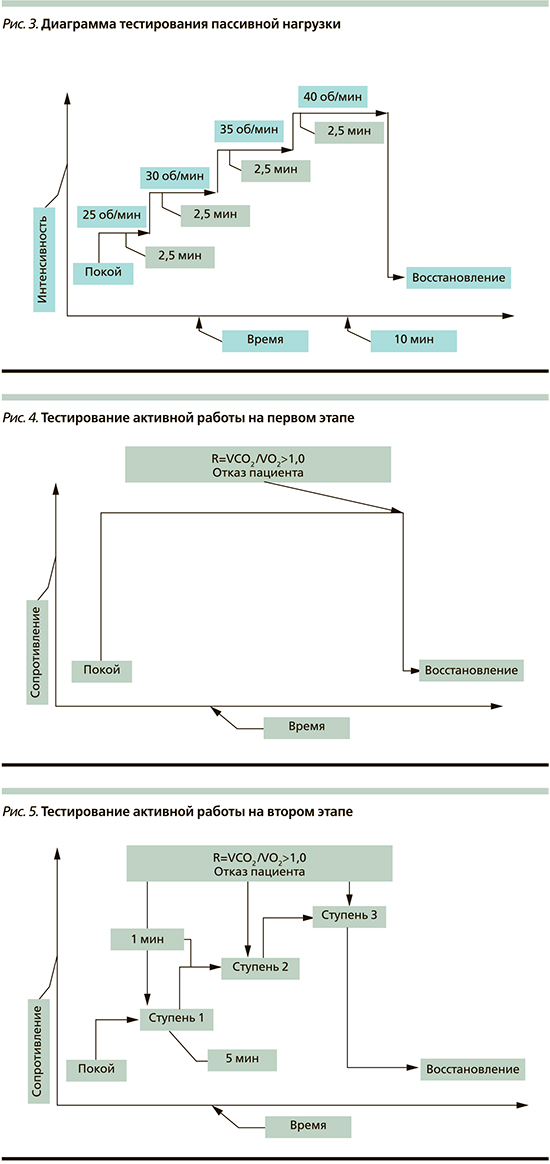
Пассивная нагрузка выполнялась механотренажером Moto-med со ступенчатым увеличением электромотором скорости движения педалей на 5 оборотов в минуту каждые 2,5 минуты в течение 10 минут в исходном положении «лежа на спине» (рис. 2)
Диаграмма работы в этом режиме представлена на рис. 3.
Активная работа выполнялась в два этапа. Первым этапом предлагалось упражнение «сгибание и разгибание верхних конечностей в плечевых суставах» с максимально возможной для пациента скоростью (рис. 4) до достижения аэробного порога или отказа пациента. Также проведена временная оценка аэробного коридора.
Вторым этапом предлагалась ступенчато нарастающая нагрузка с использованием отягощения. Во время тестирования использовались упражнения на верхние конечности: «на счет раз согнуть руки в локтевых суставах ладонями к плечам; на счет два разогнуть руки в локтевых и плечевых суставах перед грудью; на счет три согнуть руки в плечевых и локтевых суставах ладонями к плечам; на счет четыре разогнуть руки в локтевых суставах и вернуться в исходное положение. Пациенту давалась словесная инструкция выбрать для себя комфортный темп выполнения упражнения. Во время выполнения первой ступени использовались утяжелители массой 0,5 кг, закрепленные на запястьях ребенка, затем каждую ступень отягощение увеличивалось на 0,5 кг вплоть до 2 кг на четвертой ступени. Выполнение каждой ступени нагрузочного тестирования длилось 5 минут, отдых между ступенями составил 1 минуту (рис. 5).
Условием прекращения тестирования являлось достижение анаэробного порога (дыхательный коэффициент RQ=VCO2/VO2 >1,1) или отказ пациента от дальнейшей работы. На основании полученных во время тестирования данных (maxVO2 и времени достижения анаэробного порога) рассчитывались режимы работы и отдыха.
Перед проведением тестирования пациентов просили воздержаться от еды и питья чая или кофе в течение не менее двух часов до исследования. Обязательным условием начала теста было опорожнение мочевого пузыря во избежание boosting-синдрома (англ. «повышение давления»).
Продолжительность исследования: 25-дневная программа двигательной реабилитации. Тестирование проводилось на 2-й и 23-й дни программы.
На основании полученных данных составлялась индивидуальная программа двигательной реабилитации пациента. Учитывая низкие функциональные возможности пациентов при первичном тестировании моторная плотность занятия была низкой, использовались упражнения малой интенсивности с включением небольшого количества мышечных групп, преимущественно плечевого пояса и верхних конечностей. Дыхательные упражнения в соотношении 2:1.
В качестве основных служили следующие исходные положения: «лежа на спине», «лежа на боку», «лежа на животе», «лежа на животе, стоя на локтях», «стоя с фиксацией на поворотном столе». Темп выполнения упражнений был средним или медленным. Занятие проводилось интервальным методом с чередованием работы и отдыха, с постепенным увеличением интенсивности активной фазы. Пассивная часть занятий представляла собой обучение родителей лечебным укладкам, применение аппаратных технологий в пассивном режиме: стимуляция подошвенной зоны стоп с помощью имитатора опорной нагрузки «Корвит» в течение 15–20 минут ежедневно; тренировка с помощью прикроватного тренажера с электродвигателем 30 минут 2 раза день утром и вечером; пассивная вертикализация на поворотном столе в течение 20–30 минут 2 раза в день утром и вечером.
По мере роста функциональных возможностей пациента изменялась моторная плотность занятий за счет увеличения активной работы. Количество и качество исходных положений изменялось в сторону увеличения активного сопротивления гравитации, уменьшения площади опоры, постурального контроля (сидя, коленно-ладонная стойка, стойка на коленях у опоры, стоя в коленном упоре с самостоятельным удержанием корпуса). Пассивная часть представляла собой сенсомоторную стимуляцию на роботизированных комплексах с биологической обратной связью (Locomat, Pablo, Amadeo) и CPN-тренировку с помощью прикроватного тренажера с электродвигателем по 30 минут 2 раза день утром и вечером.
На протяжении всего реабилитационного курса проводилась коррекция трофологического статуса дотацией сипингов к основному рациону.
Статистическую обработку данных проводили с помощью компьютерной программы Statistica v.6.0 Stat.Soft.Inc. Использовали вычислительные и графические возможности редактора электронных таблиц Excel. Данные проверялись на соответствие нормальному закону распределения с помощью тестов Lilliefors и Shapiro-Wilk’sWtest. Применяли дисперсионный анализ, t-критерий Стьюдента, непараметрические тесты: критерий знаков и парный тест Wilcoxon. При всех видах статистического анализа различия считались достоверными на уровне значимости р<0,05. Данные представлены в виде средних значений ±стандартное отклонение.
Результаты исследования
Из числа участников исследования I группу составили дети с травматическим поражением шейного отдела спинного мозга (12 человек), клинически проявляющимся верхним парапарезом и нижней параплегией; II группа (13 человек) включила детей с травматическим поражением грудного и пояснично-крестцового отделов спинного мозга, клинически проявляющимся нижним парапарезом или нижней параплегией.
 Данные клинического осмотра, инструментального исследования и шкальной оценки (ASIA, VFM) заносились в базу данных (регистр пациентов с ПСМТ). На момент первоначального осмотра у всех детей, взятых в исследование, степень повреждения спинного мозга соответствовала типу А – полное. К окончанию курса реабилитации (25 дней) степень повреждения спинного мозга соответствовала типу В (неполное: чувствительность, но не движения, сохранена ниже неврологического уровня поражения, в т.ч. в сегментах S4–S5) у 7 детей I и у 9 детей II групп.
Данные клинического осмотра, инструментального исследования и шкальной оценки (ASIA, VFM) заносились в базу данных (регистр пациентов с ПСМТ). На момент первоначального осмотра у всех детей, взятых в исследование, степень повреждения спинного мозга соответствовала типу А – полное. К окончанию курса реабилитации (25 дней) степень повреждения спинного мозга соответствовала типу В (неполное: чувствительность, но не движения, сохранена ниже неврологического уровня поражения, в т.ч. в сегментах S4–S5) у 7 детей I и у 9 детей II групп.
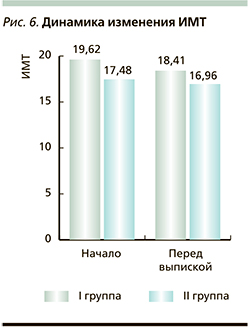
Анализ оценки восстановления функции по шкале VFM показал, что на момент выписки у пациентов I группы средние показатели самообслуживания увеличились на 39%, у пациентов II группы – на 40,6% от нормы по сравнению с показателями на момент поступления. При первичном обследовании трофологический статус пациентов I группы оценивался как нормотрофия (ИМТ – 19,62±5,56), пациентов II группы – как недостоточность питания I степени (ИМТ – 16,18±5,78). При повторном обследовании в I группе отмечалось снижение показателей ИМТ до 18,41±3,78, т.к. при поступлении у двух пациентов трофологический статус оценивался как «повышенное питание» (ИМТ>23), а по окончании курса реабилитации росто-весовые показатели приблизились к нормотрофии. Во II группе пациентов значимых колебаний в росто-весовых показателях отмечено не было, перед выпиской ИМТ пациентов II группы составил 16,96±3,78 (рис. 6).
При первичном обследовании средние показатели VO2 в покое составили у пациентов I и II групп 4,03 и 4,91 мл/кг/мин соответственно. При проведении пассивной нагрузки показатели VO2 увеличились до 6,02 и 6,0мл/кг/мин соответственно (табл. 2). Показатели VO2 при пассивной нагрузке у пациентов обоих групп были сопоставимыми, поскольку тестировались нижние, плегированные, конечности.
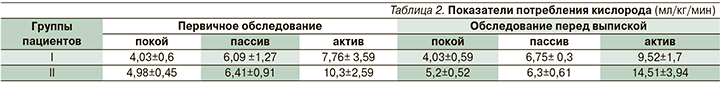
При оценке активной двигательной нагрузки в I группе увеличения VO2 по сравнению с пассивной отмечено не было. Это объяснялось тем, что у пациентов с верхним парапарезом (а в раннем периоде реабилитации грубым парапарезом до плегии в дистальных отделах) количество активных мышечных единиц, задействованных в движении, ограничено. Поэтому у пациентов II группы, у которых функция верхних конечностей оставалась сохранной, разница между maxVO2 при пассивной и активной работе была существенной.
При обследовании по окончании курса реабилитации потребление кислорода у пациентов I группы в покое и при пассивной нагрузке было сопоставимым, поскольку тестировались по-прежнему плегированные нижние конечности. Потребление кислорода при активной нагрузке возросло до 9,52±1,7 мл/кг/мин (на 22,6%; рис. 7), что свидетельствует об увеличении количества активных мышечных единиц, участвующих в движении.
Анализ данных стандартной неврологической оценки повреждений спинного мозга по шкале ASIA показал, что на момент выписки из стационара у всех пациентов I группы произошло значимое увеличение показателей двигательной функции (в среднем на 55,4%) и чувствительности (болевой на 40,2%, тактильной на 49,5%) по сравнению с показателями на момент поступления.
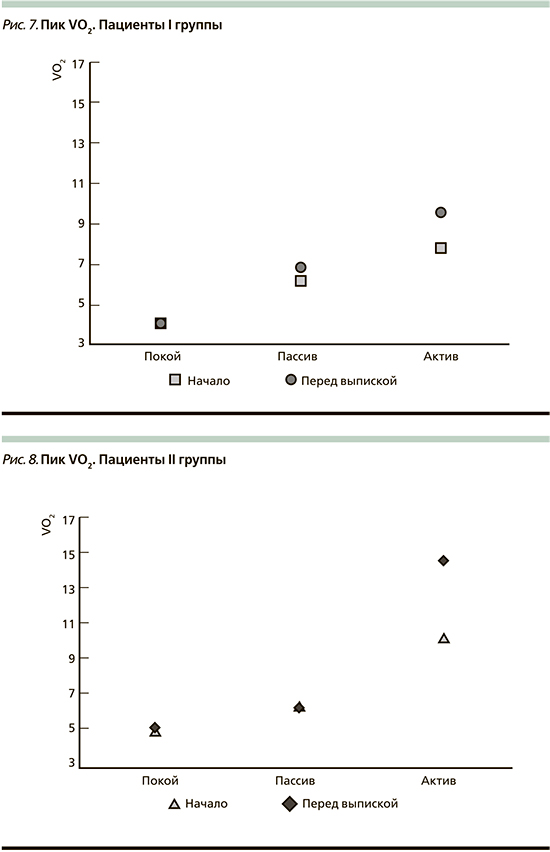
При оценке результатов обследования перед выпиской во II группе также отмечался прирост максимального потребления кислорода – до 14,51±3,94 (на 40,8%; рис. 8).
Анализ данных пациентов II группы на момент выписки из стационара выявил увеличение показателей двигательной функции в среднем на 21,7%, болевой чувствительности на 28,3%, тактильной на 29,6% по сравнению с показателями на момент поступления.
Для тестирования общей выносливости необходимо определение времени достижения аэробного порога. При первичном обследовании в обеих группах пациентов время достижения аэробного порога составило 70±12 секунд, при повторном исследовании (перед выпиской) оно увеличилось до 160±23 секунд, что свидетельствовало об увеличении выносливости пациентов.
При оценке выполнения первичного тестирования со ступенчатым повышением нагрузки ни один из пациентов обеих групп не смог преодолеть 2-ю ступень. При повторном тестировании (перед выпиской) в I группе отказались от выполнения программы на 2-й ступени 2 пациента, во II группе – 1 пациент, все остальные больные прошли 3 ступени программы без достижения анаэробного порога.
У детей, исключенных из обработки материалов, результаты тестирования потребления кислорода в покое и при пассивной нагрузке не отличались от таковых, полученных в основных группах. При попытке тестирования потребления кислорода во время активной работы у пациента в возрасте 17 лет с высокой шейной травмой выполнение упражнений не состоялось в связи с отсутствием движений ниже уровня С3. У двух детей в возрасте до 5 лет адекватное выполнение нагрузочного теста оказалось невозможным в связи с непониманием условий тестирования.
В период проведения реабилитационных мероприятий у ряда пациентов наблюдались соматические осложнения: инфекционные, трофические, приступы автономной вегетативной дисрефлексии.
Обсуждение
Эргоспирометрия служит объективным методом оценки ТФН у детей с тяжелой ПСМТ, но имеются и ограничения его использования. Так, например, применение его невозможно у детей в возрасте до года и с массой тела менее 10 кг. Кроме того, его применение в широкой практике ограничивается высокой стоимостью оборудования.
В ходе проведенного исследования были получены следующие основные результаты:
- Определение ТФН позволяет персонализировать составление программы ранней двигательной реабилитации детей с ПСМТ.
- Полученные в результате тестирования показатели maxVO2 и времени достижения анаэробного порога позволяют подобрать режим двигательной активности с учетом индивидуальных возможностей пациента.
- Постепенное увеличение моторной плотности занятий позволяет избегать перетренированности и в конечном итоге обеспечивать увеличение ТФН.
- Пассивная нагрузка не является эквивалентом активной, а служит одним из методов профилактики осложнений гипостатического положения.
Данные о приросте mахVO2 при активной нагрузке и расширении аэробного коридора в обеих группах пациентов свидетельствуют о повышении ТФН за счет увеличения силы мышц и общей выносливости организма.
Моторная плотность занятий у пациентов I и II групп в начале курса составила 7,50±3,2 минуты (16,7%) из 45 минут. Пассивная нагрузка во время занятия составила 37,50±3,2 минуты (83,3%).
К концу курса реабилитации моторная плотность занятия у всех пациентов увеличилась до 29,2±4,3 минуты (64,9%) из 45 минут. Пассивная нагрузка уменьшилась до 15,8±4,3 минуты (35,1%).
Таким образом, постепенное увеличение нагрузки предпочтительно при составлении программы двигательной реабилитации данного контингента пациентов.
В результате проведенных реабилитационных мероприятий в I группе пациентов (поражение шейного отдела спинного мозга) к окончанию срока реабилитации все 12 детей выдерживали ортостатическую нагрузку на столе-вертикализаторе в течение 30–40 минут и были высажены в кресло-коляску. Переворачиваться на бок и самостоятельно передвигаться в кресле-коляске научились 10 (83,3%) детей, 9 (75%) освоили элементарные гигиенические навыки (умывание, чистка зубов), питье из чашки и прием пищи с применением специальных приспособлений.
Во II группе (поражение грудного и пояснично-крестцового отделов спинного мозга) все 13 пациентов научились переворачиваться на живот, пересаживаться в коляску, передвигаться на ней без посторонней помощи и к моменту выписки выдерживали ортостатическую нагрузку на балансировочном тренажере в течение 15 минут.
Кроме того, 6 (50%) пациентов I группы и все 13 детей II группы были подготовлены к вертикализации в замковых аппаратах на нижние конечности с полукорсетом, что и было осуществлено во время следующей госпитализации через 5–6 месяцев после травмы, после приобретения ребенком специальных приспособлений.
Заключение
В настоящее время нагрузочное тестирование широко применяется в спорте высоких достижений. В литературе встречаются данные о единичных исследованиях взрослых больных с кардиологической патологией и взрослых пациентов с последствиями ПСМТ в позднем периоде (3 года после травмы). Исследований ТФН у детей с ПСМТ на этапе ранней реабилитации не проводилось.
Выполненная нами работа показала, что исследование ТФН на этапе ранней реабилитации детей с ПСМТ позволяет оценивать индивидуальные возможности пациента и персонализировать программу двигательной реабилитации с последующей оценкой ее адекватности.
Оценка ТНФ методом эргоспирометрии может быть использована не только в отношении детей с ПСМТ, но и при другой патологии, что требует дальнейшего углубленного изучения.


