Введение
Ишемическая болезнь сердца служит наиболее частой причиной смерти во всем мире. В настоящее время благодаря современным методам диагностики и лечения наблюдается снижение уровня смертности от острого инфаркта миокарда (ИМ). В соответствии с современными клиническими рекомендациями принято классифицировать острый коронарный синдром (ОКС) на ОКС с элевацией сегмента ST и без элевации сегмента SТ в связи с различными временными рамками проведения реперфузионной терапии. ОКС с элевацией сегмента ST требует неотложного эндоваскулярного вмешательства. Ранняя стратификация риска больных, находящихся в зоне высокого риска развития сердечно-сосудистых осложнений, считается важной задачей. На смертность в данной группе пациентов влияют множественные факторы, среди которых: возраст более 75 лет, временнóй интервал от появления первых симптомов до начала терапии, развитие острой сердечной недостаточности и кардиогенного шока, сахарный диабет, анамнез перенесенного острого ИМ, многососудистое поражение коронарных артерий, хроническая почечная недостаточность [1, 2]. Использование различных изменений электрокардиограммы (ЭКГ), возникших в течение острого ИМ, с целью стратификации риска является перспективным направлением. Регистрация расщепления комплекса QRS (fQRS) наряду с другими признаками (формирование зубцов Q, нарушения проводимости по типу блокад ножек пучка Гиса и АВ-блокад, «застывшие» элевации и депрессии сегмента ST) может служить признаком неблагоприятного прогноза.
Фрагментация QRS – это появление дополнительных зубцов R или зазубрин на восходящей части зубца R, нисходящей части зубца S комплекса QRS (<0,12 c) в 2 и более смежных отведениях.
Мы представляем клинический случай возникновения фрагментации комплекса QRS при первичном ИМ с элевацией сегмента ST и течение заболевания в раннем постинфарктном периоде.
Клинический случай
Пациентка Д. 66 лет госпитализирована в блок кардиореанимации с направительным диагнозом: острый коронарный синдром с элевацией сегмента ST.
Из анамнеза известно, что больная в течение длительного времени страдает артериальной гипертензией с максимальным повышением артериального давления (АД) до 170/90 мм рт.ст., уровень АД не контролирует, постоянно принимает лизиноприл 5мг. Толерантность к физическим нагрузкам ранее высокая, болей стенокардитического характера не описывает.
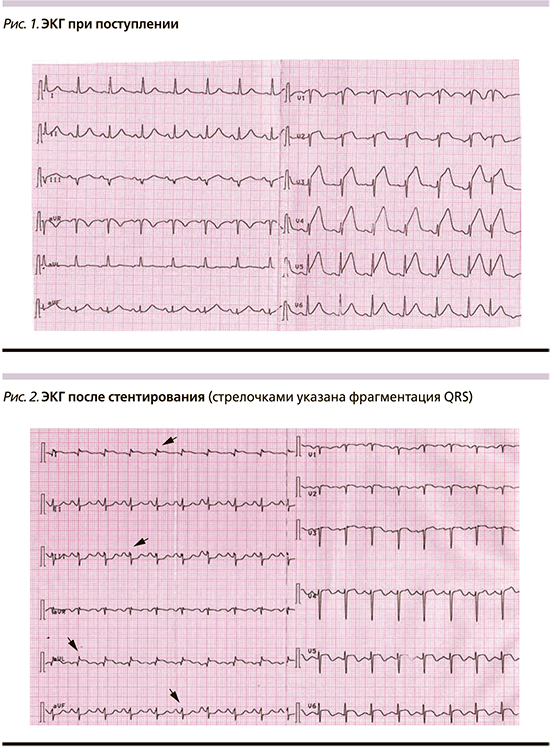
Настоящее ухудшение состояния произошло в день поступления, когда впервые в жизни пациентка отметила появление интенсивного давящего болевого синдрома за грудиной, сопровождающегося обильным потоотделением, тошнотой. На зарегистрированной при поступлении ЭКГ (рис. 1) регистрируется синусовый ритм с частотой сердечных сокращений (ЧСС) 90 уд/мин, электрическая ось сердца отклонена влево, расщепление комплекса QRS III, элевация сегмента SТ V1–V5 до 4 мм, что вкупе с вышеописанной клинической картиной соответствует острому переднему ИМ с элевацией сегмента ST.
При объективном осмотре пациентка в сознании, контактна, ориентирована всесторонне правильно. Положение активное. Кожные покровы нормальной окраски и влажности. Отеков нет. Аускультативно в легких дыхание везикулярное, проводится во все отделы. Хрипов не выслушивается. Число дыханий 18 в минуту. SрО2 – 99% на воздухе. Тоны сердца приглушены, ритмичные, шумов не выслушивается. ЧСС – 90 уд/мин, АД на правой руке – 160/90 мм рт.ст. АД на левой руке – 155/89 мм рт.ст. Пульсация на периферических артериях симметричная, удовлетворительная. Язык влажный, розовый. Живот при пальпации мягкий, безболезненный во всех отделах. Печень не выступает из-под края правой реберной дуги. Селезенка не пальпируется. Симптом поколачивания отрицательный.
Пациентке дана нагрузочная доза препаратами тикагрелор (180 мг), ацетилсалициловая кислота (250 мг), после чего больная направлена в рентгеноперационную для проведения коронароангиографии. Выявлено: левая коронарная артерия (ЛКА) – стеноз ствола 30%, кровоток TIMI III. Передняя межжелудочковая ветвь: стеноз 50% в проксимальной трети, 90% в средней трети, далее окклюзирована, кровоток TIMI 0. Первая диагональная ветвь: стеноз в устье 60%, кровоток TIMI III. Вторая диагональная ветвь: стеноз в устье 75%, кровоток TIMI III. Огибающая ветвь: стеноз 50% в средней трети, кровоток TIMI III. Правая коронарная артерия: анатомически слабо развита, стеноз средней трети 50%. Левый тип коронарного крово-обращения.
Выполнены ангиопластика и стентирование передней межжелудочковой ветви двумя стентами с лекарственным покрытием. Время от начала болевого синдрома до механической реканализации составило 120 минут.
На ЭКГ после стентирования (рис. 2) регистрируется синусовый ритм с ЧСС 113 уд/мин, элевация сегмента SТ в I, AvL, V5–V6 до 2 мм, депрессия сегмента SТ II, III, AvF. Зубцы Q I, AvL. Фрагментация комплекса QRS I, III, AvF, AVL.
В анализах крови обращали на себя внимание значительное повышение уровней общего холестерина (7,7ммоль/л), триглицерида (1,28 ммоль/л), липопротеидов высокой плотности (2,25 ммоль/л), липопротеидов низкой плотности (4,87 ммоль/л), тропонина I (0,039–34,2 нг/мл).
По данным эхокардиографии, выполненной после cтентирования, полости сердца не расширены, фракция выброса левого желудочка (ЛЖ) – 34%, нарушение сократимости верхушки и передней стенки, всех верхушечных сегментов, среднего сегмента передней стенки ЛЖ, аневризма ЛЖ с пристеночными тромботическими массами.
Была начата антикоагулянтная терапия: варфарин и подкожные инъекции низкомолекулярного гепарина до достижения целевых значений международного нормализованного соотношения, проведена смена антитромбоцитарной терапии с тикагрелора 90 мг 2 раза в сутки на клопидогрел 75 мг/сут через нагрузочную дозу в 600 мг. При дообследовании, по данным суточного мониторирования ЭКГ, неоднократно регистрировались короткие эпизоды фибрилляции предсердий. При контрольной эхокардиографии (на 11-е сутки) сохраняются пристеночные тромботические массы в аневризматическом расширении, фракция выброса ЛЖ составила 40%. Больная выписана под наблюдение участкового кардиолога на 12-е сутки в стабильном состоянии.
Обсуждение
В настоящее время считается, что причиной появления fQRS служит электрическая неоднородность миокарда и нарушение процессов деполяризации, возникающие в связи со структурной деформацией периифарктных зон, вызванной разрастанием фиброзной ткани в зоне инфаркта и препятствующей правильному распространению волны возбуждения [3, 5]. Появление высокочастотных зазубрин на ЭКГ в исследовании [4] было вызвано как постинфарктными изменениями, так и увеличением размеров сердца вследствие различных заболеваний (артериальная гипертензия, ревматические пороки клапанного аппарата, легочная гипертензия). Было доказано, что у пациентов с известной или предполагаемой ишемической болезнью сердца fQRS является маркером перенесенного острого ИМ (по данным однофотонной эмиссионной компьютерной томографии), обладающим более высокой чувствительностью и негативной предсказательной способностью по сравнению с зубцом Q, а также является независимым предиктором развития ИМ [6, 7]. Возникновение фрагментации QRS при остром ИМ с проведенной реперфузионной терапией (чрескожное коронароное вмешательство, тромболитическая терапия) является показателем большего размера ИМ, периинфарктных зон и ассоциировано с развитием синдрома No-Reflow [8–10] Также имеются данные о более частом развитии желудочковых и наджелудочковых нарушений ритма; повторных инфарктов, тяжелой сердечной недостаточности и значимо большей летальности в группе пациентов с fQRS [11–13]. В исследованиях [14, 15] показано, что возникновение фрагментации комплекса QRS при ИМ ассоциировано с многососудистым поражением коронарных артерии и более высоким по сравнению с группой без fQRS риском по шкале SYNTAX.
На основании приведенного клинического примера можно расценивать появление расщепления комплекса QRS при ИМ с элевацией сегмента ST как предиктор неблагоприятного течения постинфарктного периода и многососудистого поражения коронарных артерий. В качестве примеров можно отметить развитие аневризматического расширения с последующим формированием тромбоза полости аневризмы, значительное снижение фракции выброса ЛЖ и эпизоды нарушения ритма сердца.
Заключение
Выявление больных, находящихся в группе высокого риска постинфарктных осложнений, считается важной задачей. ЭКГ является одним из наиболее широкодоступных методов диагностики. Использование фрагментации комплекса QRS как маркер неблагоприятного прогноза наряду с другими признаками может стать перспективным направлением.
Согласие пациента
Пациент устно выразил согласие на публикацию. Подписанное согласие отсутствует.



