Введение
Гранулезоклеточные опухоли яичников (ГКОЯ) относятся к редким неэпителильным новообразованиям, частота которых, по некоторым данным, составляет приблизительно 3–5% от всех злокачественных опухолей яичников. Скорректированная по возрасту заболеваемость, по данным разных авторов, в различных регионах составляет от 0,6 до 2,1 случая на 100 тыс. женщин в год [1–3]. По мнению ряда авторов, данные о частоте заболеваемости ГКОЯ недостаточно отражают истинное положение вещей, поскольку большинство раковых регистров в мире не учитывают эти опухоли [4]
По гистологическим особенностям ГКОЯ разделяют на два типа: взрослый и ювенильный [5]. Однако, по мнению R. Young, которому вместе с другими авторами принадлежит приоритет в морфологическом разделении ГКОЯ на два типа, это разделение весьма условно, поскольку ГКОЯ взрослого типа иногда встречаются у молодых женщин, а ювенильный тип опухоли может встречаться, хотя и реже, у пациенток старшего возраста [6, 7].
Основной метод лечения ГКОЯ – хирургический. Роль химиотерапии в лечении ГКОЯ до сих пор не определена в связи с редкостью и поздним рецидивированием этого заболевания [8–15].
Цель исследования: определить роль лекарственного и хирургического методов в лечении больных ГКОЯ взрослого типа (ГКОЯ-ВТ).
Методы
В исследование вошли данные о 93 больных ГКОЯ-ВТ, проходивших лечение и наблюдавшихся в НМИЦ онкологии с 1980 по 2017 г. Все пациентки были рестадированы с учетом классификации FIGO (2014). [16]. Проведен анализ информации о возрасте, клинических проявлениях заболевания, морфологических параметрах, типе операции, адъювантной терапии, рецидивах и последующем наблюдении за больными ГКОЯ-ВТ. Медиана длительности наблюдения за больными составила 118 месяцев (от 6 до 423). Анализ данных проведен с использованием пакетов статистических программ Statistica и SPS.
Результаты
Средний возраст пациенток на момент постановки диагноза составил 47,1 года (от 19 до 77 лет). У 74 (79,6%) пациенток была диагностирована I стадия заболевания. IA-стадия установлена 51 (54,8) больной, IB – 6 (6,5%) и IC – 17 (18,3%). У 19 (20,4%) пациенток диагностированы II–IV стадии заболевания (табл. 1).
Наиболее частыми клиническими проявлениями ГКОЯ-ВТ были боли внизу живота и в поясничной области, кровотечения в постменопаузе, нарушения менструального цикла в репродуктивном периоде, увеличение живота. При оценке состояния эндометрия у пациенток с маточными кровотечениями в 93,5% случаев выявлены морфологические признаки гиперпластических процессов в эндометрии (железистая гиперплазия, полипы эндометрия), в двух случаях – аденокарцинома эндометрия. При этом у одной пациентки гарнулезоклеточная опухоль левого яичника диагностирована при исследовании операционного материала, полученного после операции гистерэктомии с двусторонней сальпигоофорэктомией и оментэктомией по поводу рака эндометрия III стадии с метастазом в правый яичник.
Среди исследованных ГКОЯ преобладали опухоли <10 см и от 10 до 19 см в диаметре. Чаще наблюдались односторонние поражения яичников и низкая митотическая активность опухоли (до 5 митозов на 10 полей зрения).
Разрыв капсулы опухоли, что по классификации ФИГО 2014 г. соответствует IC1-стадии, обнаружен у 5 (5,4 %,) пациенток (табл. 1), разрастания опухоли на поверхности капсулы (IC2-стадия) – у 9 (9,7%). Асцит был выявлен у 21,3% пациенток и коррелировал с размером опухоли. При размерах опухолей 10–19 см асцит был выявлен у 25,6% больных, при опухолях >20 см в диаметре – у 58,5%. Цитологическое подтверждение наличия опухолевых клеток в асцитической жидкости или смывах с брюшины получено в 3,2% случаев.
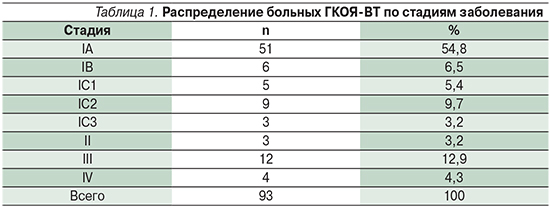
Стадия заболевания достоверно влияла на показатели 5-летней выживаемости (табл. 2; р<0,05). При III–IV стадиях опухоли она составила 43,8%. У всех больных III–IV стадиями наблюдался рецидив заболевания. Не обнаружено достоверного влияния размера опухоли на длительность безрецидивного периода и безрецидивную выживаемость, в то время как распространение опухоли за пределы капсулы при IC2-стадии и число митозов >10 негативно влияли на безрецидивную выживаемость больных (р<0,05).
Все пациентки подвергались хирургическому лечению. Последнее при I стадии ГКОЯ проведено 74 пациенткам (табл. 3). Радикальные операции в объеме гистерэктомии с двусторонней сальпингоофорэктомией и оментэктомией выполнены 49 (66,2%) пациенткам. Односторонняя сальпингоофорэктомия с резекцией контралатерального яичника –22 (29,7%) больным, удаление кисты яичника – 3 (4,1%).
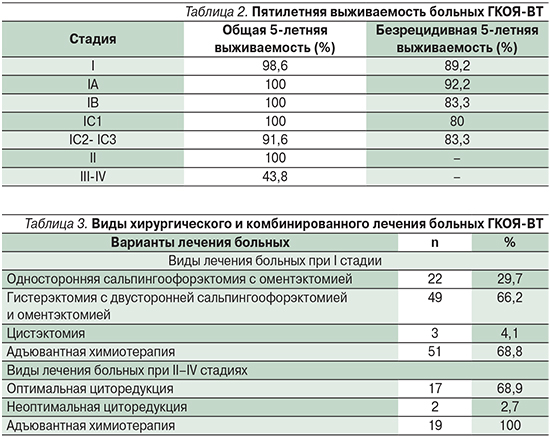
В 7,8 % случаев радикальные операции с хирургическим стадированием проведены после нерадикальных хирургических вмешательств, выполненных в других лечебных учреждениях.
Хирургическое лечение при II–IV стадиях ГКОЯ-ВТ выполнено 19 пациенткам, из которых в 17 случаях выполнена оптимальная циторедуктивная операция в объеме гистерэктомии с двусторонней сальпингоофорэктомией и оментэктомией, двоим произведена паллиативная циторедуктивная операция (табл. 3).
Адъювантная химиотерапия (АХТ) при I стадии была проведена 51 больной, из них 40 пациенткам – при IA-стадии, 2 – при IB- и 9 – при IC-стадии заболевания. При II–IV стадиях заболевания АХТ проведена всем больным (табл. 3). Применялись следующие схемы химиотерапии: BEP (блеомицин, этопозид, цисплатин) – в 38,5% случаев, схема VAC (винкристин, дактиномицин, циклофосфан) – в 48,7%, схема ТС (паклитаксел, карбоплатин) – в 4,1%, другие препараты и схемы – в 8,7%.
Рецидивы заболевания возникли у 34 (36,6%) больных. Среднее время до возникновения первого рецидива составило 55 месяцев (от 3 до 312). Из 74 пациенток с I стадией заболевания рецидивы наблюдались у 18 (24,3%) больных. При IA- и IB-стадиях – у 6 (10,5%), при IС-стадии – у 12 (70,6%), при II–IV стадиях – в 19 (100%) случаях. Среднее время до возникновения первого рецидива при IA- и IB-стадиях составило 134,5 месяца, при IС-стадии – 67,4, при II–IV стадиях – 34,3 месяца.
Не выявлено зависимости безрецидивной выживаемости и длительности безрецидивного периода от объема хирургического лечения при I стадии заболевания (р>0,05). Проведение АХТ также не оказывало влияния на показатель безрецидивной выживаемости и длительности безрецидивного периода независимо от стадии заболевания.
При возникновении первого рецидива у 20 (58,8%) больных проведено хирургическое лечение в сочетании с АХТ, у 4 (11,8%) – сочетание операции с лучевой терапией, в отношении 10 (29,4%) применялась только химиотерапия. Не обнаружено влияния видов лечения на возникновение второго рецидива заболевания или на беспрогрессивную выживаемость, при этом длительность беспрогрессивного периода была несколько, но недостоверно больше при выполнении оптимальной циторедукции и не зависела от проведения и схемы АХТ.
Гормонотерапия после хирургического лечения третьего и четвертого рецидивов заболевания применялась в единичных случаях, результаты которой оценить не представляется возможным.
Обсуждение результатов
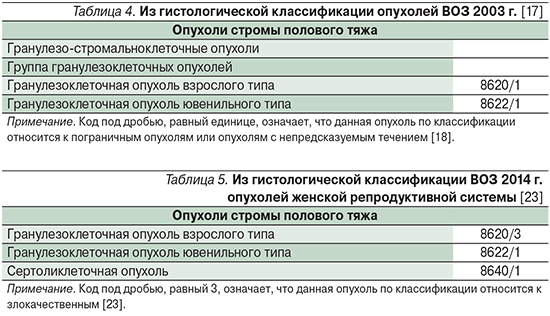
ГКОЯ как взрослого, так и ювенильного типов в связи с неопределенностью их злокачественного потенциала до недавнего времени, согласно гистологической классификации ВОЗ 2003 г., относили к пограничным опухолям (табл. 4) [17].
Действительно, у больных ГКОЯ наблюдается достаточно высокая 5- и 10-летняя выживаемость как в нашем исследовании, так и в работах других авторов. В исследовании J.Y. Park et al. 5-летние показатели безрецидивной и общей выживаемости при ранних (I–II) стадиях составили 89 и 99% соответственно, при поздних стадиях (III–IV) – 72 и 80% соответственно. Аналогичные 10-летние показатели при ранних (I–II) стадиях составили 89 и 90% соответственно, при поздних стадиях (III–IV) – 57 и 67% соответственно [19].
Тем не менее, несмотря на относительно благоприятное клиническое течение и позднее рецидивирование ГКОЯ по сравнению с более частыми эпителиальными злокачественными опухолями яичников, около 10–20% больных с диагнозом ГКОЯ умирают от рецидивов и метастазов этой опухоли в течение первых 5–10 лет от момента начала лечения [13, 20, 21]. При типично злокачественном течении заболевания в опухоли обнаруживались признаки, которые позволяли патологоанатомам отнести их к злокачественным ГКОЯ [22].
В последней гистологической классификации ВОЗ 2014 г. пересмотрены все категории пограничных опухолей: часть из них осталась в категории пограничных (tumours of borderline malignancy), другие опухоли с низким злокачественным потенциалом (low-grade malignant) отнесены к категории злокачественных. Что касается ГКОЯ, то их разделили на пограничные, к которым отнесли ГКОЯ ювенильного типа и злокачественные – ГКОЯ-ВТ (табл. 5) [23].
Несмотря на определение ГКОЯ-ВТ не как пограничные, а как истинно злокачественные опухоли, не существует определенных рекомендаций по хирургическому и лекарственному лечению данного заболевания. Это связано прежде всего с поздним рецидивированием ГКОЯ-ВТ, требующим длительного наблюдения за больными, а также с редкостью этих опухолей и разноречивыми данными относительно факторов прогноза.
Так, одни исследователи делают вывод, согласно которому возраст, размер опухоли, стадия, митотический индекс, Ki-67, ядерная атипия, лимфо-васкулярная инвазия, остаточная опухоль после операции служат независимыми предикторами рецидива заболевания при многофакторном анализе [24–27]. Другие авторы не обнаруживают влияния размера опухоли, ядерной атипии, митотического индекса, уровня Ki-67 на риск рецидива заболевания, но отмечают влияние разрыва опухоли на риск рецидива (р<0,0001) а на общую выживаемость – только стадии FIGO (р=0,032) [28, 29].
M. Dridi et al. при многофакторном анализе данных не обнаружили ни одного независимого прогностического фактора у больных ГКОЯ-ВТ, однако отметили, что высокий митотический индекс негативно влиял на выживаемость больных, что совпадает с нашими данными [30].
Что касается вариантов хирургического лечения ГКОЯ-ВТ, то G. Mangili et al. продемонстрировали достоверно положительное влияние полного стадирования и места первичного специализированного лечения на показатель 5-летней безрецидивной выживаемости [31]. Положительное влияние полного хирургического стадирования продемонстрировали и другие исследователи [19, 32]. Авторы рекомендуют при распространенном процессе выполнять оптимальную интервальную циторедукцию после химиотерапии, но не советуют выполнять лимфодиссекцию, поскольку данная процедура не влияла на частоту рецидива заболевания, а при гистологическом исследовании удаленных лимфатических узлов в них не обнаруживались метастазы. Помимо этого A. Karalok et al. подтверждают, что единственным независимым фактором, влияющим на прогноз, является стадия заболевания [32]. Противоположные данные приводят I.H. Lee et al., которые в многоцентровом ретроспективном исследовании [33] при многофакторном анализе данных 102 пациенток с ГКОЯ-ВТ не обнаружили влияния вариантов хирургического лечения на частоту рецидивов заболевания. В этом исследовании также показано влияние только одного независимого фактора (стадии заболевания) на возникновение рецидива при ГКОЯ-ВТ.
Противоречивы и рекомендации относительно лекарственного лечения ГКОЯ-ВТ. Есть сообщения о повышении безрецидивной выживаемости и времени до прогрессирования у пациенток высокого риска, получавших АХТ [34].
Несколько исследований показали положительный эффект химиотерапии на базе препарата платины для пациенток с распространенной стадией заболевания [35, 36]. В других работах не было обнаружено положительного влияния химиотерапии на частоту рецидивов даже при ранних стадиях ГКОЯ [25, 31, 32, 37]. Более того, исследование, посвященное влиянию химиотерапии на прогноз пациенток ГКОЯ-ВТ со стадией IC, не обнаружило различий в безрецидивной выживаемости между пациентками в группах с АХТ и без нее [38]. Результаты исследования, проведенного D. Wang et al., показали, что АХТ не защищает от рецидивов пациенток с ГКОЯ-ВТ [39].
Согласно рекомендациям NCCN, применение АХТ в отношении пациенток с ранней стадией ГКОЯ-ВТ целесообразно при выраженных факторах риска, таких как высокий митотический индекс, разрыв опухоли или неполное хирургическое стадирование. При этом, как было показано выше, исследование прогностических факторов ГКОЯ обнаруживает противоречивое влияние возраста, числа митозов, нарушения целостности капсулы опухоли на клиническое течение и прогноз. Наше исследование не подтвердило положительного влияния АХТ на безрецидивную выживаемость при I стадии заболевания, но обнаружило негативное влияние высокого митотичесого индекса на прогноз.
Что касается схем химиотерапии, то наиболее широко используемым режимом АХТ первой линии для пациентов с ГКОЯ-ВТ считается схема BEP, но отмечается, что препараты, входящие в нее (блеомицин, этопозид, цисплатин), ассоциируются с потенциально серьезной токсичностью, такой как миелосупрессия и пульмонит [8, 12, 13].
В обзоре N. Colombo сообщается, что химиотерапия на основе платины в настоящее время используется больными с поздними стадиями или рецидивирующим заболеванием, с общим уровнем ответа от 63 до 80% и что комбинированная химиотерапия таксанами и платиной, по-видимому, остается перспективной схемой для дальнейшего исследования [14].
Согласно рекомендациям NCCN (категория 2B), возможно применение таксанов в сочетании с карбоплатиной (схема TC – паклитаксел, карбоплатина). В настоящее время гинекологическая онкологическая группа (GOG) проводит рандомизированное исследование фазы II, результаты которого ожидаются в 2024 г., по сравнению влияния схем TC и BEP на беспрогрессивную выживаемость больных ГКОЯ-ВТ (ClinicalTrialsgov Identifier NCT01042522). Ожидается, что схема TC может иметь относительно более низкую токсичность и схожую беспрогрессивную выживаемость по сравнению со схемой BEP.
Схемы BEP и TC использовались в отношении некоторых пациенток в нашей работе, однако ретроспективный характер исследования, а также разнообразие режимов химиотерапии и используемых доз не позволили сделать какие-либо выводы относительно влияния различных схем на частоту рецидивов и выживаемость больных.
Перспективным направлением паллиативного лечения рецидивов ГКОЯ считается гормонотерапия на базе прогестагенов (мегестрол) и агонистов гонадотропин-релизинг-гормонов [8, 40, 41, 42, 43]. Сообщается о многообещающих результатах применения ингибиторов ароматазы при рецидивах ГКОЯ-ВТ [44–46].
В настоящее время исследуется эффективность применения таргетной терапии, а именно ингибиторов mTOR и тирозинкиназы в лечении ГКОЯ [47–50].
Заключение
Достоверных различий в показателях общей и безрецидивной выживаемости больных ГКО яичников взрослого типа в зависимости от вариантов проводимого им хирургического и лекарственного лечения не выявлено. Полученные результаты и данные литературы свидетельствуют о благоприятном течении заболевания при IA-стадии и отсутствии неблагоприятных факторов риска, что позволяет применять операции, сохраняющие фертильность у пациенток репродуктивного возраста. Учитывая полученные результаты и токсичность химиотерапии, представляется возможным ограничиться наблюдением после хирургического лечения при I стадии ГКОЯ-ВТ, особенно в отсутствие высоких факторов риска. Необходимы дополнительные многоцентровые рандомизированные исследования для уточнения эффективности различных вариантов хирургического и лекарственного лечения больных ГКОЯ-ВТ.


