Обоснование
Ранняя выписка пациентов из стационара после проведения хирургического вмешательства становится общепринятым стандартом [1]. Длительное пребывание в клинике связано с риском развития внутрибольничных инфекций, тромбоэмболических осложнений и обусловлено длительной иммобилизацией [1]. Выписка в день госпитализации требует ускоренного восстановления пациента после операции (ERAS – Enhanced recovery after surgery) и низкой частоты развития нежелательных явлений – НЯ (боль, тошнота, рвота, остаточная седация) [1, 2]. Хирургическая резекция носовой перегородки (септопластика) является одной из основных операций, выполняемых в оториноларингологической практике [3]. НЯ, связанные с проведением септопластики в условиях локальной анестезии (ЛА) или общего обезболивания, препятствуют реализации программы ERAS и ранней выписке больных [3–6]. Применение ЛА в комбинации с седацией характеризуется низким риском развития кровотечения, боли, послеоперационной тошноты и рвоты (ПОТР), поэтому пользуется большим предпочтением среди хирургов и пациентов [3, 4, 7, 8].
Повышенный интерес к проведению септопластики в условиях седации связан с появлением высокоселективных ɑ2-агонистов адренорецепторов (дексмедетомидин), что обусловлено его способностью оказывать седативное действие без влияния на функцию дыхания [9]. C. Tang et al. показали способность дексмедетомидина снижать уровень катехоламинов, фактора некроза опухоли, провоспалительных цитокинов в крови во время и после оперативного вмешательства [10].
В результате пациенты имели низкий уровень периоперационного стресса и боли [10]. В настоящее время нет консенсуса в отношении эффективного и безопасного седативного препарата, способного обеспечивать ускоренное восстановление прооперированных больных [3, 4], что диктует необходимость дальнейших исследований.
Цель исследования. Оценить возможность и определить причины задержки ускоренного восстановления пациентов после септопластики в условиях седации дексмедетомидином или пропофолом при мультимодальном обезболивании.
Методы
Проведено рандомизированное проспективное исследование.
Критерии включения:
- подписанная и датированная форма информированного согласия пациентов до проведения каких-либо процедур исследования;
- ЛОР-операция: септопластика и вазотомия;
- амбулаторные пациенты в возрасте более 18 лет;
- ASA (American Society of Anaesthesiologists) – 1-й, 2-й классы.
Работа выполнена на базе ООО МО «Новая больница» № 33 (Екатеринбург) в условиях малой операционной с однодневным стационаром. Период проведения исследования – 2016–2018 гг.
Протокол исследования одобрен этическим комитетом ООО МО «Новая больница» 27.09.2016.
Коррекцию деформации носовой перегородки проводили эндоскопическим методом [2, 11]. Согласно рекомендациям врача, пациенты не принимали твердой пищи за 6 часов и жидкость за 2 часа перед вмешательством [2].
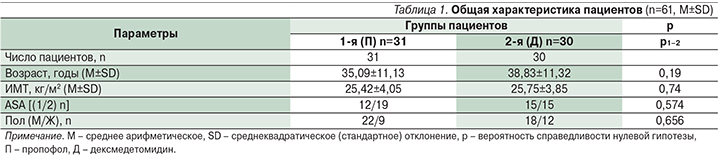
Больные были сопоставимы по возрасту, полу, индексу массы тела (ИМТ) и периоперационному риску ASA (табл. 1).
Премедикацию не применяли. За 20 минут до оперативного вмешательства выполнили переднюю тампонаду носа с использованием раствора 2%-ного лидокаина в объеме 10 мл.
Мониторинг витальных показателей артериального давления, частоты сердечных сокращений, степени насыщения крови кислородом (SpO2) осуществляли монитором Nihon Kohden Corporation, Model BSM-3763 (Japan) перед операцией и через каждые 10 минут в течение оперативного вмешательства и до момента выписки из стационара.
Целевой уровень седации соответствовал баллам от 0 до -3 по шкале RASS (шкала возбуждения–седации Ричмонда). Средний уровень седации контролировали вербальным контактом с пациентом каждые 5–10 минут [12].
В 1-й группе первоначально, внутривенно (в/в) через инфузомат вводили пропофол 10 мг/мл в нагрузочной дозе 0,5 мг/кг, поддерживающая доза – 0,3–4,0 мг/кг/ч. Лорноксикам в/в струйно в дозе 8 мг до начала оперативного вмешательства. При достижении целевого уровня седации выполнили ЛА ультракаином (Ультракаин Д-С, 1:200000 2 мл, 1 мл – 40 мг артикаина).
Пациенты 2-й группы получали дексмедетомидин в/в через инфузомат в нагрузочной дозе 1 мкг/кг на протяжении 20 минут (дексмедетомидин 200 мкг/2 мл), поддерживающая доза – 0,2–0,6 мкг/кг/ч. Лорноксикам в/в струйно 8 мг до начала септопластики. Инфильтрационную анестезию выполняли ультракаином.
Десятибалльную визуально аналоговую шкалу (ВАШ) применяли для оценки уровня боли [13–15]. В случае интенсивности боли во время проведения вмешательства ≥4 пациенту дополнительно вводили местный анестетик.
Шкалу Aldrete использовали для решения вопроса о переводе пациентов из операционной в палату восстановления и выписке домой.
Статистическую обработку результатов проводили на персональном компьютере с помощью прикладных программ «Excel» версии «Microsoft Office 2016» и «Statistics for Windows, Release 7.0, StatSoft, Inc». Результаты представили в виде M±SD, где M – среднее арифметическое, SD – среднеквадратическое (стандартное) отклонения. Достоверность различий средних значений между двумя выборками определяли по t-критерию Стьюдента для нормального распределения, различия считали достоверными для р<0,05.
Результаты исследования
В 1-й группе 30 пациентов выписали домой в день оперативного вмешательства. Один пациент был оставлен под наблюдением на 48 часов, второй пациент досрочно закончил участие в исследовании на этапе оперативного лечения по причине клинически значимого уровня боли.
Все пациенты 2-й группы исследования были выписаны в день операции. Один пациент выбыл из исследования на этапе прескрининга, т.к. соответствовал критериям исключения.
Длительность госпитализации и седации в обеих группах не различалась. Длительность оперативного вмешательства достоверно меньше в группе пациентов, где использовали дексмедетомидин (табл. 2).
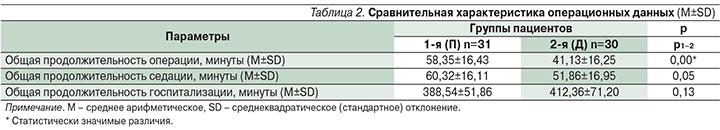
Время до достижения счета 9–10 по шкале Aldrete составило 0 минут. Счет по шкале перед выпиской пациента домой соответствовал 9–10 баллам (табл. 3).
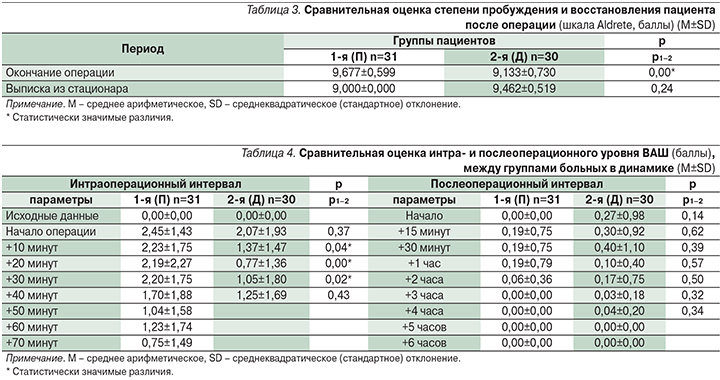
Интраоперационный уровень боли оказался статистически значимо выше в 1-й группе больных. Послеоперационную боль зарегистрировали на минимальном уровне в обеих группах. Статистически значимых различий не получили (табл. 4).
Объем общей кровопотери в 1-й и 2-й группах составил соответственно 30,80±13,91 и 28,56±17,86 мл (М±δ). Повышенный уровень интраоперационной боли у 13 пациентов 1-й группы и 6 пациентов 2-й группы сопровождался беспокойством и непроизвольными движениями. Послеоперационного обезболивания потребовали 8 пациентов в группе пропофола и 4 пациента в группе дексмедетомидина. Статистически значимых различий не получили (табл. 5).

Обсуждение
Малоинвазивная хирургическая техника – одна из основных составляющих концепции ERAS [2]. Эндоскопический метод коррекции носовой перегородки позволяет сократить время оперативного вмешательства до 28 минут [11]. Мета-анализ, представленный C.J. Hong et al., показал, что использование эндоскопического метода коррекции носовой перегородки по сравнению с «открытым» сопровождается меньшим объемом кровопотери [16].
В исследованиях R. Dogan и S. Manpreet интраоперационный уровень боли составил 2,2±1,1 балла, послеоперационный – 1,8±1,4 и 2,24±1,61 соответственно [4, 7]. В итоге длительность госпитализации пациентов превысила сутки. Заслуживает внимания использование дексмедетомидина в сочетании с ЛА (монообезболивание).
Наши исследования свидетельствуют, что всех пациентов группы с использованием дексмедетомидина успешно выписали в день оперативного вмешательства, что обусловлено низким уровнем боли на протяжении (1,33±1,66 балла) и после оперативного вмешательства (0,17±0,71 балла), применением дексмедетомидина на фоне мультимодального обезболивания в соответствии с принципами ERAS [1].
X.Y. He et al. в исследованиях с участием детей, перенесших тонзилэктомию и аденоидэктомию, подтверждают высокую интра- и послеоперационную анальгетическую активность дексмедетомидина, сопоставимую с опиоидами, [17] тогда как пациенты, получавшие пропофол с многокомпонентным обезболиванием, имели высокий уровень периоперационной боли [3].
K. Indira et al. в проспективном двойном слепом рандомизированном плацебо-контролируемом исследовании доказали необходимость применения ɑ2-агонистов адренорецепторов (клонидин) в качестве адъюванта при проведении оториноларингологических операций [9]. Клонидин на фоне мультимодального обезболивания обеспечил превосходную седацию и анальгезию [9].
ПОТР служат причиной непредвиденной задержки госпитализации [18]. Стратегия, разработанная клиницистами и направленная на предотвращение развития ПОТР, подтверждает преимущество седации с ЛА (табл. 6) [18]. В 1-й и 2-й группах нашего исследования опиоид ограничительная стратегия позволила избежать ПОТР [1].

Заключение
Седация дексмедетомидином в условиях мультимодального обезболивания обеспечивает ускоренное восстановление после септопластики, прежде всего за счет высокого уровня анальгезии, что позволяет выписывать пациента в день оперативного вмешательства.


