Обоснование
Артериальная гипертензия (АГ) – один из главных модифицируемых факторов риска сердечно-сосудистых событий. Распространенность АГ постоянно растет во всем мире [1]. По оценкам разных авторов, более 116,4 млн человек страдают этим заболеванием, которое ежедневно приводит к 2303 смертям от сердечно-сосудистых заболеваний (ССЗ) [2]. Предполагается, что численность населения, страдающего от АГ в течение следующих 20 лет, увеличится на 60% и составит в общей сложности более 1,5 млрд человек [1]. На данный момент 46% взрослого населения США страдают от АГ, у 80% из которых верифицирован диагноз, еще меньшее число следует назначенной фармакотерапии [3], а достижение целевого уровня артериального давления (АД) наблюдается примерно у 53% из них [3]. Несмотря на растущую информированность общества об АГ и ее осложнениях, проблема широкой распространенности недиагностированной и неконтролируемой АГ, которая характеризуется отсутствием специфических клинических проявлений, низкой эффективностью лечения и низкой приверженностью из-за развития возможных нежелательных лекарственных реакций (НЛР), остается актуальной [3].
Недостаточная клиническая эффективность фармакотерапии АГ может быть связана с межиндивидуальной генетической изменчивостью. Общегеномные исследования подтвердили, что генетические факторы оказывают влияние не только на уровень АД, но и на вариабельность ответа на антигипертензивную терапию [4]. Ввиду многофакторной природы анализ фенотипов лекарственного ответа должен включать оценку взаимодействий между несколькими локусами генов, ответственных как за фармакодинамические, так и за фармакокинетические свойства антигипертензивных препаратов [5, 6]. Генетические полиморфизмы генов, кодирующие белки-переносчики лекарственных средств (ЛС), белки-ферменты, вовлеченные в патогенетические механизмы АГ, а также белки-ферменты, определяющие скорость метаболизма ЛС, могут оказывать влияние на модулирование фармакологического ответа [3, 7]. Исследования общегеномных ассоциаций GWASs (Genome Wide Association Stadies) привели к установлению вариантов, связанных с эффективностью ЛС и НЛР. Однако из-за мультигенной и многофакторной природы фенотипов фармакологического ответа требуются дальнейшие исследования в этой области с целью разработки персонализированных алгоритмов фармакотерапии [5, 8]. Наибольшую актуальность приобретает выявление генетических полиморфизмов в генах ключевых факторов регуляции сердечно-сосудистой системы, ассоциированных с функционированием РААС, таких как гены, кодирующие:
- • ангиотензинпревращающий фермент (АПФ) (ACE, Angiotensin I converting enzyme) – полиморфизм вставки/делеции, I/D-полиморфизм, обозначение по референсному сиквенсу человека rs4646994;
- • ангиотензиноген (AGT, Angioten-sinogen) – М235Т-полиморфизм, rs699;
- • рецепторы к ангиотензину II 1-го типа (AGTR1, angiotensin II receptor type 1) – А1166С-полиморфизм, rs5186;
- • альдостеронсинтетазу (CYP11B2, Cytochrome P450 family 11 subfamily B member 2) – C-344T-полиморфизм, rs1799998;
- • CYP2C9 (Cytochrome P450 family 2 subfamily C member 9) – основной фермент, ответственный за метаболизм блокаторов рецепторов ангиотензина (БРА), одним из основных классов антигипертензивных ЛС, применяемых для лечения АГ.
В представленной работе впервые изучена частота встречаемости полиморфных вариантов набора ключевых известных генов-кандидатов CYP2C9*2 (Arg144Cys), CYP2C9*3 (Ile359Leu), AGTR1 (A1166C), AGT (M235T), ACE (I/D полиморфизм), CYP11B2 (С-344T) и их комбинаций, влияющих на эффективность и безопасность блокаторов РААС и метаболизм БРА у пациентов с впервые выявленной АГ 1–2-й степеней, наблюдающихся в условиях поликлиники Москвы.
Цель исследования: определить частоту встречаемости полиморфных вариантов генов CYP2C9*2 (Arg144Cys), CYP2C9*3 (Ile359Leu), AGTR1 (A1166C), AGT (M235T), ACE (I/D полиморфизм), CYP11B2 (С-344T) и их комбинаций у пациентов с впервые выявленной АГ 1–2-й степеней, наблюдающихся в условиях московской поликлиники.
Методы
Исследование носит дизайн кросс-секционного молекулярно-генетического исследования частот встречаемости полиморфных вариантов генов CYP2C9*2 (Arg144Cys), CYP2C9*3 (Ile359Leu), AGT (M235T), CYP11B2, AGTR1 (A1166C), ACE (I/D полиморфизм) и их комбинаций среди пациентов с впервые выявленной АГ 1–2-й степеней в условиях московской поликлиники.
Критерии включения: АГ 1–2-й cтепеней, возраст от 18 до 74 лет, наличие подписанного письменного информированного согласия пациента на участие в исследовании. Критерии невключения пациентов в исследование: АГ 3-й степени, неконтролируемая АГ, артериальная гипотензия, повышенная чувствительность к ирбесартану и валсартану или вспомогательным компонентам препарата, активные заболевания печени или повышение сывороточной активности трансаминаз более чем в 3 раза, печеночная недостаточность (классы А и В по шкале Чайлда–Пью), хроническая болезнь почек 4–5-й стадий (скорость клубочковой фильтрации [СКФ] менее 30 мл/мин/1,73 м2; клиренс креатинина <30 мл/мин), сахарный диабет в стадии декомпенсации, беременность и период лактации, возраст до 18 лет и старше 75 лет, пациенты с первичным гипер-альдостеронизмом, ангионевротический отек, включая отек Квинке, при лечении препаратами, влияющими на РААС, в т.ч. ингибиторов АПФ, одновременное применение алискирена и препаратов, содержащих алискирен, у пациентов с сахарным диабетом и/или с умеренными или тяжелыми нарушениями функции почек (СКФ менее 60 мл/мин/1,73 м2 площади поверхности тела), одновременное применение с ингибиторами АПФ у пациентов с диабетической нефропатией, непереносимость галактозы, недостаточность лактазы и синдром глюкозо-галактозной мальабсорбции, установленный диагноз злокачественного новообразования на момент включения в исследование, необходимость в постоянном приеме нестероидных противовоспалительных средств и/или препаратов, которые метаболизируются цитохромом Р-450 CYP2C9, которые могут влиять на эффективность и профиль безопасности ирбесартана.
Поиск участников исследования проводился в амбулаторных лечебно-профилактических учреждениях Москвы, клинических базах кафедры клинической фармакологии и пропедевтики внутренних болезней ПМГМУ им. И.М. Сеченова (Сеченовский Университет): ГКБ им. Е.О. Мухина, ГБУЗ «Госпиталь для ветеранов войн № 3» ДЗМ, ЦКБ гражданской авиации, ГБУЗ «ГП № 2» ДЗМ.
Набор пациентов осуществлялся в период с 1 июля 2021 по 28 августа 2022 г.
После подписанного информированного согласия у пациентов, включенных в исследование (пациенты с впервые выявленной АГ 1–2-й степеней, наблюдавшихся в условиях поликлиники Москвы), производили забор 3 мл периферической крови, которую собирали в вакуумные пробирки для дальнейшего генотипирования по CYP2C9*2 (Arg144Cys), CYP2C9*3 (Ile359Leu), AGTR1 (A1166C), AGT (M235T), ACE (I/D полиморфизм), CYP11B2 (С-344T).
Для генотипирования использовали венозную кровь, собранную в вакуумные пробирки «VACUETTE» (Greiner bio-one, Австрия) (4 мл, 13*75 мм) с К2 ЭДТА. Пробирки переворачивали не менее 10 раз для максимально более полного смешивания антикоагулянта с кровью, замораживали и хранили при -20ºС до выделения ДНК. ДНК выделяли из лейкоцитов цельной крови с помощью коммерческих наборов реактивов «ДНК-СОРБ-В» Amplisens ФГБУ ЦНИИ эпидемиологии Роспотребнадзора (Россия). Все технологические операции выполняли в соответствии с инструкциями наборов. Полученные препараты ДНК хранили при температуре -20ºС.
Для определения генетических полиморфизмов генов CYP2C9*2 (Arg144Cys) и CYP2C9*3 (Ile359Leu) использовался метод полимеразной цепной реакции (ПЦР) в реальном времени на ДНК-амплификаторе «CFX96 Touch Real Time System» с программным обеспечением «CFX Manager» компании BioRad (США) и коммерческий набор «РеалБест-Генетика Варфарин» («ВекторБест», Россия), основанный на ПЦР с последующим анализом кривых плавления образующихся ампликонов. I/D- полиморфизм гена ACE определяли с помощью набора «SNP-SHOT» Two step (ООО НПФ «Литех», Россия). Полиморфизм A1166C гена рецептора 1-го типа ангиотензина II AGTR1 и полиморфизм M235T гена ангиотензиногена AGT определяли с помощью наборов реагентов для выявления полиморфизмов в геноме человека «SNP-ЭКСПРЕСС» в режиме реального времени (ООО НПФ «Литех», Россия). Полиморфизм C-344T гена альдостеронсинтазы CYP11B2 определяли с помощью набора реагентов для выявления полиморфизма в геноме человека «SNP-Скрин» (ЗАО НПК «Синтол», Россия).
Исследование одобрено локальным этическим комитетом ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава РФ (Протокол № 05-21 от 10.03.2021).
Размер выборки предварительно не рассчитывался. Статистический анализ и визуализацию полученных данных проводили с использованием среды для статистических вычислений R 4.2.3 (R Foundation for Statistical Computing, Вена, Австрия). Описательные статистики для качественных переменных представлены в виде числа наблюдений (относительная частота). Для сравнения групп в отношении качественных переменных использовали точный критерий Фишера. Для анализа соответствия эмпирического распределения генотипов теоретическому, определяемому равновесием Харди–Вайнберга, использовали тест отношения правдоподобия.
Результаты
На основании изучения амбулаторных карт 179 пациентов с впервые выявленной эссенциальной АГ 1–2-й степеней были включены в исследование, среди которых 141 (78,8%) женщина и 38 (21,2%) мужчин в возрасте от 32 до 69 лет (средний возраст – 58,2±6,4 года, медианный возраст 60 – 57–63 года). Всем пациентам, включенным в исследование, были назначены БРА (ирбесартан и валсартан) в виде монотерапии или в комбинации с гидрохлоротиазидом.
В таблице представлены результаты анализа частоты генотипов в исследуемой когорте пациентов.

Нами не было выявлено статистически значимых отклонений наблюдаемой частоты генотипов от теоретической, определяемой равновесием Харди–Вайнберга (рис. 1): полиморфный локус c.430 (Arg144Cys) гена CYP2C9 (G2=1,08; p=0,298), полиморфный локус c.1075 (Ile359Leu) гена CYP2C9 (G2=3,36; p=0,067), полиморфный локус c.1166 (A1166C) гена AGTR1 (G2=0,67; p=0,412), полиморфный локус c.4072 (M235T) гена AGT (G2=1,71; p=0,191), I/D-полиморфизм гена ACE (G2=0,92; p=0,338), полиморфный локус c.344 (C344T) гена CYP11B2 (G2=0,92; p=0,338).

На рис. 2 представлены результаты анализа частоты комбинаций аллелей риска.
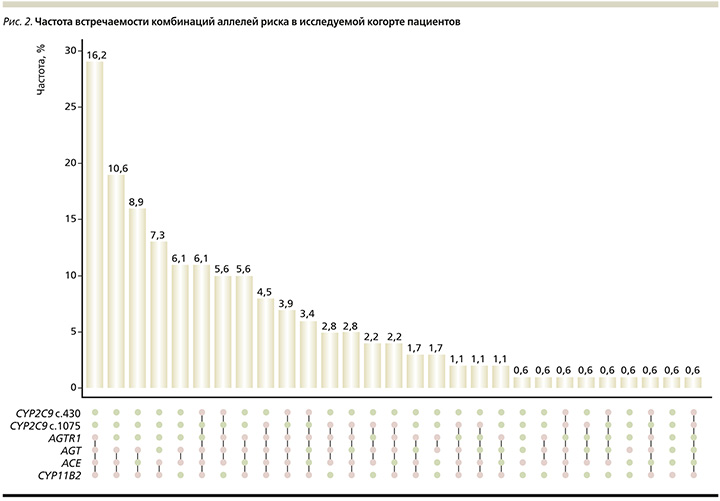
Так, 29 (16,2%) пациентов, были носителями комбинаций нефункциональных аллелей (аллелей риска) по генам фармакодинамики блокаторов РААС AGTR1 (С-аллель), AGT (С-аллель), ACE (D-аллель), CYP11B2 (Т-аллель), у 19 (10,6%) больных определялись одновременно аллели риска по генам AGT (С-аллель), ACE (D-аллель), CYP11B2 (Т-аллель), у 16 (8,9%) – по AGT (С-аллель), CYP11B2 (Т-аллель), у 13 (7,3%) пациентов – по ACE (D-аллель), CYP11B2 (Т-аллель), у 11 (6,1%) больных – по AGT (С-аллель), ACE (D-аллель), у 10 (5,6%) – по AGTR1 (С-аллель), AGT (С-аллель), ACE (D-аллель), CYP11B2 (Т-аллель). При этом по генетическим полиморфизмам гена CYP2C9, отвечающего за метаболизм БРА, нефункциональных аллелей выявлено у них не было.
У 11 (6,1%) пациентов определялась комбинация аллелей риска по генам фармакодинамики и метаболизма БРА, по CYP2C9*2 (Arg144Cys), AGT (С-аллель), ACE (D-аллель), CYP11B2 (Т-аллель); у 10 (5,6%) пациентов – по CYP2C9*2 (Arg144Cys), AGTR1 (С-аллель), AGT (С-аллель), ACE (D-аллель); у 8 (4,5%) пациентов – по CYP2C9*3 (Ile359Leu), AGTR1 (С-аллель), AGT (С-аллель), ACE (D-аллель), CYP11B2 (Т-аллель), у 7 (3,9%) – по CYP2C9*2 (Arg144Cys), AGTR1 (С-аллель), AGT (С-аллель), ACE (D-аллель), CYP11B2 (Т-аллель). Частота встречаемости комбинации аллелей риска по генетическим полиморфизмам CYP2C9*2 (Arg144Cys) и по CYP2C9*3 (Ile359Leu) гена метаболизма БРА определялась менее чем у 1% пациентов.
Обсуждение
Проанализирована частота распределения генотипов и аллелей риска по набору ключевых генов, ответственных за функционирование РААС, и генов, отвечающих за метаболизм ЛС, в частности ряда БРА.
Для генотипов *1*2 и *2*2 по генетическому полиморфизму гена CYP2C9*2 (Arg144Cys) и *1*3 и *3*3 по генетическому полиморфизму гена CYP2C9*3 (Ile359Leu) характерно снижение функции фермента, при гомозиготном состоянии – значительное. Частота встречаемости аллелей риска по генам CYP2C9*2 и CYP2C9*3 среди выборки пациентов с впервые выявленной АГ 1–2-й степеней – 11,7 и 9,2% соответственно, что коррелирует с данными о частоте встречаемости среди европейцев данных нефункциональных аллелей – 12 и 6% [9]. Аллелем риска генетического полиморфизма гена AGTR1 является С аллель, которая встречалась в 30,2% случаев среди нашей выборки и соответствует частоте встречаемости у европейцев – 27% [10]. Аллелем риска генетического полиморфизма гена AGT является С аллель, которая встречалась в 47,5% случаев среди данной выборки пациентов и соответствует частоте встречаемости у европейцев – 41% [10]. Аллелем риска инсерционно-делеционного генетического полиморфизма гена ACE является D-аллель, которая встречалась в 48,3% случаев среди данной выборки пациентов. В Соединенных Штатах афроамериканцы имеют самую высокую частоту аллеля D (89%) по сравнению с индейцами (69%) и представителями европеоидной расы (69%) [11].
В Европе население Италии, Испании и Франции также имеет высокую частоту аллеля D (82–87%) [12]. Напротив, в Азии китайцы, корейцы, тайваньцы и японцы имеют высокую частоту аллеля I гена ACE, что выше, чем в европейских популяциях (33–51% в азиатских странах против 13–27% в европейских) [13]. Аллелем риска генетического полиморфизма гена CYP11B2 является T-аллель, которая встречалась в 53,6% случаев среди пациентов данной выборки и соответствует частоте встречаемости среди европейцев (49%) и русского населения (45%) [10].
Ген CYP2C9 кодирует фермент CYP2C9 – изофермент семейства цитохрома Р-450, участвующий в метаболизме. По генетическому полиморфизму CYP2C9*2 получено следующее распределение генотипов: генотип *1*1 определялся у 141 (78,8%) пациента, частота встречаемости гетерозигот *1*2 и гомозигот *2/*2, носителей нефункционального аллеля, соответственно 34 (19%) и 4 (2,2%) пациента. По генетическому полиморфизму CYP2C9*3: генотип *1*1 определялся у 146 (81,6%) пациентов, генотип *1*3, гетерозиготы по нефункциональному аллелю – у 33 (18,4%). Представителей гомозигот по нефункциональному аллелю CYP2C9*3 в нашем исследовании не выявлено.
Ген AGTR1 расположен в эндотелии сосудов и отвечает за сигнальную трансдукцию вазоконстрикторного стимула основного эффекторного гормона ангиотензина II [14]. По результатам проведенного исследования, распределение генотипов по генетическому полиморфизму A1166C гена AGTR1 следующее: генотип АА был определен у 85 (47,5%) пациентов, генотип АС у 80 (44,7%), генотип СС у 14 (7,8%).
В исследовании K. Chen et al. [15] анализировали частоту встречаемости генетических полиморфизмов CYP2C9*3 и AGTR1 у пациентов с АГ в Китае.
В ретроспективное исследование были включены 2419 больных и 126 человек контрольной группы. Среди населения Китая авторы получили следующие результаты: частота гомозигот дикого типа по CYP2C9*3 составила 93,3%, в то время как частота встречаемости гетерозигот и гомозигот по нефункциональному аллелю CYP2C9*3 составила 6,41 и 0,29% соответственно. Частота генотипов АА дикого типа по полиморфизму A1166C гена AGTR1 составила 90,41%, в то время как частота встречаемости гетерозигот АС и гомозигот СС по нефункциональному аллелю была определена в 9,3 и 0,29% случаев соответственно. Значимой разницы в распределении генотипов среди пациентов с АГ и контрольной группы авторы не обнаружили. Комбинаций аллелей риска исследуемых полиморфизмов выявлено не было. Результаты исследования [15] коррелируют с полученными нами данными по частоте встречаемости аллеля риска по гену CYP2C9, в то время как частота носителей нефункционального аллеля С по гену AGTR1 в нашем исследовании значительно выше среди населения Москвы.
В исследовании H. Dong et al. [16] анализировали взаимосвязь носительства аллелей риска по полиморфизму А1166C гена AGTR1, CYP2C9*3 и эффективность антигипертензивной терапии ирбесартаном. Молекулярно-генетический анализ по двум полиморфизмам был выполнен 2085 пациентам, и авторами были получены следующие результаты: у пациентов мужского пола с генотипами АС и СС зарегистрировано статистически значимое различие в интенсивности снижения систолического АД (САД) и диастолического АД (ДАД) по сравнению с генотипом АА (32,3±1,3 против 29,3±0,5 мм рт.ст. и 21,6±0,8 против 19,4±0,1 мм рт.ст. соответственно; р<0,05). Пациенты с генотипами *1*3 и *3*3 гена CYP2C9*3 показали более интенсивное снижение цифр АД по сравнению с пациентами с генотипом *1*1 (34,9±15,5 против 29,3±10,2 мм рт.ст. и 22,8±9,0 против 19,6±8,5 мм рт.ст. соответственно).
В то же время в ретроспективном исследовании Y. Liu et al. [17] проанализирована эффективность монотерапии валсартаном в зависимости от генетического полиморфизма A1166C гена рецептора ангиотензина II и полиморфизма гена фермента цитохрома Р-450 CYP2C9*3. В исследование был включен 281 пациент, по результатам которого у пациентов с генотипом CC и AC по полиморфизму AGTR1 A1166C статистически значимо лучше осуществлялся контроль АГ по сравнению с пациентами, у которых определялся генотип AA (отношение шансов [ОШ]=2,836, 95% доверительный интервал [ДИ]: 1,199–6,705; р=0,018). О статистической разницы в распределении аллелей по гену CYP2C9*3 у пациентов, достигших целевого уровня АД и его не достигших, авторы не выявили.
По полученным нами данным частота носительства аллеля риска D по I/D-полиморфизму гена ACE, который отвечает за преобразование ангиотензина I в вазоактивный ангиотензин II и инактивирует брадикинин, составила 48,3%, в то время как гомозиготные по нефункциональному аллелю и носителям DD-генотипа были 45 (25,1%) пациентов, а гетерозиготными представителями ID-генотипа – 83 (46,4%).
Генотип II был выявлен у 51 (28,5%) пациента Москвы с АГ 1–2-й степеней.
В исследовании Z. Wang et al. [18] среди населения Китая была проанализирована частота встречаемости генетических полиморфизмов по гену ACE (I/D-полиморфизм), гену AGTR1 (А1166С) и гену CYP2C9 (CYP2C9*3). В исследование были включены 354 пациента с АГ (Циньян, Китай). По полученным результатам авторов частоты генотипов локусов ACE, AGTR1, CYP2C9 находились в равновесии Харди–Вайнберга, при этом частота аллелей риска по полиморфизмам изучаемых генов составила 39,27%, 6,21 и 4,8% соответственно. По результатам нашего исследования частота встречаемости аллелей риска по данному набору генов среди населения Москвы оказалась выше, что может быть связано со значительным вкладом населения стран Азии, для которых характерна более высокая частота встречаемости генотипа CYP2C9*3 [19].
В исследовании 2020 г. [20] D.D. Patel et al. изучали риск развития эссенциальной АГ у носителей аллеля риска по I/D-полиморфизму гена ACE. В исследование были включены 279 пациентов с АГ и 292 здоровых участника. Авторы определили статистически значимое увеличение шансов развития АГ при генотипе DD гена ACE (ОШ=2,09; 95% ДИ: 1,24–2,91) и пришли к выводу о прогностической значимости носительства нефункционального аллеля D по I/D-полиморфизму гена ACE как предиктора развития АГ.
В результате молекулярно-генетического анализа по однонуклеотидному полиморфизму М235Т гена AGT, который является предшественником вазоконстрикоторов ангиотензина I и II, получены следующее данные: носители генотипа СС 36 (20,1%) пациентов генотип СТ выявлен у 98 (54,7%) больных и генотип ТТ – у 45 (25,1%). Распределение частот генотипов по генетическому полиморфизму С-344T гена альдостеронсинтетазы CYP11B2, которая катализирует реакцию синтеза альдостерона, были получены следующие результаты: генотип СС определялся у 38 (21,2%) больных, генотип СТ у 90 (50,3%) и генотип ТТ у 51 (28,5%).
В исследовании X. Ji et al. [21], проведенном в Китае, в которое были включены 345 пациентов с АГ и 157 человек контрольной группы, анализировали частоту встречаемости генотипов по генетическому полиморфизму С-344T гена альдостеронсинтетазы CYP11B2. Авторы получили следующие результаты: частота встречаемости генотипа СС среди пациентов, страдавших АГ, составила 15,1%, генотипа СТ – 51,9%, генотипа ТТ – 33%. Полученные авторами результаты коррелируют с распределением генотипов по генетическому полиморфизму С-344T гена альдостеронсинтетазы CYP11B2 в нашем исследовании среди московских пациентов с АГ 1–2-й степеней. Распределение генотипов в контрольной группе среди здоровых лиц было следующим: носителями генотипа СС были 8,3% человек, генотипа СТ – 46,8%, генотипа ТТ – 44,9%. Таким образом, частота аллеля С была значимо выше у пациентов с АГ по сравнению с контрольной группой (р<0,05) среди населения Китая. В проспективной части исследования [18] 98 пациентов с АГ получали терапию валсартаном в течение 4 недель. Снижение САД, ДАД при однократном измерении, а также параметров САД, ДАД, полученных при 24-часовом мониторировании АД в группе с генотипом CC и CT, было значимо более выраженно, чем в группе с генотипом TT (р<0,05).
Т.А. Мулерова и соавт. [22] оценивали влияние генетических полиморфизмов генов РААС, включая ген AGT (М235Т), ген AGTR1 (A1166C), ген ACE (I/D-полиморфизм), на эффективность антигипертензивной терапии у больных АГ, жителей Горной Шории. По результатам исследования авторы получили следующее распределение генотипов по гену AGT: носителями генотипа ТТ были 23,7% пациентов, представителей коренного населения Горной Шории, генотипа СТ – 41,7%, генотипа СС – 34,6% пациентов; по гену AGTR1: носителями генотипа АА были 73,1% выборки, генотипа АС – 19,9%, генотипа СС – 7% пациентов; по гену ACE: носителями генотипа II были 46,2% пациентов, коренных шорцев, генотипа ID – 37,2%, генотипа DD – 16,7% пациентов. Полученные авторами данные по распределению частот генотипов по гену AGT коррелируют с нашими данными, а по гену ACE и AGTR1 в нашем исследовании более часто определялось носительство аллелей риска D и С соответственно, что подчеркивает влияние этнического фактора как на риск развития АГ, так и на эффективность антигипертензивной терапии. По результатам проспективной части исследования [22] авторы выявили, что лица коренной национальности, носители гомозигоного генотипа СС и гетерозиготы ТС, значимо лучше отвечали на назначенную им терапию блокаторами РААС по сравнению с носителями генотипа ТТ. В рамках того же исследования при изучении влияния А1166С-полиморфизма гена AGTR1 было выявлено, что в когорте шорцев достигали целевого уровня АД обладатели гомозиготного генотипа АА гена AGTR1.
В исследовании Е.В. Тимохиной и соавт. [23], целью которого было выявить частоту полиморфизма гена АПФ – ACE (I/D-полиморфизм) и гена рецептора ангиотензина II 1-го типа AGTR1 (A1166C) у женщин, беременность которых осложнилась тяжелой преэклампсией с ранним и поздним дебютом. В результате проведенного исследования авторы установили, что вероятность ранней преэклампсии в 5 раз выше у носителей генотипа DD, а наличие D-аллеля повышает риск развития тяжелой преэклампсии.
Ограничения исследования. В настоящее время выполнено ограниченное количество исследований [24–28], посвященных влиянию либо отдельных полиморфизмов генов-кандидатов, оказывающих влияние на риск развития АГ и/или на эффективность антигипертензивной терапии, либо ограниченных комбинаций полиморфизмов, которые участвуют в метаболизме антигипертензивного препарата или ответственны за определенное звено РААС, в то время как ответ на антигипертензивную терапию зависит и от генов, которые вовлечены в патогенетические механизмы развития АГ и оказывают влияние на фармакодинамические эффекты ЛС, модификации механических взаимодействий между ЛС и генами, а также полиморфизмы в генах, связанных с переносчиками ЛС. Данные этих исследований остаются противоречивыми.
Таким образом, все вышеперечисленные генетические полиморфизмы способны менять ответ на антигипертензивную терапию, в первую очередь при назначении препаратов выбора при лечении АГ, модулирующих активность РААС (ингибиторов АПФ и БРА).
В связи с этим изучение влияния полиморфизмов этих генов-кандидатов как по отдельности, так и их сочетания, представляет собой интерес для персонализации фармакотерапии АГ. Помимо влияния генов-кандидатов на фармакодинамику антигипертензивных препаратов заслуживают внимания и генетические полиморфизмы, способные оказывать влияние на метаболизм антигипертензивных ЛС, а значит, изменять плазменную концентрацию активного вещества и таким образом изменять выраженность ответа на применяемый препарат или увеличивать риск развития возможных НЛР.
В связи с этим мы изучили у каждого пациента набор ключевых известных генов-кандидатов, способных оказывать влияние на эффективность фармакотерапии БРА, что позволило сформировать для дальнейшего наблюдения группы носителей комбинаций аллелей риска устойчивости к терапии и развитию НЛР.
Заключение
Изучено распределение аллельных вариантов генов CYP2C9*2 (Arg144Cys); CYP2C9*3 (Ile359Leu), AGTR1 (A1166C), AGT (М235Т), ACE (I/D-полиморфизм), CYP11B2 (С-344T) и частота комбинаций аллелей риска у пациентов с впервые выявленной АГ 1–2-й степеней, наблюдающихся в условиях поликлиники Москвы. Отклонения от закона Харди–Вайнберга выявлено не было, что говорит о нахождении в генетическом равновесии пациентов данной группы и возможности экстраполировать результаты исследования на популяцию. Полученные нами данные во многом коррелируют с ранее опубликованными отечественными и зарубежными результатами по изучению частоты распределения нефункциональных аллелей и генотипов ключевых генов метаболизма БРА – CYP2С9 и генов фармакодинамики блокаторов РААС – AGTR1, AGT, ACE, CYP11B2. Однако среди пациентов нашей выборки, жителей Московского региона, отмечается более высокая частота встречаемости аллеля D по гену ACE и аллеля C по гену AGTR1, ассоциированных с развитием АГ.
Результаты исследования дают возможность сформировать три принципиальные группы для дальнейшего наблюдения: носители аллелей риска по генам фармакодинамики: у 16,2% данной выборки пациентов определялась комбинация аллелей риска по всем изучаемым в исследовании генам, оказывающим влияние на фармакодинамику ингибиторов РААС, ключевых факторов регуляции сердечно-сосудистой системы (AGTR1, AGT, ACE, CYP11B2); носители комбинации аллелей риска по гену метаболизма БРА CYP2С9*2 и генам фармакодинамики блокаторов РААС AGT, ACE, CYP11B2 у 6,1% пациентов данной выборки; носители комбинации аллелей риска по гену фармакокинетики CYP2C9*3 и генам фармакодинамики AGTR1, AGT, ACE, CYP11B2 у 4,5% больных. У представителей двух последних групп не только возможно развитие устойчивости к антигипертензивной терапии блокаторами РААС (иАПФ и БРА) ввиду наличия аллелей риска по генам фармакодинамики, а также по гену CYP2C9, определяющему медленный метаболизм ряда БРА, но и существует риск развития НЛР.
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационной работы: «Фармакогенетические подходы к персонализации антигипертензивной терапии блокаторами рецепторов ангиотензина II».



