Болезнь Паркинсона (БП) – прогрессирующее нейродегенеративное заболевание, требующее постоянного приема лекарственных средств, корригирующих дефицит дофамина в полосатом теле, – главный нейрохимический дефект, который лежит в основе многих клинических проявлений заболевания. Применение дофаминергических средств, прежде всего леводопы и агонистов дофаминовых рецепторов (АДР), позволяет в течение многих лет эффективно контролировать основные двигательные симптомы БП, поддерживая мобильность и повседневную активность, в конечном итоге – увеличивать выживаемость больных [1, 4].
Леводопа в терапии БП
Появление препаратов леводопы в 1960–1970 гг. позволило на годы отсрочить момент наступления инвалидизации и летального исхода у больных БП. В настоящее время леводопа остается наиболее эффективным противопаркинсоническим средством, «золотым» стандартом лечения БП. Только в отношении леводопы четко доказана способность, длительно поддерживая двигательную активность, продлять срок жизни пациента с БП.
У большинства больных БП даже умеренные дозы леводопы вызывают уменьшение симптомов заболевания, а выраженный лечебный эффект леводопы отмечается у 95% больных. Поскольку препараты леводопы остаются наиболее действенным лечебным средством на всех стадиях БП, их рано или поздно назначают практически всем больным этим заболеванием. Леводопа эффективна в отношении всех основных симптомов заболевания – гипокинезии, тремора, ригидности, хотя в отношении разных симптомов латентный период эффекта может быть неодинаков.
Однако леводопа не предупреждает прогрессирования заболевания и при длительном применении ее способность улучшать состояние пациентов с БП снижается в силу двух обстоятельств. Во-первых, по мере прогрессирования заболевания появляются и нарастают симптомы, которые с самого начала лишь частично реагируют на леводопу и могут быть связаны с дисфункцией недофаминергических систем, в т.ч. аксиальные двигательные нарушения (псевдобульбарные проявления: дизартрия, дисфагия; нарушения ходьбы и постуральной устойчивости), психические и вегетативные нарушения. На поздних стадиях заболевания именно они во многом определяют тяжесть состояния пациентов.
Во-вторых, через несколько лет после начала приема леводопы у подавляющего большинства пациентов БП меняется реакция на леводопу: появляются колебания двигательной активности (моторные флуктуации) и насильственные движения (дискинезии). Хотя применение леводопы приводит к увеличению выживаемости и продолжительности жизни больных, показано, что благоприятное действие леводопы на выживаемость проявляется лишь в первые 8–9 лет болезни, если лечение начинается до появления выраженной постуральной неустойчивости, т.е. в конце 2-й – начале 3-й стадии БП [8].
В последующем все более важную роль в клинической картине начинают играть симптомы, резистентные к леводопе, и хотя препарат продолжает оказывать лечебное действие, его влияние на выживаемость ослабевает. Таким образом, раннее начало применения леводопы позволяет пациентам с БП извлечь максимальную пользу из этого препарата.
Вместе с тем неизбежное развитие моторных флуктуаций и дискинезий через несколько лет, а иногда спустя несколько месяцев или недель после начала лечения существенно ограничивает терапевтический ресурс препаратов леводопы. Поэтому предупреждение моторных флуктуаций и дискинезий служит одним из основных приоритетов при построении стратегии лечения БП. На сегодняшний день, если БП проявилась в 50–60 лет, первые 5 лет пациента удается вести без леводопы, последующие 5 лет его состояние можно хорошо компенсировать, в основном варьируя дозой и кратностью приема препаратов леводопы, и наконец в следующие 5 лет компенсация в связи с развитием флуктуаций, дискинезий, а также нарастанием моторных и немоторных недофаминергических симптомов все более затрудняется.
Краткосрочный и долгосрочный эффекты дофаминергических средств при БП
Несмотря на короткий период полужизни леводопы в крови (около часа), в первые годы лечения БП при 3-кратном и даже 2-кратном приеме эффект леводопы остается стабильным в течение суток. Это обеспечивается наличием не только краткосрочного, но и т.н. долгосрочного эффекта леводопы, развивающегося при регулярном приеме препарата. О существовании долгосрочного эффекта можно судить по постепенному нарастанию эффекта при повторном введении стабильной дозы леводопы в течение нескольких дней или недель (в среднем около 2 недель) после изменения дозы, с другой стороны, также по отсроченному или замедленному нарастанию симптомов паркинсонизма после отмены препаратов леводопы, которое может растягиваться примерно на тот же срок – 2–3 недели (несмотря на то что концентрация леводопы в крови практически близка к нулю уже на следующее утро после ее отмены). Возобновление приема леводопы после относительно длительной паузы в приеме дофаминергических средств далеко не сразу восстанавливает долговременную реакцию. Наличие долгосрочного эффекта леводопы было подтверждено результатами исследования ELLDOPA, в котором даже спустя 2 недели после отмены малых доз леводопы больные, ранее принимавшие активный препарат, были в лучшем положении, чем в группе плацебо. Долгосрочная реакция обеспечивает не менее половины общей реакции на дофаминергические средства, прежде всего леводопу.
После приема однократной дозы леводопы улучшение, наступающее в течение нескольких десятков минут, может длиться 1–4 часа, коррелирует с подъемом концентрации леводопы в плазме и обозначается как «краткосрочная реакция». По мере прогрессирования заболевания, снижения численности нигростриарных нейронов и десенситизации постсинаптических дофаминовых рецепторов долгосрочная реакция имеет тенденцию к угасанию, на фоне которого более четко проявляется «пульс» краткосрочной реакции, принципиально не меняющей своих параметров. Полагают, что именно с этим связано развитие феномена «истощения конца дозы», а затем и «включения–выключения». Таким образом, задача отсрочить возникновение моторных флуктуаций должна быть сопряжена с таковой максимально длительного сохранения долгосрочного дофаминергического эффекта. Краткосрочная реакция имеет «стойкий» характер и сохраняется неизменно в течение большей части заболевания.
Сравнительная характеристика долгосрочной и краткосрочной реакций представлена в таблице.
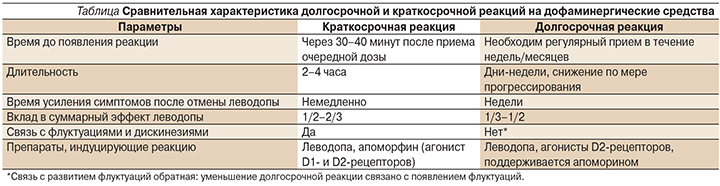
На сегодняшний день известно немного закономерностей формирования и поддержания долговременной реакции. Она быстро угасает при недостаточной суточной дозе дофаминергических средств, но не зависит от кумулятивной дозы леводопы. Она в меньшей степени зависит от числа приемов леводопы в течение дня, но у тяжелых больных лучше выражена при более частом приеме. За этим стоит предполагаемая закономерность дофаминергической терапии, согласно которой долгосрочная реакция быстрее формируется, если очередная доза принимается на фоне действия предшествовавшей дозы леводопы. С другой стороны, долгосрочная реакция быстрее угасает у более тяжелых больных, а также в более вовлеченных конечностях. Однако даже у самых тяжелых больных она не утрачивается полностью. По-видимому, долгосрочная реакция сопряжена с процессом моторного научения, а ее угасание связано с феноменом декремента в пробах на гипокинезию и хронической усталостью.
Долгосрочный эффект связывают с восполнением запасов эндогенного дофамина в пресинаптических окончаниях или перестройкой (сенситизацией) постсинаптических механизмов. Поскольку именно с редукцией долгосрочного эффекта леводопы можно связать развитие флуктуаций у больных, длительно принимающих этот препарат. Существует гипотеза, связывающая развитие долгосрочной реакции с наполнением леводопой периферического депо, однако ей противоречит возможность индукции длительной реакции АДР.
Помимо обычных (стандартных) препаратов леводопы, которые растворяются в желудочно-кишечном тракте в течение 30 минут, выпускают препараты с замедленным высвобождением (Мадопар ГСС, Синемет CR), из которых леводопа высвобождается в течение 3 часов. В результате удлиняется период, течение которого в крови поддерживается терапевтическая концентрация леводопы, а в мозге – эффективная концентрация дофамина, что позволяет уменьшить выраженность моторных флуктуаций. В то же время для этих препаратов свойственно более медленное нарастание концентрации леводопы в крови (Tmax – 1,5–3 часа) и, соответственно, медленное наступление эффекта, а также более низкая пиковая концентрация. Поэтому у части больных БП с моторными флуктуациями они не могут обеспечивать предсказуемое полноценное «включение» и могут удлинять период дискинезий. Кроме того, для препаратов с замедленным высвобождением характерна более низкая биодоступность леводопы, в результате чего ее суточную дозу приходится увеличивать в среднем на 20–30%. В раннем периоде БП при назначении препарата леводопы с замедленным высвобождением максимальная реакция достигается в течение недели, что совпадает с формированием долгосрочного эффекта, тем не менее нет данных, что при приеме пролонгированных препаратов леводопы достигается более стойкая долгосрочная реакция.
Можно ли использовать АДР для сохранения долгосрочной реакции?
АДР способны непосредственно стимулировать дофаминовые рецепторы на стриарных нейронах в обход дегенерирующих нигростриарных клеток, таким образом имитируя действие эндогенного дофамина.
Подавляющее большинство АДР главным образом стимулируют D2-рецепторы. При этом прамипексол, ропинирол и пирибедил имеют особое сродство к D3-подтипу D2-рецепторов, бромокриптин является антагонистом D1-рецеп-торов, каберголин, наоборот, имеет высокое сродство к D1-рецепторам. Пирибедил блокирует также пресинаптические α2-адренорецепторы, способствуя таким образом усилению норадеренергической передачи. Остается неясным, в какой мере эти особенности рецепторного профиля препаратов предопределяют особенности их клинического эффекта. Предполагают, что стимуляция D3-подтипа D2-рецепторов в лимбической системе сопряжена с антидепрессивным эффектом АДР, показанным в ряде исследований [2, 3]. Лишь апоморфин является агонистом как D1-, так и D2-рецепторов, имея эффект, максимально близкий к действию леводопы.
Первоначально предполагали, что АДР лучше всего использовать на поздней стадии заболевания: считалось, что они на этой стадии могут стать альтернативой леводопе, поскольку их действие не связано с дегенерирующими нигростриарными окончаниями и опосредованно сохранными постсинаптическими структурами на стриарных нейронах. Но оказалось, что на развернутой и поздней стадиях БП компенсация возможна лишь при комбинации АДР с препаратами леводопы (возможно, это связано с необходимостью одновременной активации как D1-, так и D2-рецепторов). Со временем обнаружилось, что АДР более эффективны на ранней стадии БП, когда отмечается гиперчувствительность D2-рецепторов, а уровень эндогенного дофамина сохраняется на более высоком уровне. Современные препараты АДР на ранней стадии БП способны оказывать терапевтический эффект, приближающийся к действию леводопы. Главная цель применения АДР на ранней стадии – отсрочить назначение леводопы на месяцы и годы или замедлить эскалацию ее дозы, снизив потребность в ней [4, 5, 7]. Низкий риск развития дискинезий и флуктуаций объясняется длительным действием АДР, благодаря которому они обеспечивают тоническую (квазифизиологическую) стимуляцию дофаминовых рецепторов в полосатом теле или преимущественной стимуляцией D2-рецепторов.
Следует учитывать, что откладывание момента развития моторных флуктуаций при начале лечения с АДР обычно происходит ценой более низкой эффективности и более частым развитием побочных эффектов (прежде всего тошноты, отека голеней, повышенной сонливости, импульсивно-компульсивных расстройств, зрительных галлюцинаций) [7, 8].
С увеличением длительности лечения эффективность АДР снижается, что требует дополнительного приема препаратов леводопы. Через 2 года от начала лечения не менее чем двум третям больным приходится дополнительно назначать препараты леводопы, через 5 лет на монотерапии АДР обычно остаются не более 10–15% больных. При добавлении леводопы к АДР риск осложнений (таких, как дискинезии и флуктуации) повышается. Тем не менее даже в долгосрочной перспективе (5–10 лет) начало лечения с последующим присоединением по мере необходимости препарата леводопы сопряжено с более низкой частотой дискинезий и флуктуаций, чем начало лечения с леводопы [11, 12, 13, 21].
На развернутой и поздней стадиях БП прием АДР позволяет ослаблять моторные флуктуации (феномены «истощения» конца дозы, «включения–выключения»), уменьшать длительность периода «выключения» и выраженность связанных с ним дискинезий. В тех случаях, когда добавление АДР позволяет снижать дозу препарата леводопы, это приводит и к ослаблению дискинезий «пика дозы», но этот эффект менее стойкий и не подтвержден в контролируемых исследованиях.
Агонисты D2-рецепторов способны индуцировать долгосрочную реакцию. Показано, что после приема ропинирола в течение 6 недель последующее прекращение его применения приводит к медленному нарастанию двигательных симптомов в течение недели. Лечение бромокриптином на ранней стадии БП приводит к формированию долгосрочной реакции, которая имеет те же параметры, что и при приеме леводопы. Апоморфин, являющийся агонистом как D2-, так и D1-рецепторов, поддерживает долгосрочную реакцию после отмены леводопы. Длительный прием агонистов D2-рецепторов потенциально способен уменьшить сенситизацию постсинаптических рецепторов, что теоретически должно ослаблять долгосрочную реакцию, однако этого не наблюдается на практике (нельзя исключить, что в ее поддержании существенная роль может принадлежать сенситизирующему действию краткосрочной реакции) [16, 17].
Ранняя комбинация противопаркинсонических препаратов
Длительное время считалось, что, как и при эпилепсии, при БП длительное сохранение монотерапии предпочтительнее, чем раннее применение комбинации препаратов. Исследования последних лет и главным образом клинический опыт свидетельствуют скорее о целесообразности перехода к комбинированной терапии на более ранней стадии заболевания, чем это реализуется в настоящее время. Это предопределяется несколькими важными особенностями. Во-первых, ранняя комбинация противопаркинсонических средств позволяет рассчитывать на нейропротективный потенциал препаратов, который в разных группах зависит от разных факторов. Во-вторых, ранняя комбинированная терапия позволяет поддерживать более высокую мобильность пациентов в течение всего заболевания, что имеет большое значение для баланса нейротрофических факторов, высвобождаемых в связи с физической нагрузкой и противодействующих дегенеративному процессу. Недавние исследования показали, что ранняя терапия препаратами леводопы может быть не столь «опасной», как это считалось в последние несколько десятилетий.
Показано, что применение сравнительно небольших доз препаратов леводопы (до 300–400 мг/сут) не приводит к значительному повышению риска развития дискинезий. Чтобы избежать излишне быстрой эскалации дозы леводопы, прибегают к ранней комбинированной терапии с включением в схему ингибитора МАО (моноаминоксидаза)-В, амантадина и АДР.
Применение АДР с длительным высвобождением в лечении БП
Новая лекарственная форма современных АДР ропинирола и прамипексола позволяет добиваться более высокой приверженности терапии, поскольку предполагает 1–2-кратный прием в течение суток. Если дополнительное действие прамипексола в большей степени направлено на коррекцию немоторных проявлений, действие ропинирола, лекарственная форма которого позволяет более гибко титровать дозу, способно добиваться оптимального улучшения двигательных функций, особенно в комбинации с препаратами леводопы. Тем не менее ропинирол, как и другие АДР, может быть полезным в лечении как ранней, так и развернутой или поздней стадий БП. На ранней стадии БП ропинирол (в качестве монотерапии или в комбинации с ингибитором МАО типа В, амантадином или холинолитиком) позволяет существенно улучшить основные симптомы паркинсонизма и отсрочить назначение препаратов леводопы нередко на несколько лет, а также замедлить эскалацию ее дозы, тем самым снизив риск развития моторных флуктуаций и дискинезий, неизбежно возникающих на фоне длительной терапии леводопы. Длительные проспективные исследования показывают, что даже спустя 10 лет после начала лечения у лиц, начинавших его с ропинирола, частота дискинезий была ниже, чем у пациентов, начинавших терапию с препарата леводопы [2, 5, 7, 9, 13]. На развернутой или поздней стадии препарат позволяет снижать необходимую дозу леводопы и тем самым уменьшать выраженность осложнений длительной терапии леводопы, а позднее проводить коррекцию моторных флуктуаций и дискинезий. Ропинирол и другие АДР превосходят препараты иных групп противопаркинсонических средств в эффективности при моторных флуктуациях, обеспечивая более значительное удлинение периода «выключения».
Кроме того, клинический эффект АДР отмечен тремя важными особенностями. Во-первых, у части больных выраженным тремором покоя (в т.ч. сохраняющимся при удержании позы) они способны эффективно уменьшать дрожание, даже если оно было резистентным к средним дозам леводопы. Во-вторых, по данным серии исследований, в т.ч. плацебо-контролируемых, АДР оказывают антидепрессивный эффект у больных БП с умеренной депрессией, причем этот эффект сопоставим с действием селективных ингибиторов обратного захвата серотонина. В-третьих, в эксперименте показан нейропротекторный эффект АДР, который может объясняться активацией пресинаптических ауторецепторов с уменьшением кругооборота дофамина и переходом дофаминергических нейронов в более «щадящий» режим работы, прямым антиоксидантным действием, стимуляцией трофической активности и торможением процессов апоптоза, опосредованного активацией D2-рецепторов, а также ослаблением эксайтотоксического влияния расторможенного субталамического ядра на нейроны черной субстанции [3, 6, 12, 14, 16].
Эффективность ропинирола с длительным высвобождением на различных стадиях БП подтверждена в ряде плацебо-контролируемых исследований, на основании которых пришли к выводу об эквивалентности эффекта равных суточных доз препаратов с немедленным и замедленным высвобождением, при этом профиль и частота побочных эффектов также были сопоставимыми [11]. Исследования также показали, что препарат ропинирола длительного высвобождения может быть как минимум столь же полезным в коррекции моторных или немоторных флуктуаций и дискинезий у больных БП, как и препараты АДР с немедленным высвобождением. На данный момент остается неясным: позволяет ли препарат с длительным высвобождением при раннем применении дополнительно снижать риск развития флуктуаций и дискинезий, возникающих на фоне приема леводопы [9]?
По мере развития заболевания схема его лечения неизбежно усложняется за счет увеличения количества принимаемых препаратов и кратности их приема. Это неизбежно создает проблему недостаточной приверженности пациентов лечению: чем сложнее схема лечения, чем больше препаратов пациент вынужден принимать, чем выше кратность их приема, тем чаще пациент намеренно или ненамеренно отклоняется от назначений врача. В связи с этим разработка новых лекарственных форм противопаркинсонических препаратов, обеспечивающих их длительное высвобождение и допускающих однократный прием в течение дня, не просто делает лечение более удобным, но и, улучшая приверженность пациентов лечению, повышает долгосрочную эффективность терапии. Кроме того, при медленном высвобождении препарата в течение суток достигается более стабильная его концентрация в крови, что может обеспечивать его лучшую переносимость и эффективный контроль симптомов заболевания в течение всего дня (как в дневное, так и в ночное время) [8, 10–12]. Вместе с тем более высокая приверженность лечению, достигаемая за счет уменьшения кратности приема препарата, может позволять лучше контролировать симптомы заболевания [14].
Следует подчеркнуть особое удобство новой лекарственной формы ропинирола, которую достаточно принимать 1 раз в сутки, для пациентов с ранней стадией БП, продолжающих работать [19].
Если больной в момент начала приема ропинирола не получает АДР, во избежание побочного действия препарат назначается путем гибкого титрования. Для этого таблетки ропинирола выпускаются в 3 дозировках: 2 мг, 4 и 8 мг. Лечение начинают с дозы 2 мг/сут, далее при условии хорошей переносимости каждые 7 дней переходят на следующий уровень дозы до достижения оптимального эффекта – максимально до 24 мг/сут (см. таблицу). После достижения дозы 8 мг/сут титрование целесообразно проводить медленнее, т.к. развитие полного лечебного эффекта может требовать нескольких недель. Рекомендуемая доза для поддерживающей терапии на ранней стадии составляет от 4 до 12 мг/сут, на развернутой или поздней стадиях заболевания доза может колебаться от 8 до 24 мг/сут [8, 20, 23].
Рационально принимать препарат примерно в одно и то же время суток, наиболее удобное для пациента. Практический опыт показывает, что для пациентов с ранней стадией БП предпочтителен прием препарата в утренние часы. Время приема пищи может не учитываться.
Если ропинирол начинает принимать пациент, уже находящийся на лечении леводопой, доза последней может быть снижена, однако это не должно быть самоцелью. Снижение дозы леводопы несомненно показано при возникновении дофаминергических осложнений либо в тех случаях, когда она явно чрезмерная. Наш практический опыт показывает, что после приема ропинирола больными, ранее принимавшими леводопу, ее дозу в течение первых 6 месяцев можно снижать более чем половине больных, больным I–II стадиями – в среднем на 20% , больным с III–IV стадиями – на 10%. В то же время, если у больных БП I–II стадий доза леводопы после первоначального снижения оставалась стабильной по крайней мере в течение 12 месяцев, то у пациентов с III–IV стадиями к концу года наблюдения для поддержания мобильности дозу леводопы пришлось вновь увеличить и она возвращалась к исходному уровню [5].
Следует подчеркнуть, что если принимаемый пациентом АДР приносит ему ощутимую пользу, его не следует менять на другой внешне «более привлекательный» препарат. Замена имеет смысл, если ранее назначенный АДР в адекватных дозах неэффективен или вызывает неприемлемые побочные эффекты [4]. Для замены одного АДР на другой чаще используют т.н. быструю схему замены препаратов, которая предполагает одномоментное переключение с одного препарата на эквивалентную дозу другого препарата. Привлекательность данной схемы определяется не только ее простотой, но и отсутствием опасности ослабления эффективности терапии и синдрома отмены АДР [26–28]. На практике выбор варианта определяется клинической ситуацией.
Если замену АДР производят из-за его недостаточной эффективности, следует придерживаться быстрой замены по принципу эквивалентности доз, согласно которому 4 мг ропинирола (как с немедленным, так и с замедленным высвобождением) примерно соответствует по эффективности:
- 1 мг прамипексол;
- 3 мг ротиготина;
- 10 мг бромокриптина;
- 100 мг пирибедила (каждая из этих доз примерно соответствует эффекту 100 мг леводопы) [27, 28].
Вместе с тем следует учитывать, что отдельные пациенты могут быть более или менее чувствительными к тем или другим препаратам. В силу этого при замене препарата между врачом и пациентом должна существовать возможность обратной связи. Только если замена агонистов проводится из-за плохой переносимости ранее принимаемого препарата, то при переключении новый препарат следует обязательно назначать в дозе, ниже эквивалентной [14, 18, 20, 24].


