Введение
В России, как и во всем мире, существует тенденция к увеличению доли пожилых людей в общей популяции. Так, за 20-летний период (с 1996 по 2016 г.) процент пожилых людей увеличился с 16,8 до 21%, что в абсолютных цифрах составило более 5 млн [1]. Подобный рост неизбежно привел и к увеличению заболеваний, ассоциированных с возрастом. Наиболее значимо это отразилось на проблеме когнитивных нарушений и нейродегенеративной патологии, связь которых с возрастом не вызывает сомнений. Болезнь Альцгеймера (БА) – самое частое нейродегенеративное заболевание центральной нервной системы (ЦНС), в ряде стран признано настоящей пандемией ХХI в. с ожидаемым приростом больных данной нозологией в ближайшей перспективе почти в 3 раза [2]. И если в развитых странах с помощью активных профилактических мероприятий у лиц молодого и среднего возраста удалось несколько приостановить прирост заболеваний с когнитивными расстройствами, то в России, как и в развивающихся странах, данная проблема стоит очень остро, приобретая масштабы не только медицинской, но и социальной катастрофы. Если экстраполировать данные мировой статистики на половозрастную структуру нашей популяции, то за тот же 20-летний интервал прирост пациентов с деменцией должен был составить около 500 тыс. человек (с 1,3 млн человек в 1996 г. до 1,8 млн в 2016-м) [1].
Еще более пессимистично выглядят цифры по умеренному когнитивному расстройству (УКР). Современные эпидемиологические данные по распространенности УКР в популяции широко варьируются в разных странах, обозначая ориентировочную частоту встречаемости от 10 до 15% [2]. Таким образом, опираясь на международную статистику, в нашей стране представленность УКР может колебаться от 3, 2 до 4, 8 млн человек, в среднем составляя около 4 млн. Применимо к нашей популяции даже при оптимистичной частоте в 10% прирост пациентов с УКР в тот же 20-летний период мог составить 750 тыс. Несмотря на столь внушительные цифры и тенденции к увеличению распространенности, процент выявляемости даже по деменции остается крайне низким и составляет не более 10%, причем это касается как неврологической, так и психиатрической службы. Диагноз БА, самой частой причины выраженных когнитивных нарушений, выставляется с частотой, не превышающей 1% от ожидаемого количества, а адекватную терапию, направленную на замедление прогрессирования симптомов, получают менее 2% больных [1]. Еще реже в рутинной клинической практике проводится корректная оценка УКР и его клинической и нозологической гетерогенности. При этом выявление ДКР, особенно форм, имеющих высокие риски последующей конверсии в деменцию, могло бы значительно повлиять на сложившиеся негативные тенденции. Ведь если отсрочить сроки наступления деменции на 5 лет, то ее распространенность через 50 лет снизится на 50%, а если сдержать наступление деменции на 10 лет, то это позволит почти полностью искоренить эту проблему [3]. Ранняя и дифференцированная диагностика ДКР способна расширить терапевтическое окно, стабилизировать и замедлить траекторию когнитивного снижения, правильно оценить прогноз пациента и максимально длительно поддерживать бытовую автономию, что несомненно является важной клинической задачей.
Когнитивные нарушения, не достигающие степени УКР: субъективные, легкие или парциальные?
К настоящему моменту не существует общепринятой классификации и терминологии ДКР. Чаще всего в литературе можно встретить термин пред-УКР для обозначения тех расстройств, которые не достигли степени УКР или деменции [4]. Нам такой подход видится не совсем рациональным с учетом гетерогенности этих состояний. Кроме того, данные нарушения не могут расцениваться только как стадия, «предшествующая» УКР, т.к. по течению часть этих случаев обратима, часть остается стационарной, никогда не прогрессирует и только некоторый процент в последующем будет прогрессировать до УКР и деменции. Мы предлагаем отдельно выделять некоторые стадии когнитивного дефицита до УКР: субъективное и легкое когнитивное снижение, а также парциальный вариант УКР.
Субъективное когнитивное расстройство (СКР) может быть выставлено при наличии у пациентов жалоб на снижение памяти, внимания или других когнитивных функций, однако без объективного подтверждения каких-либо отклонений при нейропсихологическом тестировании и оценке функциональной активности человека. И несмотря на то что результаты мета-анализов показывают, что жалобы пациента только в 20–30% случаев свидетельствуют о реальном когнитивном снижении, субъективное когнитивное снижение может быть значимо в оценке рисков дальнейшего развития УКР и деменции [6, 7]. Определяющую роль для понимания природы СКР играет возраст человека. У пациентов молодого и среднего возраста СКР отражает дефицит внимания, трудности переключения при большом потоке входящей информации. Чаще всего у молодых пациентов СКР ассоциировано с депрессией и тревогой, которые компенсируются при адекватной коррекции аффективного статуса. В более старших возрастных группах, согласно концепции PASA (posterior-anterior shift aging), происходит переключение функционально-активных зон с задних корковых на передние корковые отделы, таким образом, внимание перестает играть определяющую роль в когнитивных процессах [8]. Несмотря на то что с возрастом происходит естественное снижении скорости когнитивного функционирования, данный дефицит компенсируется опытом, мудростью и поведенческими реакциями, приобретаемыми в течение жизни. С учетом этих компенсаторных механизмов люди пожилого возраста менее завязаны на дефицит внимания в отличие от лиц молодого и среднего возраста, поэтому СКР в этой возрастной группе в большей степени может быть связано с органическими, «стойкими» причинами [8]. Согласно современным эпидемиологическим данным, даже изолированно субъективное снижение когнитивных функций у пожилого человека – один из факторов, повышающих риск конверсии в деменцию, что обусловливает необходимость динамического наблюдения за такими пациентами с регулярной оценкой нейропсихологического статуса [6]. Интересно, что и в этом возрасте отмечена корреляция СКР с депрессией с возможностью коррекции когнитивных нарушений терапией антидепрессантами, однако здесь депрессия выступает скорее как сопутствующее клиническое проявление, чем как первопричина. Так, в 30% случаев при развитии депрессии у пожилых людей выявляется значимое отложение β-амилоида, ключевого маркера БА. СКР и депрессия могут быть первыми симптомами текущего дегенеративного процесса и требуют как диагностики, так и корректного ведения пациента [9].
Термин «легкие когнитивные нарушения» (ЛКН) не представлен в современных подходах к классификации ДКР, однако в нашей стране он используется достаточно активно. Теоретически отличием ЛКН от СКР может являться ухудшение выполнения нейропсихологических тестов в динамике от предшествовавшей индивидуальной нормы человека, однако в рамках возраст-допустимых значений (например, снижение фонетической речевой активности в течение года с 18 до 15 слов в минуту, что, однако, соответствует возрастной норме в 14 слов) [10]. То есть ЛКН как отклонение от индивидуальной, а не от возрастной нормы – допустимый термин, однако он требует подтверждения динамики когнитивных тестов, что труднореализуемо в рамках рутинной клинической практики, поэтому его лучше не использовать.
Многие авторы предложили классификацию когнитивных расстройств, выходящих за рамки СКР, однако пока не достигших степени УКР. Так, Jessen et al. предложили классифицировать все ДКР на СКР, раннее и позднее УКР [5]. Однако разделение по временному признаку и по степени тяжести делает термин «раннее УКР» одной из стадий единого процесса, что не очень корректно, поскольку когнитивные нарушения, не достигающие степени УКР, могут никогда не спрогрессировать до умеренных.
D.A. Loewenstein et al., основоположники термина пред-УКР (пред-MCI), на основании широкого набора нейропсихологических тестов показали гетерогенность состояний, не достигающих степени УКР, и предложили выделять пред-УКР функционального и нейропсихологического типов [11].
Нам видится наиболее целесообразным расценивать данный тип нарушений как парциальный тип УКР (п-УКР):
- Функциональный вариант п-УКР – когда в ходе беседы с пациентом, оценки его понимания, вовлеченности в дискуссию, готовности к общению, а также после развернутого опроса ухаживающего лица об изменении функциональной активности по сравнению с предшествовавшим уровнем у врача создается впечатление о когнитивном снижении пациента, однако выполнение нейропсихологических тестов не выявляет значимых отклонений от возрастной нормы.
- Нейропсихологический вариант п-УКР – когда ни у врача, ни у родственника не создается впечатления о когнитивном снижении пациента, однако при тестировании выявляется отклонение от нормы (до 1,5 стандартных отклонений) в одной или более когнитивных сферах. Чаще всего эти отклонения отмечаются в тестах, имеющих временные ограничения (за счет снижения концентрации и устойчивости внимания, а также скорости психомоторных реакций), а также в тесте на отсроченное воспроизведение информации.
Термин «парциальный» (избирательный, изолированный) наиболее полно отражает суть подобного разделения, ведь при сочетании этих двух форм когнитивное снижение пациента должно быть расценено как истинное УКР.
D.A. Loewenstein et al. четко показали, что когнитивные нарушения еще до развития УКР служат достоверно более значимым фактором риска развития деменции по сравнению с возрастной нормой. И несмотря на то что при нейропсихологическом варианте, особенно с нарушением выполнения тестов на оценку мнестической сферы, риск конверсии в деменцию и УКР наибольший, при функциональном варианте (основанном на впечатлении врача) по сравнению с возрастной нормой этот риск также достоверно увеличивается [11].
Умеренное когнитивное расстройство
УКР – это синдром, который может развиваться в рамках ряда состояний (как продромальная стадия некоторых нейродегенеративных заболеваний, сосудистой патологии мозга, различных интеркуррентных состояний, «псевдокогнитивного расстройства» или депрессии и т.д.) [12–14]. УКР может быть обратимо до возрастной нормы, может иметь ремиттирующее течение, а может постепенно прогрессировать, приводя к развитию деменции.
Эпидемиология УКР
Распространенность УКР, по данным разных авторов, весьма вариабельна. Это может быть связано с постоянным пересмотром концепции УКР, использованием различных критериев диагностики, а также исследованием различных возрастных групп. Так, по данным O.L. Lopez et al., среди общей популяции лиц старше 70 лет на долю пациентов с УКР приходится порядка 19% [15], однако в исследовании LAMICs, крупном многоцентровом проекте стран с низким и средним уровнями дохода, законченном в 2012 г., этот процент оказался разительно ниже – от 0,6 до 4,6% [16]. В среднем доля пациентов с УКР составляет от 10 до 15% среди лиц пожилого возраста. Отмечена негативная динамика по распространенности УКР. Так, еще в 2010 г. систематизированные обзоры говорили о цифрах от 9,9/1000 до 40,6/1000 человек, в то время как более современные работы указывают на цифры 63,6/1000 и 111,09/1000 человек в год [15, 17]. Частично обнадеживают данные о высоком проценте обратимости УКР до возрастной нормы. Так, во французском исследовании PAQUID (2002) авторы отметили, что порядка 40% пациентов с исходно диагностированным УКР при динамическом наблюдении вернулись к возрастной норме [18]. Однако и здесь отмечены негативные тенденции. Современные работы выявляют более низкий процент потенциально обратимых форм УКР – 9,5 [19] и 16% [20] по разным данным. Доказанные предикторы обратимости УКР: отсутствие гена APOE4, более высокий балл MMSE (Mini-Mental State Examination), а также отсутствие значимых мнестических нарушений. Однако необходимо отметить, что даже в случае разрешения УКР до возрастной нормы в долгосрочной перспективе у этих пациентов сохраняется более высокий риск развития деменции по сравнению с общей популяцией [18].
Критерии диагностики УКР
Критерии диагностики УКР неоднократно пересматривались и до сих пор служат предметом обсуждения. Так, в 2004 г. концепция УКР подразумевала только субъективные и объективно выявляемые отклонения от возрастной нормы в любой из когнитивных сфер [22]. Позднее той же группой авторов к критериям УКР была добавлена оценка функциональной активности пациента, которая должна быть минимальной и не приводить к социальной дезадаптации и утрате бытовой автономии [23]. Европейским консорциумом по БА были сформулированы и одобрены следующие критерии диагностики УКР [24].
- Жалобы на когнитивные проблемы со стороны самого пациента или его семьи.
- Снижение когнитивных функций в период более года по сравнению с предшествовавшим уровнем.
- Выявляемое при нейропсихологическом тестировании снижение более чем на 1 стандартное отклонение от возрастной нормы хотя бы в одной из когнитивных сфер (память, регуляторные функции, зрительно-пространственные функции и др.).
- Отсутствие значимого влияния когнитивного снижения на повседневную активность.
- Отсутствие деменции.
При переходе на Международную классификацию болезней 11-го пересмотра (МКБ-11) термин УКР будет заменен на малое нейрокогнитивное расстройство (а термин «деменция» – на большое нейрокогнитивное расстройство).
В DSM (Diagnostic and Statistical Manual of Mental Disorders) 5-го пересмотра предложены следующие критерии малого нейрокогнитивного расстройства:
- умеренное когнитивное снижение от предшествовавшего уровня в одной или более когнитивных сферах (по информации от ухаживающего лица или врача либо по результатам нейропсихологического тестирования);
- отсутствие значительного влияния на повседневные действия (допускается отклонение в инструментальной повседневной активности, но при сохранности компенсаторных стратегий);
- отсутствие причинно-следственной связи с делирием;
- отсутствие психического заболевания, которое могло бы объяснить данное нарушение.
Интересно, что по этим критериям допускается подтверждение когнитивных расстройств не только в ходе нейропсихологического тестирования, но и по данным информанта и врача, что расширяет границы диагностики, позволяя к малому когнитивному расстройству отнести не только УКР, но и его парциальные варианты. Однако использование данного термина – пока вопрос будущего.
Отдельно в МКБ-11 обозначено малое нейрокогнитивное расстройство амнестического типа, что подтверждает важность типологизации ДКР с выделением отдельных клинических форм.
Клинические варианты УКР
В 2004 г. R.C.Petersen et al. предложили разделять УКР на амнестический (а-УКР) и неамнестический подтипы (на-УКР) [37].
По числу нарушенных сфер а-УКР и на-УКР дополнительно подразделялись на моно- и многофункциональные в зависимости от доминирующего когнитивного дефекта и наличия или отсутствия отклонений по другим когнитивным доменам [22, 25].
Предложенное разделение успешно позволяло выявлять пациентов с начальными проявлениями БА при наличии у них а-УКР. В 2011 г. амнестический тип УКР при наличии соответствующих биомаркеров был включен в критерии диагностики БА [26]. Однако для остальных нейродегенеративных заболеваний и сосудистой деменции, также имеющих высокие риски конверсии, данная классификация оказалась нечувствительной, что обозначило необходимость дальнейших поисков.
Более комплексный этиологический подход основан на выявлении специфических типов УКР, согласно особенностям нейропсихологического профиля. Впервые описанный О.С. Левиным в 2006 г. [3], он нашел подтверждение в работах Hence et al. и Sayantani Ghosh et al. [12].
Согласно этой классификации, можно выделить 4 основных типа УКР, причем ее преимуществом является формирование некоей нозологической структуры УКР:
1. Амнестический тип характеризуется особым нейропсихологическим профилем, когда при тестировании выявляются преимущественные нарушения мнестических функций. Причем данные нарушения памяти затрагивают непосредственно процесс хранения и консолидации информации, что проявляется в нарушении не только самостоятельного воспроизведения, но и опосредованного узнавания при помощи подсказок (отсутствие «следов памяти»). Амнестический синдром может как быть изолированным, так и сочетаться с другими когнитивными нарушениями, преимущественно опосредованными задними корковыми отделами (речь, праксис, гнозис и т.д.), однако с четким преобладанием дисфункции памяти. При сочетании с нарушением в других когнитивных доменах у пациентов может отмечаться снижение семантической речевой активности (называние растений, животных), а также в тесте как самостоятельного рисования, так и копирования часов (как проявление зрительно-пространственных нарушений). Данный тип УКР наиболее часто ассоциирован с последующим развитием БА («продромальная» стадия).
2. Дизрегуляторный тип УКР характеризуется преимущественным нарушением регуляторных функций.
У таких пациентов возникают трудности в выполнении задач, связанных с планированием, сложным поэтапным действием, мышлением. В тестах на память могут выявляться нарушения, связанные с трудностями поиска информации при сохранности запоминания, что проявляется в хорошем эффекте подсказок при опосредованном узнавании материала. Речевые нарушения связаны с трудностями поиска слов на определенно заданную букву (фонетическая речевая активность). Дизрегуляторный тип нарушений связан с дисфункцией лобных долей, чаще всего вторичной, за счет нарушения функциональных связей подкорковых структур с префронтальной корой. Данный тип УКР, по нашим наблюдениям, наиболее характерен для дисциркуляторной энцефалопатии, но может наблюдаться и при болезни Паркинсона, болезни Гентингтона, депрессии и других формах.
3. Смешанный тип УКР характеризуется значительными нарушениями мнестических функций в сочетании с дизрегуляторными нарушениями. Здесь необходимо отметить, что выявление смешанного типа УКР не служит предиктором развития смешанной деменции. При конверсии данного типа УКР в деменцию может произойти трансформация и в БА, и в деменцию с тельцами Леви, и в сосудистую деменцию.
4. Монофункциональный тип УКР – особый вариант УКР, при котором мнестическая сфера, как правило, остается интактной, но отмечается диспропорционально грубое снижение в одном из других когнитивных доменов (чаще зрительно-пространственных или речевых). Данный тип УКР при прогрессировании чаще всего приводит к развитию деменции с тельцами Леви в случае зрительно-пространственных нарушений, либо первично-прогрессирующей афазии при наиболее грубом отклонении в афатической сфере [3].
Данная классификация нам видится наиболее полной, максимально приближенной к этиологической структуре заболеваний. Выявление того или иного типа УКР позволяет, в некоторой степени «заглядывая в будущее», избегать некоторых тактических ошибок в ведении таких пациентов, выбирать наиболее подходящую терапевтическую стратегию с учетом индивидуальных особенностей пациента и того заболевания, которое пока не проявило себя в достаточной мере.
УКР с высоким риском конверсии в деменцию
Наиболее пристального внимания врачей в рамках концепции УКР заслуживает риск его возможного прогрессирования с последующей конверсией в деменцию. Все попытки более дифференцированного подхода, выделение различных типов УКР и постоянные пересмотры диагностических критериев направлены именно на максимально раннее выявление группы риска. Данные авторов о возможности конверсии в деменцию у пациентов с УКР весьма разнятся. Это связано с использованием разных критериев и подходов к классификации. Так, R.C. Petersen et al. оценивали риск конверсии УКР в деменцию как 12% [27]. Позднее в другом исследовании, также основываясь на классификации УКР на амнестический и неамнестические типы, после наблюдения за 581 больным в течение 30 месяцев был отмечен достоверно больший риск конверсии у пациентов с амнестическим профилем когнитивных нарушений (а-УКР) по сравнению с теми, у кого выявлены отклонения в других когнитивных сферах (на-УКР): 48,7 и 28,6% соответственно [28]. В той же работе отмечено, что амнестический профиль УКР не является строгим предиктором БА и может приводить к развитию других нозологических форм деменции, а неамнестический вариант УКР не исключает возможности развития БА.
Разрушение длительно существующей парадигмы, что выявление амнестического нейропсихологического профиля УКР служит явным предиктором развития БА, позволило предположить, что УКР с высоким риском конверсии в деменцию («продромальная стадия БА) должно рассматриваться в более широких диагностических рамках и включать не только особенности нейропсихологического профиля.
Наше наблюдение за больными позволило выделить следующие особенности проявления УКР с высоким риском конверсии в деменцию [3, 10]:
- Быстрое прогрессирование когнитивного дефицита.
- Преимущественное нарушение мнестических функций со снижением эффективности подсказок при отсроченном воспроизведении информации.
- Низкая семантическая речевая активность.
- Нарушение инструментальной повседневной активности.
- Атрофия гиппокампа (по данным магнитнорезонансной томграфии головного мозга) и/или выявление биомаркеров (тау, фосфотау, αβ42 в цереброспинальной жидкости) [38].
По нашему мнению, именно такое сочетание признаков позволит выделить из больных УКР амнестического типа группу пациентов, которые уже на этапе относительно умеренного когнитивного снижения могут быть расценены как пациенты с «продромальной стадией БА», что дает некоторую амнистию на назначение противодементных препаратов еще на этапе УКР.
УКР и повседневная активность
Согласно критериям, предложенным Европейской ассоциацией по изучению БА, при УКР у пациентов не должно отмечаться значимых снижений повседневной активности (кроме наиболее сложных). Длительное время нарушение повседневной активности рассматривалось диагностическим коррелятом деменции и исключало возможность наличия УКР. Первые статистически подтвержденные данные, будто уровень повседневной активности у пациентов с УКР может быть нарушен, были опубликованы группой немецких исследователей, которые доказали, что даже на этапе УКР оценка уровня повседневной активности достоверно ниже, чем в здоровой популяции [23]. Основываясь на этих данных, в 2008 г. T. Giovanetti et al. предложили внести эти нарушения как один из диагностических критериев УКР [30]. С учетом неоднозначности результатов разных авторов эти критерии не были одобрены, однако жесткая формулировка «отсутствие нарушения повседневной активности» в основных критериях была заменена на «сохранность базисных повседневных навыков с возможным минимальным снижением инструментальной повседневной активности». Позже были опубликованы данные, согласно которым УКР связано с нарушением таких функциональных возможностей, как забота о собственном благополучии и здоровье, а также ведение финансовых дел [30]. Именно взаимодействие с окружающими людьми, нарушение мотивационной сферы и снижение интереса, внимания и заботы о собственном здоровье (контроль приема лекарств, заинтересованность собственными анализами, лечением) по нашему наблюдению является одним из первых проявлений объективно значимого когнитивного снижения. В 2012 г. J.C. Morris et al. повторно обратились с предложением о пересмотре критериев, показав в своей работе, что у пациентов с УКР в умеренной степени могут быть нарушены оплата счетов, приготовление пищи и осуществление покупок, что в целом может частично ограничивать их бытовую автономию [31]. Таким образом, оценка функционального статуса важна на любом этапе когнитивного снижения и требует активного развернутого расспроса ухаживающих за пациентом лиц. Значительные трудности возникают при отсутствии ухаживающего лица, особенно это актуально для пациентов, находящихся на стационарном лечении, что требует поиска инструментов для функциональной оценки у больных этой когорты.
Для оценки возможностей дифференцированного подхода к диагностике ДКР с учетом разных форм и функциональной активности нами было проведено исследование с включением 104 пациентов, находящихся на лечении в Госпитале для ветеранов войн № 1 Москвы. Пациенты находились на плановом лечении в отделениях терапевтического профиля (кардиология, неврология, терапия), и набор осуществлялся методом сплошной выборки. Ни у одного из пациентов на момент включения в исследование не было выставлено диагноза «синдром когнитивных нарушен» (ни УКР, ни деменции). Единственным критерием включения была возможность выполнения нейропсихологического тестирования, т.е. пациенты должны были обладать достаточным зрением, слухом, способностью писать и т.д. Критерием исключения были случаи экстренных госпитализаций по поводу ургентных состояний (инсульт, инфаркт, пневмонии и т.д.), а также наличие выраженной депрессии.
Возраст пациентов, включенных в исследование, составил 84,5±3,8 года с разбросом от 72 до 94 лет. Подавляющее большинство составили женщины: 82 против 22 мужчин.
Всем больным проведена оценка когнитивных нарушений с помощью валидизированных шкал: шкала краткого исследования психического статуса (MMSE) [32] и Монреальская когнитивная шкала MoCA (Montreal Cognitive Assessment) [33].
По результатам тестирования средний балл шкалы MMSE в целом по выборке составил 24,6±4,8, Монреальской когнитивной шкалы – 18,1±5,0 баллов. Таким образом, по результатам нейропсихологического тестирования абсолютно все пациенты, находившиеся на плановом лечении в госпитале, должны были иметь значимое когнитивное снижение, хотя большинство пациентов полностью или частично себя обслуживали и вне стационара были способны к самостоятельному проживанию. C учетом трудностей интерпретации полученных результатов, значительного отклонения от нормы в ряде субтестов и их несоответствия клиническому впечатлению нами была разработана собственная шкала для оценки функциональной активности в условиях стационара, которую заполнял медицинский работник, наблюдавший за поведением пациента (табл. 1). В шкале учитывались возможности как инструментальной, так и неинструментальной активности, а также клиническое впечатление медицинского персо-нала.
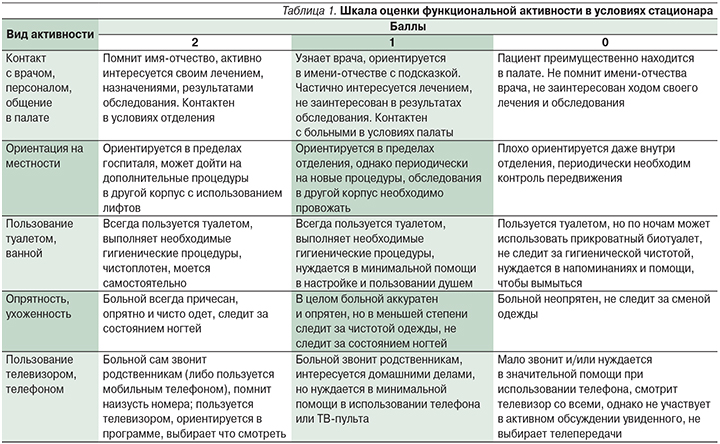
Оценка 10 баллов подразумевает отсутствие снижения функциональной активности, 9 – допустимая оценка для УКР. Показатель менее 9 баллов трактовался как значимое снижение повседневной активности, характерное для деменции. Учет функционального статуса и данных нейропсихологического тестирования позволил распределить пациентов по степени когнитивного снижения на парциальный тип УКР, УКР и деменцию (табл. 2).

У 22 (21%) пациентов учет нейропсихологических и функциональных ограничений позволил выявить деменцию, у 45% выявлено УКР и еще 35 (34%) пациентов были отнесены к парциальному варианту УКР. Оказалось, что диагностика только на основании результатов нейропсихологических шкал обладает низкой чувствительностью и специфичностью, давая как ложноположительные, так и ложноотрицательные результаты. Использование предложенной нами шкалы в сочетании с оценкой нейропсихологических тестов показало хорошую чувствительность и позволило более дифференцированно оценить степень когнитивных расстройств с выработкой индивидуальной стратегии дальнейшего ведения пациента.
Терапия пациентов с ДКР
На сегодняшний день не существует средства, способность которого замедлять развитие деменции у пациентов с УКР была бы доказана в адекватных длительных плацебо-контролируемых исследованиях. Возможно, это связано с гетерогенностью УКР, вариабельной степенью риска конверсии в деменции при различных типах ДКР.
Из общих мер можно отметить следующие:
- коррекция факторов риска кардиоваскулярных заболеваний, прежде всего коррекция артериальной гипертензии (пациентам с когнитивными нарушениями желательно стремиться к стабилизации артериального давления на верхней границе нормы), гиперлипидемии, сахарного диабета, метаболического синдрома, гипергомоцистеинемии;
- лечение сопутствующих заболеваний, особенно протекающих с хронической сердечной и дыхательной недостаточностью;
- отмена или снижение дозы препаратов, способных оказать негативное влияние на когнитивные функции, прежде всего с седативным и холинолитическим действиями.
Если когнитивное снижение у пациента развивается на фоне значимых аффективных нарушений, можно рассматривать назначение антидепрессантов, однако важно учитывать, чтобы антидепрессант сам по себе не оказывал негативных действий на когнитивные функции, а также обладал хорошим противотревожным действием, поскольку провокация тревожного аффекта может дополнительно усугубить дефицит внимания.
Важной задачей предупреждения деменции может быть формирование когнитивного резерва. Решение этой задачи достигается прежде всего адекватной умственной и физической нагрузкой, активной социальной деятельностью, методиками направленной нейропсихологической реабилитации, а также применением средств, усиливающих когнитивные функции [10].
Одним из вариантов медикаментозной терапии может быть применение Акатинола Мемантина – модулятора глутаматных рецепторов NMDA-типа. Его эффект показан в массе плацебо-контролируемых рандомизированных исследований пациентов с различными формами выраженных когнитивных нарушений: БА, сосудистой деменции, деменции при болезни телец Леви и других, что позволяет надеяться на клинический эффект и при разных нозологических типах УКР. Кроме того, существует ряд теоретических предпосылок к использованию Акатинола Мемантина пациентами с ДКР. Прежде всего следует учитывать возможность нейропротекторного действия, которое может быть связано с блокадой как эксайтотоксического эффекта, так и специфического действия, связанного с противостоянием процессам образования амилоида, фосфорилирования τ-протеина, одними из наиболее важных звеньев дегенеративного процесса при БА. Кроме того, помимо коррекции глутаматергической передачи Акатинола Мемантин способен стимулировать дофаминергическую нейротрансмиссию, приводя к дополнительному стимулированию префронтальной коры и улучшению функции внимания. Именно дополнительной стимуляцией синтеза дофамина можно объяснить показанное в ряде работ действие Акатинола Мемантина на коррекцию аффективных нарушений, в частности уменьшение апатии и депрессии [34].
Нами было проведено исследование эффективности Акатинола Мемантина у пациентов с УКР. В качестве группы сравнения был выбран пирацетам. Через 6 месяцев терапии у пациентов группы Акатинола Мемантина отмечено значительное улучшение состояния по шкале общего клинического впечатления, достоверно в большем проценте случаев по сравнению с пирацетамом. При сравнении двух групп пациентов, получавших 10 мг Акатинола Мемантина, через 6 месяцев были лучше показатели качества жизни и меньше уровень депрессии по сравнению с группой сравнения. Нам удалось выявить вариабельность клинического эффекта при применении акатинола. У пациентов с дизрегуляторным типом УКР отмечена статистически достоверная разница по большинству нейропсихологических тестов на фоне применения Акатинола Мемантина по сравнению с пирацетамом. При амнестическом типе УКР эффект был более умеренным и значимый результат спустя 6 месяцев терапии удалось получить только по показателям логической памяти без достоверной разницы по общему баллу шкалы MMSE до и после лечения. Однако по сравнению с пирацетамом динамика балла MMSE у пациентов на фоне терапии Акатинолом Мемантином оказалась достоверно более значимой [10]. Подтверждением целесообразности применения Акатинола Мемантина у пациентов с амнестическим типом УКР может быть показанное в работе Н.Н. Яхно и соавт. увеличение количества β-амилоида в ликворе на фоне терапии пациента, что может говорить не только о значимом клиническом, но и о нейропротективном действии препарата [35, 36].
В нескольких работах был продемонстрирован положительный эффект терапии Акатинолом Мемантином и для пациентов с УКР в рамках болезни Паркинсона, посттравматической энцефалопатии и дисциркуляторной энцефалопатии, что расширяет диапазон возможного применения препарата [1].
Заключение
Таким образом, дифференцированный подход к диагностике ДКР с оценкой как нейропсихологического, так и функционального статуса пациента позволит оптимизировать тактику ведения пациентов. Индивидуализация терапии с учетом типа УКР, риска его дальнейшей конверсии позволит не только улучшить когнитивный статус, но и сохранить функциональную активность пациента, улучшить качество жизни не только самого больного, но и окружающих его людей.


