Втечение многих лет одной из актуальных проблем тиреоидологии остается диффузно-токсический зоб (ДТЗ). Как известно, на его долю приходится более 80% всех случаев синдрома тиреотоксикоза. Распространенность ДТЗ в общей популяции достигает 2–5%, ежегодная заболеваемость – 5–7 человек на 100 тыс. населения [1]. Несмотря на все принимаемые меры, уровень осложнений со стороны сердечно-сосудистой системы (ССС) при ДТЗ остается высоким [2]. В отсутствие своевременной диагностики и лечения заболевание может приводить к тяжелым нарушениям ритма и развитию хронической сердечной недостаточности (ХСН), которые могут служить причиной потери трудоспособности, тяжелой инвалидизации пациентов [3]. По мнению многих исследователей, к основным причинам ДТЗ относятся нарушения иммунной системы [4] и генетические факторы [5]. Вместе с тем избыточная или недостаточная обеспеченность организма микроэлементами, участвующими в синтезе тиреоидных гормонов и антиоксидантной защите клеток, вероятно, может утяжелять течение тиреотоксикоза и послужить одной из причин развития сердечно-сосудистых осложнений (ССО) [6]. Известно, что одним из незаменимых микроэлементов, необходимых для жизнедеятельности человека, является медь – составной компонент супероксиддисмутазы, ответственной за ингибирование процессов перекисного окисления липидов (ПОЛ) мембран клеток, а также медь-зависимого фермента – лизилоксидазы, участвующей в образовании поперечных сшивок коллагеновых и эластических волокон [7]. Установлено, что медь является реактантом острой фазы воспалительных процессов, компонентом церуллоплазмина, обладающего антиоксидантными свойствами и защищающего липидные мембраны от ПОЛ, а также компонентом фермента цитохром-с-оксидазы, участвующей в синтезе аденозинтрифосфата (АТФ). Проведенные ранее исследования показали наличие зависимости содержания меди в организме от уровня тиреоидных гормонов: при гипертиреозе – повышение, при гипотиреозе – снижение концентрации этого микроэлемента в крови [8]. Однако до настоящего времени остается открытым вопрос о возможной роли нарушения насыщения организма медью в формировании ДТЗ, в развитии и прогрессировании ССО тиреотоксикоза. Решению этих вопросов посвящено настоящее исследование.
Цель исследования: оценить вклад обеспеченности организма медью в прогрессировании тяжести тиреотоксикоза и развитии ССО у больных ДТЗ.
Методы
Проведено контролируемое рандомизированное одномоментное исследование. На протяжении 2 лет в исследование были включены 113 женщин с диагнозом ДТЗ, поступивших на оперативное лечение в отделение эндокринной хирургии ГАУЗ «Кемеровская областная больница им. С.В. Беляева», Кемерово. Диагноз ДТЗ установлен и подтвержден в соответствии с клиническими рекомендациями РАЭ (Российская ассоциация эндокринологов) от 2014 г. [9]. Все пациентки до начала процедур исследования подписали форму информированного согласия, одобренную Локальным этическим комитетом. В группу сравнения были включены женщины в возрасте 25–60 лет (n=37), не имевшие патологии щитовидной железы (ЩЖ) и ССС.
Обследованные были в возрасте 25–60 лет, 55 из них молодого возраста (25–44 года), 58 – среднего (45–60 лет) (классификация ВОЗ, 2012) [10].
С учетом тяжести тиреотоксикоза выделено 2 группы: 1-я группа – со средней степенью тяжести (n=61), 2-я – с тяжелым течением тиреотоксикоза (n=52). Оценены жалобы, анамнестические, физикальные данные всех обследованных; концентрации тиреотропного гормона (ТТГ), свободного тироксина (св.Т4), антител к рецептору ТТГ (АТ к рТТГ) в сыворотке крови методом иммуноферментного анализа. Концентрацию меди определяли в волосах, срезанных в 2–3 участках затылочной области на 3–5 см выше корней волос, длина среза не менее 3 см. Определение проведено методом атомно-абсорбционной спектрофотометрии на спектрофотометре В-1100 с диапазоном 315–1050 нм. За референсные значения принимали 11–17 мкг/г.
Проведено ультразвуковое исследование (УЗИ) ЩЖ на аппарате Mindray DC-3. Записана электрокардиограмма (ЭКГ) в покое в 12 отведениях на аппарате Sciller Cardiovit AT-1, а также суточное мониторирование ЭКГ на аппарате Micrivit MT-101/200 (SCHILLER) с оценкой ишемических изменений и работоспособности при проведении лестничной пробы. Исследование эхокардиографических показателей сердца выполнено на приборе Vivid 7,0 demention. Морфометрические показатели сердца и функцию левого желудочка оценили в положении больного на левом боку. Из левого парастернального и верхушечного доступов оценивали стандартную четырех- и двухкамерную позиции сердца путем сканирования в двухмерном режиме. Измеряли дилатацию отделов, соотношение размеров левых и правых отделов сердца, наличие и степень дискинезии зоны некроза и рубцовых изменений, а также наличие аневризмы, выпота в полость перикарда. Из левой парастернальной позиции оценивали размеры и величину объемов камер сердца. Рассчитывали значение фракции выброса левого желудочка в М-режиме.
Критерии включения в исследование: женский пол; возраст более 25, но менее 60 лет; наличие ДТЗ с тиреотоксикозом тяжелой и средней степени тяжести (согласно критериям РАЭ), концентрация св.Т4≤22,0 пмоль/л; уровень АТ к рТТГ>1,0 МЕ/л; объем ЩЖ по данным УЗИ≥18 см3; рецидивирующее течение тиреотоксикоза (2 и более рецидива на фоне стандартной тиреостатической терапии тиамазолом).
Критерии исключения: мужской пол, пожилой и старческий возраст (60 и более лет, согласно критериям ВОЗ), впервые выявленный ДТЗ; уровень св.Т4≥22,0 пмоль/л; уровень АТ к рТТГ≤1,0 МЕ/л; объем ЩЖ по данным УЗИ<18 см3, наличие узловых образований в щитовидной железе по данным УЗИ, наличие сердечно-сосудистой патологии до дебюта ДТЗ (ишемическая болезнь сердца, врожденные и приобретенные пороки сердца, нарушения ритма и проводимости, ХСН), а также проведение химической окраски волос за 2 месяца до исследования, курение в анамнезе.
Полученные данные были проанализированы с использованием программы Statistica SPSS. Количественные показатели представлены в виде медианы с интерквартильным размахом (25-й; 75-й процентили). Межгрупповые различия анализировали по количественным признакам с помощью U-критерия Манна–Уитни. Для оценки межгрупповых различий по качественным признакам применяли критерий Фишера. Корреляционный анализ показателей проведен с помощью метода ранговой корреляции Спирмена. Различия считали статистически значимыми при р<0,05.
Исследование одобрено этическим комитетом (протокол № 141/к, дата проведения заседания – 11.2014).
Результаты исследования
Все обследованные пациентки в момент поступления в клинику на оперативное лечение находились в состоянии субклинического тиреотоксикоза, достигнутого на фоне стандартной тиреостатической терапии тиамазолом (табл. 1).
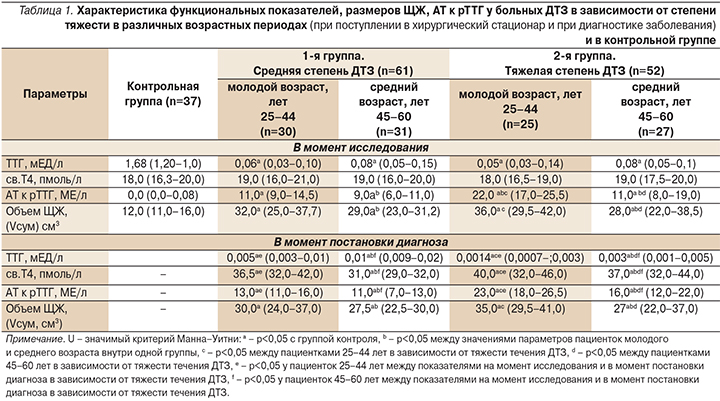
Различий в значениях ТТГ и св.Т4 у пациенток разного возраста и тяжести тиреотоксикоза не установлено. Тогда как в момент постановки диагноза ДТЗ у молодых пациенток обеих групп показатели ТТГ были ниже, а св.Т4 выше, чем у пациенток среднего возраста. Уровень АТ к рТТГ у всех пациенток на протяжении заболевания был повышенным, особенно у лиц молодого возраста, по-видимому из-за более высокой активности у них всех клеток, в т.ч. лимфоцитов [11]. Объем ЩЖ у лиц молодого возраста при разной тяжести ДТЗ был также выше, чем у лиц среднего возраста, вероятно из-за более высокого титра АТ к рТТГ. Корреляционный анализ подтвердил данное предположение. Так, отмечена связь между уровнем АТ к рТТГ и объемом ЩЖ у пациенток ДТЗ средней степени: молодого возраста – r=0,56 (р=0,01), у пациенток среднего возраста – r=0,74 (р=0,01). При тяжелой степени ДТЗ аналогичные показатели составили: r=0,78 (р=0,01), r=0,70 (p=0,01). В группе сравнения уровни ТТГ, св.Т4 соответствовали референсным значениям, титр АТ к рТТГ не повышен, объем ЩЖ не увеличен.
До момента постановки диагноза ДТЗ, согласно данным выкопировок сведений из амбулаторных карт, историй болезни, у пациенток отсутствовали данные о нарушении сократительной функции сердца и о нарушении ритма.
При декомпенсации тиреотоксикоза все пациентки с тяжелой степенью ДТЗ имели ХСН: I ФК (классификация NYHA, 1964) – у 9 (17,3%) обследованных, II ФК – у 39 (75,0%), III ФК – у 4 (7,7%) (χ2=5,09; р1–2=0,02), (χ2=1,9; р1–3=0,2), (χ2=14,16; р2–3=0,02) (табл. 2).
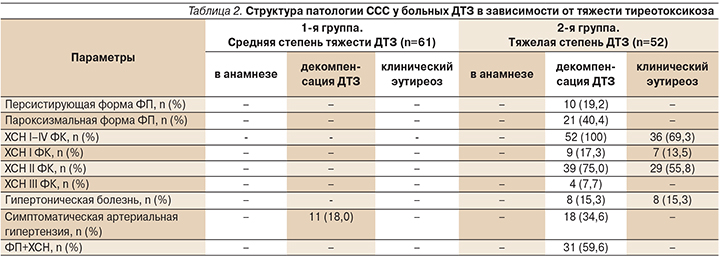
На фоне проводимой тиреостатической терапии произошло снижение степени тяжести ХСН: при ХСН I ФК – до 7 (13,5%), при ХСН II ФК – до 29 (55,8%) (χ2=26,5; р1-2=0,01), ХСН III и IV ФК выявлено не было.
Период декомпенсации ДТЗ осложнился фибрилляцией предсердий (ФП) у 31 (59,6%) с тяжелым тиреотоксикозом, из них 10 (19,2%) имели персистирующую форму, 21 (40,4%) – пароксизмальную (χ2=0,02; р=0,90). У остальных (21 [40,4%]) пациенток сохранялся синусовый ритм (см. табл. 2). На фоне лечения тиреостатиками персистирующая и пароксизмальная формы ФП были купированы, что указывает на тиреогенный характер ФП.
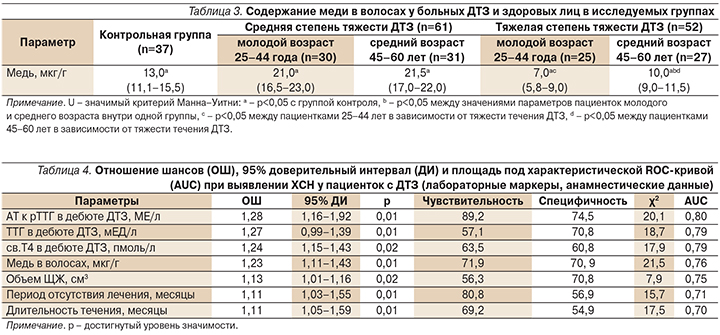
Результаты исследований продемонстрировали нарушение концентрации меди в волосах при ДТЗ. При этом обращает на себя внимание, что тиреотоксикоз средней тяжести у всех (61 [100,0%]) больных сопровождался повышением уровня меди до 21,0 (17,0–23,0) мкг/г с превышением показателей контрольной группы в 1,6 раза, тогда как у большинства (40 [76,9%]) больных тиреотоксикозом тяжелой степени концентрация меди в волосах составила 7,0 (5,5–8,0) мкг/г и была в 1,9 раза ниже, чем в контрольной группе, и 3 раза ниже, чем при средней тяжести тиреотоксикоза.
Лица молодого возраста имели более низкие значения показателя, чем лица среднего возраста, особенно при тяжелом тиреотоксикозе (р<0,05). В группе сравнения дефицит меди имели лишь 4 (10,8%) пациентки (р=0,01), уровень микроэлемента составил 13,0 (11,1–15,5) мкг/г (р=0,01) (табл. 3).
Согласно полученным данным, с обеспеченностью медью организма больных ДТЗ связан уровень АТ к рТТГ. При средней тяжести у лиц молодого возраста r=0,48 (р=0,01), среднего возраста – r=0,46 (р=0,01); при тяжелой степени ДТЗ у лиц молодого возраста r=-0,58 (р=0,01), среднего возраста – r=-0,59 (р=0,01).
С обеспеченностью медью также ассоциирован и объем ЩЖ: при средней степени тяжести ДТЗ у молодых r=0,48 (р=0,01), у лиц среднего возраста – r=0,45 (р=0,02). При тяжелой степени ДТЗ аналогичные показатели составили r=-0,67, (р=0,01), r=-0,50, (р=0,01).
Полученные данные показали, что недостаточная обеспеченность организма медью может быть одной из причин развития ССО при тяжелой степени ДТЗ. Так, дефицит меди выявлен у 21 (67,7%) больной ФП и у 40 (76,9%) пациенток с ХСН. При этом уровень меди в волосах составил: 9,0 (7,8–10,0) мкг/г при ФП; 7,0(5,5–8,0) мкг/г при ХСН. Результаты корреляционного анализа подтвердили наличие значимой отрицательной связи между уровнем меди и ФВ левого желудочка во всех возрастных группах при тяжелой степени тиреотоксикоза: (r=-0,51, р=0,01), (r=-0,51, р=0,01).
Для сравнительной оценки взаимной сопряженности показателей ХСН и гормонального профиля (ТТГ, св.Т4), уровня АТ к рТТГ, объема ЩЖ, установленных в момент постановки диагноза ДТЗ, а также уровня меди в волосах, длительности течения в месяцах и периода отсутствия лечения ДТЗ использован метод логистического регресса и ROC-анализа (табл. 4). Для однофакторного анализа были использованы перечисленные показатели. Результаты проведенного исследования показали, что среди изучаемых параметров наибольшей прогностической значимостью обладали АТ к рТТГ. Так, при значении АТ к рТТГ более 12,5 МЕ/л при постановке диагноза ДТЗ вероятность ХСН повышается в 1,28 раза, что отражает площадь под кривой AUC (Area UnderCurve) 0,80; р=0,01).
Далее было установлено, что вероятность ХСН повышается в 1,27 раза (AUC – 0,79; р=0,01) при уровне ТТГ<0,008 мЕд/л – в 1,24 (AUC – 0,79; р=0,01), при значениях св.Т4>32,0 пмоль/л – в 1,13 (AUC – 0,75; р=0,01), при объеме ЩЖ>более 29,5 см3 (в момент постановки диагноза ДТЗ) – в 1,11 (AUC – 0,70; р=0,02), при длительности течения тиреотоксикоза свыше 3 месяцев – в 1,11 раза (AUC – 0,71; р=0,02) в отсутствие лечения ДТЗ тиреостатиками более 3 месяцев. Также было выявлено, что при снижении уровня меди в волосах ниже 9,0 мкг/г вероятность развития ХСН увеличивалась в 1,23 раза (AUC – 0,76; р=0,01).
Каждый фактор был оценен с помощью множественного регрессионного анализа: метода логистического регресса с целью выявления признаков, позволяющих прогнозировать развитие ХСН у пациенток с ДТЗ. Вероятность возникновения ХСН при воздействии установленных независимых прогностических факторов определялась по формуле Р=1/1+е-y.
Зависимый признак Y=b0+b1X1+b2X2+b3X3+b4X4+5·X5+b6X6, где: b0, b1, b2, b3, b4, b5, b6 – коэффициенты регресса; X1, X2, X3, X4, X5, X6 – независимые признаки (факторы риска); е – математическая константа, приблизительно равная 2,72.
В статистической модели вероятности развития ХСН в качестве зависимого признака выбраны: 0 – нет ХСН, 1 – есть ХСН. Независимыми признаками, отобранными путем анализа ассоциаций каждого из них с зависимым признаком, стали показатели в момент постановки диагноза ДТЗ: ТТГ, св.Т4, АТ к рТТГ, объем ЩЖ, а также уровень меди в волосах, длительность течения ДТЗ и период отсутствия его лечения тиреостатиками.
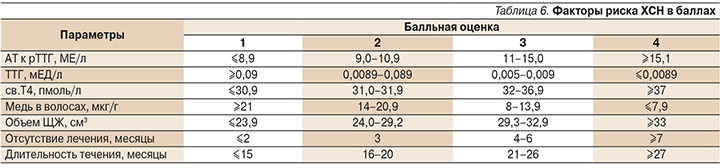
Вероятность осложнения ДТЗ ХСН по данной модели определяется по формулам: Р=1/1+е-y, Y=7,56+(-0,02×ТТГ)+0,18×св.Т4+0,10×АТ к рТТГ+(-0,94×медь в волосах) +0,45×объем ЩЖ+1,09×отсутствие лечения (месяцы)+1,01×длительность течения (месяцы). Подстановка значения Y в формулу Р=1/1+е-y определяла вероятность возникновения ХСН у пациентки с ДТЗ. Выраженность каждого фактора риска модели в баллах представлена в табл. 5, 6.

По уравнениям регресса минимальное число баллов (7) определяет наименьшую вероятность наличия ХСН (30,0%), максимальное число баллов (28) увеличивает риск до 99,0%. Проведена градация рисков на низкий, средний и высокий. Низкому риску соответствовали 7 баллов, среднему – 8–14, высокому – 15–28 баллов.
Пример расчета вероятности появления ХСН. Так, значение суммарной балльной нагрузки у пациентки с уровнем АТ к рТТГ – 35 МЕ/л (4 балла), ТТГ – 0,001 мЕД/л (4 балла), св.Т4 пмоль/л – 26 (1 балл), меди в волосах – 13 мкг/г (3 балла), объемом ЩЖ – 38 см3 (4 балла), отсутствием лечения – 7 месяцев (4 балла), длительностью течения ДТЗ – 13 месяцев (1 балл) составило 21 (балл), что соответствует высокому риску развития ХСН.
Обсуждение
В ходе настоящего исследования получены данные, свидетельствующие о высокой частоте осложнений со стороны ССС у пациенток с тяжелой степенью ДТЗ, а также о нарушении уровня меди в волосах при этом заболевании. В литературе также приводятся указания на отклонения концентрации меди от нормы у больных ДТЗ. Однако сведения неоднозначны: по одним данным, обеспеченность высокая [12], по другим – снижена [13].
Полученный у больных ДТЗ средней степени тяжести высокий уровень меди, возможно, связан с выходом этого микроэлемента из депо вследствие повышающейся активности медьсодержащих ферментов: супероксиддисмутазы, церулоплазмина, аминооксидаз, цитохром-с-оксидазы, лизилоксидазы и других ферментов [14]. Сниженный уровень меди у больных тиреотоксикозом тяжелой степени, по-видимому, связан с повышенным расходом микроэлемента на удовлетворение высоких метаболических потребностей и истощением запасов в условиях повышенного накопления продуктов ПОЛ [15]. Лица молодого возраста имели более низкие значения показателя, чем среднего возраста, особенно при тяжелом тиреотоксикозе, возможно из-за более интенсивного обмена веществ с более выраженным потреблением меди, чем у лиц среднего возраста.
Установлено, что у большинства больных ДТЗ, осложненном ФП и ХСН, снижено содержание меди в волосах. Другие авторы также указывают на дефицит меди у пациенток с нарушением ритма и ХСН, объясняя это снижением антиоксидантной защиты и усилением апоптоза кардиомиоцитов. Известно, что медь играет ключевую роль в антиоксидантной защите клеток: является кофактором активного центра фермента супероксиддисмутазы, входит в состав церулоплазмина. Медь необходима для синтеза АТФ: входит в состав фермента цитохромоксидазы. Медьзависимый фермент – лизилоксидаза, участвует в образовании поперечных сшивок коллагеновых и эластических волокон [16].
При дефиците меди активируется ПОЛ с нарушением целостности кардиомиоцитов, эндотелиальных клеток [17]. Медь обладает выраженными противовоспалительными свойствами, смягчает проявление аутоиммунных заболеваний. Ряд авторов отмечают положительную динамику ХСН на фоне приема препаратов, содержащих микроэлементы, в т.ч. медь [18].
Таким образом, проведенные исследования показали, что большинство (40 [76,9%]) пациенток с ДТЗ тяжелой степени тяжести имеют пониженное содержание меди в волосах – 7,0 (5,5–8,0) мкг/г. При осложнении ДТЗ ХСН дефицит меди наблюдался у 40 (76,9%), а ФП – у 21 (67,7%) пациентки. Полученные данные позволяют считать дефицит меди одной из возможных причин неблагоприятного прогноза ДТЗ. Разработана модель важнейших прогностических факторов ХСН у пациенток с ДТЗ, рассчитаны в баллах факторы риска ХСН, которые позволяют прогнозировать степень риска ХСН при ДТЗ и дифференцированно подходить к ее профилактике.
Выводы
Полученные данные продемонстрировали, что ДТЗ сопровождается нарушением обеспеченности организма медью: при средней степени тяжести ДТЗ у всех больных содержание меди в волосах повышено – 21,0 (17,0–23,0) мкг/г. По мере прогрессирования ДТЗ обеспеченность организма медью снижается, что повышает вероятность развития ФП и ХСН. Так, содержание меди в волосах снижено до 7,0 (5,5;8,0) мкг/г у 40 (76,9%) больных ДТЗ тяжелой степени. При ФП недостаток меди в волосах зарегистрирован у 21 (67,7%), при ХСН – у 40 (76,9%) больных. В группе сравнения пониженное содержание меди имели лишь 4 (10,8%) обследованных (р=0,01), уровень микроэлемента составил 13,0 (11,1–15,5). Результаты исследования позволяют считать недостаточную обеспеченность медью организма одной из возможных причин формирования ССО при ДТЗ, рекомендовать определять уровень меди в волосах, оценивать степень риска развития ХСН с помощью разработанной модели важнейших прогностических факторов ХСН и дифференцированно подходить к ее профилактике. При низком риске рекомендовать продукты с повышенным содержанием меди (говяжья печень, печень трески, какао-порошок, фундук, креветки, кальмары, горох и др.), при среднем и высоком рисках назначать препараты с повышенным содержанием меди в виде меди сульфата пентагидрата (2,0 мг).
Ограничение исследования: не было.


