Введение
Полинейропатия – самое частое осложнение сахарного диабета (СД) [1–3]. При диабетической полинейропатии (ДПН) поражаются сенсорные, моторные, автономные волокна периферических нервов. Выделяют множество видов ДПН, наиболее распространенным из которых считается дистальная симметричная полинейропатия [2–6]. В основе патогенеза ДПН лежит поражение аксонов периферических нервов, соответственно, наиболее частым патогенетическим вариантом ДПН является аксональная полинейропатия [2, 3, 7]. Тем не менее на электронейромиографии (ЭНМГ) в некоторых случаях ДПН могут выявляться признаки поражения миелина (снижение скорости распространения возбуждения [СРВ] по периферическим нервам, увеличение латентностей, деформация М-ответов) – проявления вторичной демиелинизации. В ряде случаев демиелинизирующие изменения на ЭНМГ настолько выражены, что возникает необходимость в дифференцировании ДПН с хронической демиелинизирующей воспалительной полинейропатией (ХВДП), которая также нередко встречается при СД [8]. Ранее мы уже описывали клинические особенности ДПН с демиелинизацией по ЭНМГ – бо'льшая выраженность болевого синдрома, наличие парезов, признаки декомпенсации диабета [9, 10].
Целью настоящей работы стало сравнение клинических особенностей аксональной и аксонально-демиелинизирующей дистальной симметричной ДПН.
Методы
Дизайн исследования
В обсервационное когортное сравнительное исследование включены пациенты с ДПН, амбулаторно обратившиеся в НИИ цереброваскулярной патологии и инсульта для производства ЭНМГ. Всего в исследование были включены 52 пациента, разделенных на 2 равные (по 26 человек в каждой) группы.
Регистрируемые показатели
Особенности клинической картины, тяжесть и патогенетический вариант ДПН оценивались на основании неврологического осмотра и ЭНМГ. Диагноз сенсорной или сенсомоторной дистальной симметричной ДПН устанавливался при наличии у пациента соответствующей клиники, изменений на ЭНМГ (прежде всего по сенсорным волокнам икроножных нервов), при наличии СД и исключении других причин полинейропатии. Тяжесть ДПН оценивалась на основании Шкалы неврологических симптомов (Neurological Symptoms Score, NSS) для субъективной симптоматики и Шкалы нейропатического дисфункционального счета (Neuropathy Disability Score, NDS) для объективных симптомов. Методом стимуляционной ЭНМГ исследовались икроножные нервы с двух сторон (n. suralis dext., n. suralis sin.) для подтверждения диагноза полинейропатии (снижение амплитуды сенсорного ответа нерва <6 мкВ хотя бы по одному нерву) и задние большеберцовые нервы с двух сторон (n. tibialis dext., n. tibialis sin.) для дифференцирования патогенетического варианта полинейропатии.
Критерии соответствия
Таким образом, критерием включения в исследование было наличие у пациента дистальной симметричной сенсорной или сенсомоторной ДПН, подтвержденное электромиографически (снижение амплитуды сенсорного ответа хотя бы одного n. suralis <6 мкВ). Из исследования исключались больные ДПН других типов (например, диабетической амиотрофией) и полинейропатиями недиабетического генеза (например, аутоиммунными, токсическими, наследственными).
Анализ в подгруппах
Включенные в исследование пациенты были разделены на 2 группы: группа I (n=26) с аксонально-демиелинизирующей ДПН и группа II (n=26) с аксональной ДПН. Разделение на подгруппы произведено на основании данных ЭНМГ – при снижении СРВ хотя бы по одному из n. tibialis <40 м/с устанавливался аксонально-демиелинизирующий вариант ДПН. Все сравнения клинических показателей проведены между указанными подгруппами.
Статистический анализ полученных данных проведен с помощью программ Microsoft Excel и Biostat. Использованы непараметрические критерии: Манна–Уитни – для сравнения количественных параметров между группами, хи-квадрат – для межгрупповых сравнений качественных параметров. Различия считались статистически значимыми при p<0,05.
Результаты
Участники исследования
На основании данных ЭНМГ все включенные в исследование пациенты были разделены на две группы. При наличии снижения СРВ <40 м/с хотя бы по одному из обследованных нервов устанавливался патогенетический вариант аксонально-демиелинизирующей ДПН, на основании чего была выделена группа I, включившая 26 больных: 20 мужчин и 6 женщин, средний возраст – 61,3±14,8 года, 22 пациента с СД 2 типа, 4 пациента с СД 1 типа. При СРВ >40 м/с по обоим обследованным нервам установлен патогенетический вариант аксональной ДПН, на основании чего была выделена группа II, также включившая 26 пациентов: 8 мужчин и 18 женщин, средний возраст – 61,5±15,8 года, 22 пациента с СД 2 типа, 4 пациента с СД 1 типа. Помимо гендерного состава (преобладание мужчин в I группе и женщин – во II; p<0,05) группы достоверно не различались (p>0,05).
Основные результаты исследования
Значения основных ЭНМГ-параметров в обеих группах представлены в табл. 1. Видно, что статистически значимые межгрупповые различия выявлены по всем исследуемым параметрам. Признаки поражения миелина периферических нервов – снижение СРВ (максимально до 24 м/с), увеличение дистальных латентностей М-ответов – были значительно выражены в I группе (p<0,001 для обоих параметров). Также в группе I выявлено статистически значимое понижение амплитуд М-ответов по сравнению со II группой (p<0,007), что говорит о большей тяжести полинейропатии в этой группе, в т.ч. и аксонопатии.
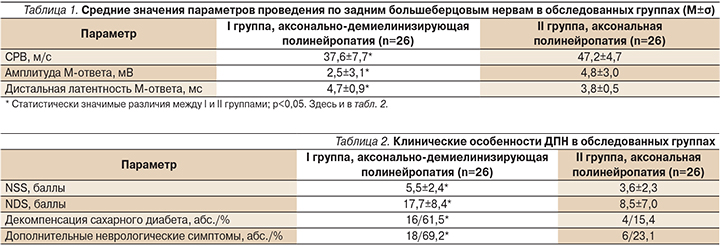
В табл. 2 представлены результаты сравнения клинических параметров между группами. Можно видеть, что статистически значимые межгрупповые различия установлены по всем исследуемым параметрам. В группе I выявлена большая тяжесть субъективной (по NSS, p<0,04) и особенно объективной (по NDS, p<0,005) симптоматики. Также в группе I отмечена более высокая частота декомпенсации СД (глюкоза крови >8 ммоль/л на момент обследования, ацетон и кетоновые тела в моче; p<0,04). Также в группе I обнаружена большая частота выявления «дополнительных» симптомов полинейропатии (из не входящих в шкалу NDS, включающую только чувствительные нарушения и снижение сухожильных рефлексов) – сенситивной атаксии (6 пациентов), гипотрофий мышц стоп и голеней (8 пациентов), трофических нарушений и признаков диабетической стопы (6 пациентов), парез стоп (2 пациента), полинейропатия верхних конечностей (2 пациента) (p<0,04).
Обсуждение
Известно, что при ДПН преимущественно и первично поражаются аксоны периферических нервов – полинейропатия носит характер аксональной. Первыми страдают тонкие немиелинизированные волокна автономной нервной системы и сенсорные, обеспечивающие болевую и температурную чувствительность [2, 3]. Позднее поражаются толстые миелинизированные нервные волокна, развивается вторичная демиелинизация [7]. При этом у пациентов с СД при ЭНМГ достаточно часто выявляется картина аксонально-демиелинизирующей полинейропатии. Проведенное нами исследование продемонстрировало, что наличие вторичной демиелинизации при ДПН (аксонально-демиелинизирующий вариант) ассоциировано с декомпенсацией СД и более тяжелой клинической картиной в плане как субъективных, так и объективных симптомов полинейропатии.
Также известно, что при СД более часто развивается ХВДП. Это аутоиммунное заболевание с первичным и преимущественным поражением миелина – полинейропатия носит характер демиелинизирующей. Несмотря на наличие разнородных данных о частоте ХВДП при СД, многие исследователи указывают на бо'льшую частоту встречаемости СД у пациентов с этой патологией [8]. Причина этого, а также механизмы развития ХВДП при СД неясны.
Существуют диагностические отличия между ХВДП и аксонально-демиелинизирующим вариантом ДПН. Это прежде всего значительное снижение СРВ при ХВДП (более 10% от нормы), наличие выраженных парезов и частое отсутствие признаков декомпенсации СД у пациентов с ХВДП [8]. Однако основное отличие кроется в разных подходах к лечению ХВДП и аксонально-демиелинизирующей ДПН. При ХВДП эффективна иммуносупрессивная терапия, особенно глюкокортикоиды, – наличие у пациента четкого эффекта от их применения подтверждает диагноз ХВДП. При ДПН наибольшую эффективность продемонстрировали препараты альфа-липоевой кислоты.
Они воздействуют на метаболизм глюкозы, способствуя компенсации СД, и улучшают функцию нерва [11–14]. Ранее проведенные исследования показали нарастание СРВ по периферическим нервам на фоне применения препаратов альфа-липоевой кислоты, т.е. воздействие последних на компонент вторичной демиелинизации [15]. С учетом вышесказанного пациентам с аксонально-демиелинизирующими полинейропатиями диабетического генеза следует прежде всего рекомендовать препараты альфа-липоевой кислоты [9, 10].
Заключение
Таким образом, в проведенном исследовании уточнены клинические особенности аксонально-демиелинизирующего варианта ДПН. Выявлено, что при развитии у пациентов с ДПН вторичной демиелинизации пораженных аксонов чаще встречается декомпенсация СД и полинейропатия протекает тяжелее по субъективным и объективным симптомам.
Большая представленность у больных аксонально-демиелинизирующим вариантом ДПН «дополнительных» симптомов полинейропатии (парезов, сенситивной атаксии) делает актуальной дифференциальную диагностику с ХВДП, особенно с учетом наличия снижения СРВ по данным электромиографии. Необходимы дальнейшие исследования с бо'льшим числом участников и более длительным наблюдением для уточнения частоты встречаемости аксонально-демиелинизирующего варианта ДПН, динамики его развития и течения, терапевтических подходов к коррекции этого состояния.


