Введение
Клинические проявления некоторых опухолей могут скрываться за неспецифическими симптомами, которые ошибочно принимаются врачами за признаки эндокринологических, гастроэнтерологических, кардиологических или других заболеваний. Пациент может длительное время, иногда годы, наблюдаться у разных специалистов, прежде чем будет верифицирован истинный диагноз, что существенно снижает прогноз и качество жизни больного. К таким опухолям относятся нейроэндокринные опухоли (НЭО), которые представляют собой гетерогенную группу новообразований, происходящих из нейроэндокринных клеток эмбриональной кишки. Функционирующие НЭО, секретирующие биологически активные пептиды, могут сопровождаться развитием комплекса патогномоничных симптомов, т.н. карциноидного синдрома (КС), который с высокой долей вероятности позволяет заподозрить у пациента серьезный диагноз. Больные КС жалуются на тахикардию, внезапные эпизоды покраснения лица и верхней части туловища, потливость, снижение массы тела, нарушения углеводного обмена. Пациенты с такими симптомами могут направляться к эндокринологу для исключения заболеваний щитовидной железы, сахарного диабета, патологии надпочечников или врачам других специальностей. Наличие настороженности в отношении НЭО, осведомленность о клинической картине этих опухолей, внимательное отношение к симптомам и анамнезу больного служат ключевым условием своевременного установления этого непростого редкого диагноза и поддержания качества жизни пациента.
Эпидемиология НЭО и КС
Встречаемость НЭО достигает 6,98 нового случая на 100 тыс. населения в год [1]. Однако, поскольку для большинства НЭО характерны относительно медленный рост и высокая 5-летняя выживаемость, истинная заболеваемость значительно выше и достигает 20 случаев на 100 тыс. человек [2]. В связи с разнообразием возникающих симптомов болезнь может длительно маскироваться под видом других заболеваний, что очень затрудняет постановку правильного диагноза. Заболеваемость НЭО прогрессивно растет и за последние 40 лет увеличилась в 6,4 раза. Высокий темп роста заболеваемости НЭО опережает заболеваемость другими злокачественными новообразованиями, что несомненно отражает активное изучение данной проблемы в последние годы, более широкое информирование врачей различных специальностей (рис. 1) [1]. Интересно, что, по данным регистра пациентов с НЭО в России, встречаемость НЭО в РФ существенно ниже мировой статистики и составляет всего 0,11 на 100 тыс. населения [3], что связано с недостаточным уровнем осведомленности врачей о данной патологии, отсутствием т.н. НЭО-настороженности и с недостаточно высоким уровнем диагностики.

НЭО могут возникать в любых органах и тканях, но наиболее часто локализуются в желудочно-кишечном тракте (ЖКТ; 62% случаев), легких (22% случаев), реже – в тимусе, молочной железе, почках, гипофизе, предстательной железе, коже, щитовидной железе, надпочечниках, яичниках и др. [5].
КС в среднем регистрируется у каждого третьего больного НЭО ЖКТ. Он служит проявлением т.н. классических карциноидов, чаще всего возникает при опухолевом поражении тонкого кишечника, реже у больных НЭО легкого и других локализаций и при метастатическом поражении печени [3]. По статистике, новые случаи клинически явного КС регистрируют с частотой примерно 2 случая на 100 тыс. населения в год [4].
Патофизиология и клиническая картина КС
КС обусловлен выделением опухолью специфических гормонов в кровоток. Впервые КС был описан в 1954 г. Торсоном и соавт. у пациента с НЭО тонкого кишечника с метастазами в печень и включал периферические вазомоторные симптомы, бронхиальную обструкцию, необычный цианоз, поражение правых отделов сердца (стеноз легочных клапанов, недостаточность трикуспидального клапана) [6].
Патофизиология КС и патогенез заболевания в значительной степени связаны с поступлением в кровь гормонально активных веществ: серотонина, брадикинина, гистамина, дофамина и др.
Главная роль в развитии основных симптомов КС принадлежит серотонину и активности 5-гидрокситриптофандекарбоксилазы, катализирующей образование серотонина из триптофана. После высвобождения серотонин быстро инактивируется печеночной моноаминоксидазой до 5-оксииндолальдегида, превращающегося в 5-оксииндолуксусную кислоту. В ткани опухоли и метастазов определяется повышенное содержание серотонина. Нарушение метаболизма триптофана приводит к значительному увеличению доли триптофана, который метаболизируется по пути образования гидроксииндола. В норме в серотонин превращается только 1% триптофана, у больных карциноидом – 60%.
Некоторые карциноидные опухоли, пока не дают метастазов в печень, могут протекать бессимптомно, поскольку их продукты быстро разрушаются моноаминоксидазой печени в портальном круге. При наличии же печеночных метастазов секреция серотонина в кровь резко усиливается, оказывая системное действие [3].
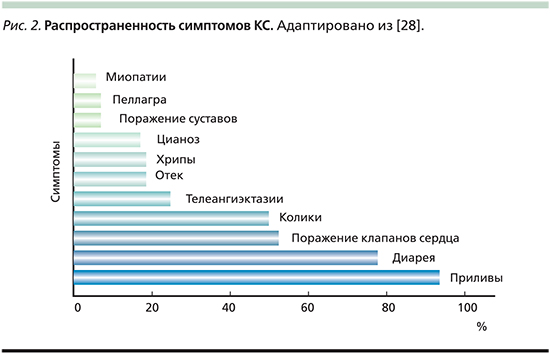
Клинические проявления КС многообразны (рис. 2). Гиперемия кожи лица – самый частый симптом заболевания. Классический КС проявляется приливами (в 90% случаев), диареей (70%), болью в животе (40%), поражением сердечных клапанов (40–45%). Реже возникают телеангиэктазии (25%), одышка (15%) и пеллагра (5%), бронхоспазм, фиброзирование и стеноз брыжеечных сосудов, спаечный процесс в брюшной полости с формированием кишечной непроходимости, фиброзирующий стеноз уретры [7].
Приливы
Типичный прилив при классическом КС начинается внезапно и представляет собой розовое или красное окрашивание кожи лица и верхней части туловища, длящееся несколько минут. Приступ может возникать несколько раз в день, сопровождаться слезотечением и провоцируется приемом алкоголя или пищи, содержащей тирамин (шоколад, орехи, бананы). В отличие от менопаузальных приливов приступы при КС «сухи» и не сопровождаются потоотделением [3].
Поскольку приливы встречаются не только в рамках КС, важно проводить дифференциальную диагностику с другими состояниями, сопровождающимися приливами, такими как медуллярный рак щитовидной железы, феохромоцитома, сахарный диабет, менопауза, эпилепсия, панические атаки, мастоцитоз, полицитемия, кардиологические причины, прием некоторых лекарственных средств (ниацин, ингибиторы фосфодиэстеразы 5-го типа) [ 8].
Известно несколько типов приливов. Первый – эритематозный, обычно ограничен лицом и шеей, длится 1–2 минуты. Второй тип приливов более продолжительный, при этом на лице больного сохраняется постоянный ценотический оттенок, и во время приступа нос становится пурпурно-красным. Прилив третьего типа длится часами и днями, может сопровождаться образованием глубоких морщин на лбу, остающихся и после прекращения приступа, сосуды конъюнктивы постоянно расширены, больные жалуются на слезотечение, возможна гипотония и диарея. Приливы четвертого типа отличаются образованием ярко-красных пятен неправильной формы, часто расположенных вокруг основания шеи и на руках [3].
Выделение разных типов приливов имеет определенное клиническое значение. Приливы первого и второго типов обычно ассоциированы с НЭО средней кишки, реже встречаются при НЭО бронхов и поджелудочной железы (ПЖ) [3].
Атипичный синдром встречается в 5% случаев, характеризуется багровым окрашиванием кожи, длящимся несколько часов, после которого остаются теленагиоэктазии и гипертрофия кожи лица и верхней части шеи, возможен акроцианоз верхних конечностей. Иногда возможны головная боль, слезотечение, гипотензия, отек кожи и бронхоспазм. Обычно такие симптомы наблюдаются при карциноидах передней кишки; считается, что они обусловлены воздействием серотонина, гистамина и других биогенных аминов [3].
Диарея
Диарея при КС первоначально имеет периодический характер, связанный с нарушением секреции и моторики ЖКТ. Впоследствии из-за лимфоангиоэктазии кишечника и избыточного роста бактерий она может стать постоянной. Отличительной особенностью секреторной диареи является то, что она не уменьшается при голодании. Диарея часто сопровождается схваткообразными болями в животе, причиной которых может быть воздействие различных гуморальных факторов, в т.ч. серотонина, тахикининов, гистамина, калликреина и простагландинов, стимулирующих перистальтику и секрецию кишечника [3].
Поражение сердца при НЭО
Карциноидная болезнь сердца (КБС) с преимущественным поражением клапанного аппарата правых отделов сердца выявляется примерно у 60% пациентов с КС и имеют признаки сердечной недостаточности в результате поражения эндокарда и клапанов сердца [9]. При КБС формируется хроническое легочное сердце. Декомпенсация сердечной недостаточности при КБС служит главной причиной заболеваемости и смерти пациентов с КС [10]. Обычно КБС развивается через 1,5 года после установления диагноза НЭО [11]. При наличии метастазов в печени секретируемые опухолью пептиды и вазоактивные вещества попадают в нижнюю полую вену и далее в правые отделы сердца, которые поражаются в первую очередь. Характерны повреждение трехстворчатого и легочного клапанов (стеноз или недостаточность), фиброз и утолщение эндокарда, расширение правых отделов сердца, формирование легочной гипертензии [12] Экспериментально показано, что серотонин стимулирует синтез коллагена интерстициальными клетками клапанов, что приводит к их утолщению и формированию фиброэластоза эндокарда [9]. Уровень сывороточного серотонина напрямую коррелирует с тяжестью КБС [12].
Важно подчеркнуть, что всем пациентам с НЭО, сопровождающимися КС, показано выполнение эхокардиографии. А единственное эффективное лечение при КБС (не включая этиологическое) – хирургическое [9]. Таким образом, крайне важно помнить о поражении сердца при НЭО с целью не только заподозрить НЭО, но и улучшить прогноз больных.
Диагностика КС и НЭО
Из всех биохимических маркеров хромогранин А обладает наилучшим сочетанием диагностической чувствительности и специфичности, что делает его основным маркером НЭО любой локализации [13]. Хромогранин А используется в целях диагностики, мониторинга и прогноза НЭО [14]. Основными лабораторными диагностическими маркерами КС помимо хромогранина А служат уровень серотонина в плазме крови и уровень 5-гидроксииндолуксусной кислоты (5-ГИУК) в суточной моче [15].
5-ГИУК – это концевой продукт метаболизма серотонина, который выводится с мочой. Суточная секреция 5-ГИУК – более стабильный и менее подверженный вариабельности показатель, чем концентрация серотонина в периферической крови, поскольку на него в меньшей степени влияют индивидуальные особенности больных, их психоэмоциональное состояние в момент взятия крови, суточные биоритмы.
Помимо специфичных маркеров НЭО и КС в диагностике используется определение других гормонов. При этом каждый вид НЭО имеет уникальный набор биохимических признаков, определяющий их функциональные особенности и различия клинического течения даже в рамках одной группы эмбриологического происхождения. Клинические проявления болезни ассоциированы прежде всего с соответствующими эндокринными гиперфункциональными синдромами в зависимости от локализации функционирующей опухоли (см. таблицу).
При назначении исследований маркеров НЭО необходимо учитывать, что на результаты их определения могут оказывать влияние различные эндогенные и экзогенные факторы. Так, существенное влияние на показатели хромогранина А может оказать прием омепразола, что нередко для пациентов с НЭО.
На показатели 5-ГИУК и серотонина может оказывать влияние употребления в пищу богатых триптофаном продуктов (бананы, авокадо, сливы, ананасы, баклажаны, помидоры, грецкие орехи, шоколад, кофе), в связи с чем пациентам следует воздерживаться от употребления этих продуктов в течение 3 суток до начала сбора мочи или взятия крови на серотонин. На уровень 5-ГИУК в суточной моче влияют также некоторые лекарственные препараты, которые могут вызывать как повышение его концентрации (парацетамол, кофеин, ацетанилид, фенацетин, резерпин, цисплатин, фторурацил, мелфалан), так и снижение (аспирин, леводопа, метилдопа, ингибиторы моноаминоксидазы, фенотиазины, трициклические антидепрессанты, кортикотропин, хлорпромазин, гепарин, имипрамид, октреотид) [17].
Общие подходы к лечению КС и НЭО. Роль аналогов соматостатина
Основным подходом к лечению больных эндокринными опухолями является удаление первичного очага. Возможные варианты оперативного лечения определяются характером возникновения, размерами и локализацией опухоли, ее функциональным статусом, наличием метастазов и осложнений опухолевого процесса.
Вторичной целью служит обязательная коррекция избыточной секреции гормонов и их эффектов. В настоящее время симптоматическое терапевтическое лечение включает биологическую терапию с использованием аналогов соматостатина, применение таргетной терапии и химиотерапевтического лечения. Также по показаниям применяется терапия, направленная на коррекцию гормонального дефицита [18, 19].
Карциноидные опухоли имеют на поверхности клеток рецепторы, обладающие высоким сродством к гормону соматостатину; выделено пять подтипов соматостатиновых рецепторов – sst2, sst5, sst1, sst3, sst4 (в порядке убывания по частоте встречаемости). Помимо соматостатиновых описаны и другие рецепторы: холецистокининовые, секретиновые, ВИП-рецепторы, бомбезиновые, СRF-рецепторы 1-го и 2-го типов при глюкогономах, инсу-линомах и др. В 87% случаев они присутствуют и в метастазах, если встречаются в первичной опухоли [20].
Аналоги соматостатина вызывают уменьшение или полное исчезновение клинических проявлений КС приблизительно у 70% больных НЭО. Впервые они стали использоваться для лечения КС начиная с 1990-х гг. [3]. Эндогенный соматостатин, который секретируется в гипоталамусе и органах ЖКТ, обладает эндокринными и паракринными эффектами, опосредованными специфическими рецепторами соматостатина. Фактически соматостатин является мощным ингибитором практически всех вазоактивных эндо- и экзокринных секретов. Связываясь со своими рецепторами, соматостатин вызывает снижение секреции соматотропного гормона в гипофизе, ингибирует секрецию тиреотропного гормона, серотонина и пептидов, продуцируемых нейроэндокринными клетками ЖКТ (глюкагона, инсулина, гастрина, ВИП, и др.), снижает активность моторики ЖКТ, ингибирует секрецию и всасывание кишечной жидкости, увеличивает время пассажа пищи по ЖКТ [3].
Для терапевтических целей синтезированы структурные аналоги соматостатина. Используемые синтетические аналоги соматостатина октреотид и ланреотид преимущественно связывают рецепторы второго и пятого подтипов – sst2 и sst5, обладают сходными с эндогенным соматостатином фармакологическими характеристиками, но отличаются бόльшей продолжительностью действия (несколько часов для аналогов по сравнению с несколькими минутами для нативного соматостатина), что позволяет их использовать в лечебных целях [3]. Короткодействующий аналог соматостатина требует введения подкожно до 3 раз в день. В связи с этим фармакологически оправданной была необходимость создания депо-форм препарата для обеспечения адекватного терапевтического эффекта. В настоящий момент в арсенале врачей есть препараты пролонгированной формы октреотида для внутримышечных инъекций. При этом перед инъекцией препарат необходимо смешать с растворителем – специальным полимерным матриксом. Препарат вводится внутримышечно 1 раз в 28 дней в дозе 30–40 мг. Отдельно стоит отметить большую важность соблюдения правильной техники внутримышечной инъекции при введении октреотида. Несмотря на кажущуюся простоту процедуры, частота нарушений техники инъекции может достигать 48% и приводит к подкожному введению препарата вместо внутримышечного [22]. Неправильная техника инъекции ведет к значительному ухудшению контроля над симптомами заболевания и усугублению течения КС [22].
Пролонгированный ланреотид представлен уникальной лекарственной формой – гелем Соматулин Аутожель. Препарат вводится глубоко подкожно 1 раз в 28 дней в дозе 120 мг. Уникальная лекарственная форма обеспечивает постепенное высвобождение препарата в кровоток в течение длительного времени. Ланреотид Аутожель выпускается в виде предварительно заполненного шприца, готового для инъекции.
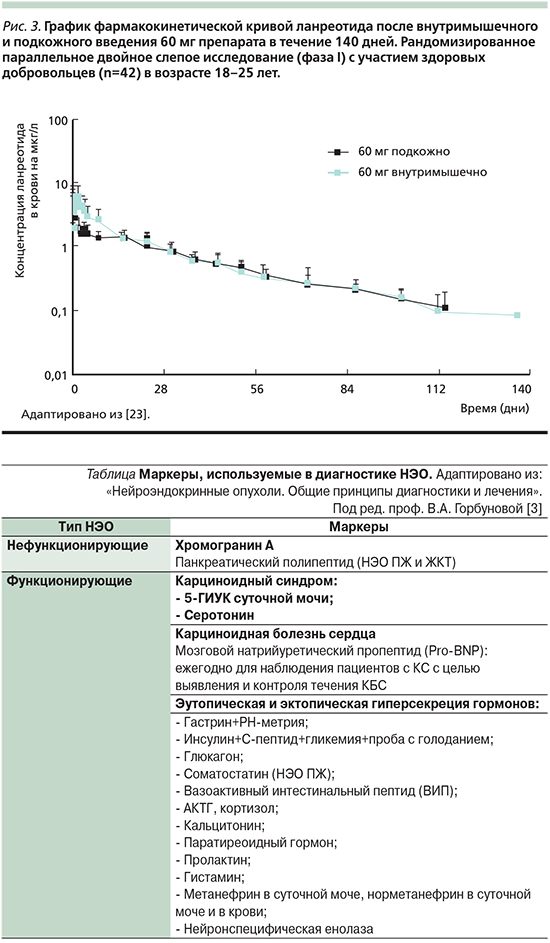
Одним из важных преимуществ ланреотида является возможность самостоятельного проведения инъекции либо самим пациентом, либо его близкими в домашних условиях [21]. В отличие от октреотида нарушение техники инъекции ланреотида не влияет на фармакокинетику препарата. Было показано, что профиль фармакокинетической кривой ланреотида практически идентичен как при внутримышечном, так и при подкожном введении (рис. 3) [23].
В результате терапии аналогами соматостатина происходит полное исчезновение приливов у 60% больных с одновременным уменьшением их частоты и тяжести в 2 раза более чем в 85% случаев, что приводит к значительному улучшению качества жизни. Исчезновение диареи пациенты отмечают более чем в 30% случаев, а более чем у 75% больных наблюдается улучшение общего состояния. Более чем у половины пациентов отмечено снижение выделения с мочой продукта распада серотонина – 5 ГИУК. Кроме того, аналоги соматостатина обладают антипролиферативным действием, в т.ч. при нефункционирующих НЭО, происходящих из ЖКТ и ПЖ. Противоопухолевый эффект аналогов соматостатина доказан в ходе рандомизированных контролируемых клинических исследований [24, 25].
Заключение
На сегодняшний день произошел колоссальный прогресс в изучении НЭО. Разработаны клинические рекомендации по диагностике и лечению НЭО [26], ежегодно проходят крупные конференции [27], активно изучаются более точные методы топической диагностики и доступное эффективное медикаментозное таргетное лечение. Активное расширение применения радиоизотопных методов исследования, топической диагностики позволяет персонифицировать подходы к лечению пациентов, индивидуализировать протокол терапии. К результатам проводимой работы относится уменьшение за последние 10 лет риска смерти пациентов с НЭО на 21,3%, а их общая выживаемость стала достигать десятка лет [1].
Поскольку симптомы НЭО и КС многолики, пациенты с ранними признаками НЭО приходят на прием к врачам различных специальностей. Чтобы суметь заподозрить за привычными симптомами более сложный диагноз, врачи всех специальностей должны быть хорошо осведомлены о симптоматике, особенностях течения и диагностики НЭО для установления истинного диагноз в кратчайшие сроки.
Ведение пациентов с НЭО, как ни одной другой патологии, требует мультидисциплинарной команды специалистов, в состав которой обязательно должны входить терапевты, эндокринологи, гастроэнтерологи, хирурги, онкологи и патоморфологи. Необходимо тесное взаимодействие специалистов с целью постановки точного диагноза, принятия консенсусного решения по лечению и разработке индивидуального плана терапии.


