Актуальность
Рак легкого – одна из наиболее распространенных локализаций онкологического процесса, характеризующаяся скрытым течением и ранним появлением метастазов. В 2012 г. в мире было зарегистрировано около 1,8 млн новых случаев рака легкого, что составило 12,9% новых случаев опухолевых заболеваний; рак легкого является причиной онкологической смертности в 19,4% случаев [1, 2]. В развитых странах заболеваемость раком легкого составляет 18,6 и 11,1 на 100 тыс. у мужчин и женщин соответственно, в развивающихся странах – 47,4 и 27,8 на 100 тыс. у мужчин и женщин соответственно [3].
В Российской Федерации (РФ) заболеваемость раком легкого является одной из самых высоких в мире. В 2016 г. диагноз «злокачественное новообразование» трахеи, бронхов, легкого был поставлен в 60 467 случаях, показатель заболеваемости составил 23,77 на 100 тыс. человек [4], 48,88 – у мужчин, 7,72 – у женщин. В структуре онкологической заболеваемости злокачественным новообразованием (ЗНО) рак трахеи, бронхов, легкого занимает третье место (10,1%), первое место у мужчин (17,6%), десятое – у женщин (3,8%) [4]. Всего на учете с данным диагнозом в 2017 г. состоял 137 381 человек, показатель распространенности заболевания составил 96,2 на 100 тыс. [5].
Рак легкого считается наиболее распространенной причиной смерти среди онкологических заболеваний в РФ: в структуре смертности от ЗНО наибольший удельный вес составляют опухоли трахеи, бронхов, легкого (17,4%), мужчины – 26,5% (первое место), женщины – 6,8% (четвертое место) [4]. ЗНО рак трахеи, бронхов, легкого относятся к заболеваниям с крайне неблагоприятным прогнозом. Так, летальность в течение года с момента установления диагноза в РФ в 2017 г. достигала 49,6% [5].
ЗНО рак трахеи, бронхов, легкого является патологией с высоким показателем несвоевременной диагностики (запущенности). Согласно данным за 2017 г., удельный вес лиц с запущенным опухолевым процессом (IY стадия) от числа больных с впервые в жизни установленным диагнозом ЗНО составил 40,8% случаев при среднем показателе запущенности в РФ – 20,5% [5]. На I–II стадиях рак легкого диагностируется в 29,4% случаев, на III стадии – в 27,9% [5].
Рак легкого составляет порядка 92% в структуре ЗНО органов дыхания (ЗНО трахеи, бронхов, легкого) [6]. Доля немелкоклеточного рака легкого (НМРЛ) в морфологической структуре рака легкого составляет примерно 85% [1, 7].
В большинстве случаев диагноз «рак легкого» ставится на стадии распространенного или метастатического заболевания, при которых прогноз становится неблагоприятным. Комбинированная химиотерапия (ХТ) на основе препаратов платины долгое время была основным методом лечения распространенного НМРЛ, улучшая контроль симптомов, качество жизни и выживаемость по сравнению с поддерживающей терапией [8]. Частота объективного ответа на терапию препаратами платины редко превышает 30%, а 1-летняя выживаемость находится в диапазоне от 30 до 45% [8].
Рак легкого представляет собой серьезную социально-экономическую проблему. Анализ социально-экономического бремени рака легкого в РФ показал, что около 20% всей популяции составляют пациенты трудоспособного возраста. Доля занятых в экономике среди впервые выявленных пациентов составляет 42,4%, или около 22 тыс. человек. Доля больных, впервые признанных инвалидами, составляет 44%. Общая величина экономического бремени в 2015 г. составила 15,37 млрд руб. (0,02% валового внутреннего продукта РФ в 2015 г.): при расчете непрямых затрат методом фрикционных затрат и 117,15 млрд руб. (0,15% валового внутреннего продукта РФ в 2015 г.) при расчете методом человеческого капитала. При этом показано, что наибольшие затраты приходятся на пациентов с распространенной и метастатической стадиями заболевания [9, 10]. Таким образом, особенно важны разработка и включение в арсенал врачей эффективных препаратов для лечения поздних стадий НМРЛ.
Прорыв в терапии распространенного НМРЛ произошел в течение последних 10 лет и связан с достижениями в области молекулярной биологии, позволившими разработать препараты направленного действия для лечения подгрупп пациентов с определенными мутациями, а также с разработкой иммуноонкологических препаратов, направленных на преодоление толерантности иммунной системы к опухоли [11, 12]. Следует отметить, что разработка иммуноонкологических препаратов особенно важна для пациентов с отсутствием активирующих мутаций, т.к. для таких пациентов это единственная, кроме ХТ, возможность эффективной терапии.
Пембролизумаб – моноклональное антитело, селективно блокирующее взаимодействие между рецептором иммунной контрольной точки PD1 и его лигандами PDL1 и PDL2. В 2018 г. пембролизумаб был зарегистрирован в РФ в качестве 1-й линии терапии в комбинации с ХТ (препараты платины и пеметрексед) для пациентов с распространенным неплоскоклеточным НМРЛ. Ранее в 2017 г. пембролизумаб был зарегистрирован в РФ в качестве 1-й линии терапии для пациентов с распространенным НМРЛ с экспрессией PDL1≥50% в отсутствие мутаций в генах EGFR или ALK, а в 2016 г. в качестве терапии 2-й линии пациентов с распространенным НМРЛ с экспрессией PDL1≥1%. При этом пациенты с мутациями в генах эпидермального фактора роста (EGFR) или киназы анапластической лимфомы (ALK) должны получать специфическую терапию, прежде чем им будет назначено лечение пембролизумабом [13].
В апреле 2018 г. были опубликованы результаты рандомизированного клинического исследования III фазы KEYNOTE-189, согласно которым комбинация пембролизумаба с препаратами платины и пеметрекседомом значительно улучшает показатель общей выживаемости (ОВ) пациентов, ранее не получавших противоопухолевую терапию, вдвое снижая риск смерти по сравнению с ХТ (отношение рисков [ОР]=0,49, 95% доверительный интервал [ДИ] – 0,38–0,64; p<0,00001). В общей группе улучшение показателя ОВ наблюдалось независимо от уровня экспрессии PDL1 – у пациентов с отсутствием PDL1 экспрессии (ОР=0,59, 95% ДИ 0,38–0,92), с экспрессией PDL1 – 1–49% (ОР=0, 95% ДИ – 0,34–0,90) и пациентов с экспрессией PDL1≥50% (ОР=0,42, 95% ДИ – 0,26–0,6). Применение комбинации пембролизумаба с ХТ также значительно улучшает показатель выживаемости без прогрессирования (ВБП), снижая риск прогрессирования или смерти в два раза по сравнению с ХТ (ОР=0,52, 95% ДИ – 0,43–0,64; p<0,00001) [14].
Результаты исследования KEYNOTE-021 cohort G [25] послужили основанием для регистрации показания (в России с августа 2018 г.) в лечении НМРЛ комбинации пембролизумаба с препаратами платины и пеметрекседом в качестве 1-й линии терапии пациентов с распространенным неплоскоклеточным раком легкого [13], а также включением данного режима терапии в ведущие международные рекомендации [15]. Пембролизумаб – первый из иммуноонкологических препаратов, который в комбинации с ХТ продемонстрировал эффективность для пациентов с неплоскоклеточным НМРЛ в отсутствие мутаций в генах EGFR или ALK вне зависимости от экспрессии PDL1. Следует отметить, что двукратное снижение риска смерти, полученное при использовании комбинации пембролизумаба и ХТ, является беспрецедентным терапевтическим эффектом 1-й линии лечения НМРЛ, что позволило в короткие сроки включить данный режим в международные и российские стандарты лечения первой линии неплоскоклеточного НМРЛ [15, 21].
Учитывая клиническую эффективность пембролизумаба в лечении НМРЛ, высокую распространенность и значительное социально-экономическое бремя данного заболевания, прежде всего для пациентов на поздних стадиях болезни, возникает необходимость провести анализ экономической целесообразности закупки пембролизумаба для лечения распространенного неплоскоклеточного НМРЛ в отсутствие мутаций в генах EGFR или ALK за счет бюджетных средств.
Целью данного исследования стала оценка эффективности затрат применения препарата пембролизумаб в комбинации с ХТ по сравнению с ХТ в 1-й линии терапии распространенного неплоскоклеточного НМРЛ в отсутствие мутаций в генах EGFR или ALK в условиях российского здравоохранения.
Гипотеза настоящего исследования состоит в том, что добавление пембролизумаба к ХТ в 1-й линии терапии распространенного неплоскоклеточного НМРЛ является затратноэффективным (не приводит к увеличению показателей «затраты/эффективность» и «затраты/полезность»).
Методы
Оценка затратной эффективности использования пембролизумаба в комбинации с препаратами платины и пеметрекседом в 1-й линии терапии распространенного неплоскоклеточного НМРЛ проводилась с использованием методов клинико-экономического анализа «затраты/эффективность» и «затраты/полезность».
Клинико-экономический анализ был проведен, согласно отраслевому стандарту «Клинико-экономические исследования» [16] и методическим рекомендациям Центра экспертизы и контроля качества медицинской помощи Министерства здравоохранения РФ [17].
Фармакоэкономическая модель
Анализ затратной эффективности применения пембролизумаба в комбинации с препаратами платины и пеметрекседом проводился на основании результатов исследования KEYNOTE-189 [14]. Для проведения анализа была разработана марковская модель динамики распространенного неплоскоклеточного НМРЛ.
В модели оценивалась вероятность эффективной терапии 1-й линии распространенного неплоскоклеточного НМРЛ (средняя длительность ВБП), вероятность прогрессирования, ОВ, частота развития осложнений, качество жизни пациентов, а также стоимость терапии основного заболевания и экономическая эффективность применения пембролизумаба в комбинации с ХТ в 1-й линии терапии:
- пембролизумаб 200 мг каждые 3 недели (до 24 месяцев) плюс ХТ (карбоплатин AUC 5 или цисплатин 75 мг/м2) каждые 3 недели, 4 цикла, плюс пеметрексед 500 мг/м2 каждые 3 недели по сравнению с ХТ препаратами платины и пеметрекседом;
- ХТ (карбоплатин AUC 5 или цисплатин 75 мг/м2) каждые 3 недели, 4 цикла плюс пеметрексед 500 мг/м2 каждые 3 недели.
Модель предусматривает переход пациентов между тремя состояниями: 1) «без прогрессирования»; 2) «прогрессирование»; 3) «смерть» (см. рисунок). В течение каждого цикла пациент, находящийся в одном из первых двух состояний, может остаться в исходном состоянии либо перейти в следующее, либо умереть. Временной горизонт моделирования составил 5 лет.
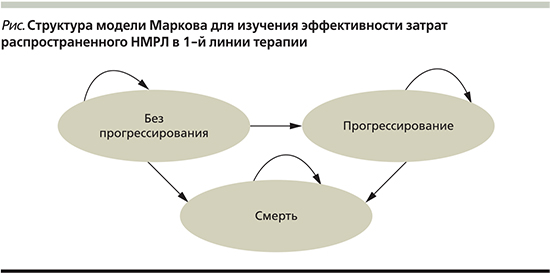
Длительность цикла в модели была принята равной 1 неделе.
Для моделирования исходными были данные о влиянии применяемых схем терапии на средние длительности ВБП и ОВ, полученные в исследовании KEYNOTE-189 [14]. Вероятности переходов между состояниями в модели в момент времени t при использовании терапии i определялись на основании данных об ОВ (OSi, t) и ВБП (PFSi, t) и рассчитывались по формулам:

где Pdeaf i, t – вероятность перехода в состояние «смерть», Pprg i, t – вероятность перехода в состояние «прогрессирование».
Моделирование кривых ВБП и ОВ для ХТ и пембролизумаба в комбинации с ХТ проводилось на основании соответствующих кривых Каплана–Майера, приведенных в исследовании KEYNOTE-189 [14]. Аппроксимация кривых выживаемости была проведена путем построения параметрических моделей выживаемости с использованием экспоненциального, логлогистического, логнормального распределения, а также распределений Вейбулла (Weibull) и Гомпертца (Gompertz). Параметры распределения, наиболее корректно описывающие исходные кривые ВБП и ОВ, согласно критериям AIC (Akaike Information Criterion) и BIC (Bayesian information criterion), а также визуальному контролю, были получены с использованием распределения Вейбула.
Критериями клинической эффективности служили число сохраненных лет жизни с поправкой на качество жизни (QALY – quality-adjusted life year), число сохраненных лет жизни (LY – life years) и средняя длительность ВБП сравниваемых схем терапии. Число сохраненных лет жизни рассчитывалось как среднее значение длительности ОВ в сравниваемых схемах терапии.
Длительность ОВ рассчитывалась как сумма вероятностей нахождения в состоянии «без прогрессирования» и «прогрессирование» в каждом цикле модели, умноженная на число циклов.
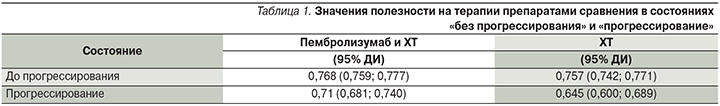
Число сохраненных лет жизни с поправкой на качество (QALY) в модели для изучаемой популяции пациентов НМРЛ рассчитывалось как сумма числа лет жизни, проведенных в состоянии «без прогрессирования» и «прогрессирование», умноженных на соответствующие коэффициенты полезности для этих состояний. Значения полезности на терапии препаратами сравнения в состояниях «без прогрессирования» и «прогрессирование» рассчитывались на основе сведений о продолжительности и качестве жизни больных, полученных в исследовании KEYNOTE-189 [14, 23, 24]. Полезность в состоянии «без прогрессирования» определялась с учетом возникающих на фоне лечения побочных эффектов. Данные о значениях полезности представлены в табл. 1.
Целевой популяцией в анализе являлись российские пациенты старше 18 лет с диагнозом «распространенный неплоскоклеточный НМРЛ» в отсутствие мутаций в генах EGFR или ALK, которым ранее не назначалась противоопухолевая терапия. В модели использовались половозрастные данные российских пациентов с диагнозом ЗНО рак трахеи, бронхи, легкого. Так, по данным за 2016 г., средний возраст больных с впервые в жизни установленным диагнозом ЗНО рак трахеи, бронхи, легкого в РФ составляет 65,6 года [4], что определило средний возраст пациентов, входящих в модель. Доля мужчин в моделируемой популяции составила 79,5% и рассчитывалась как доля пациентов с впервые в жизни установленным диагнозом ЗНО рак трахеи, бронхи, легкого в РФ за 2016 г. [4].
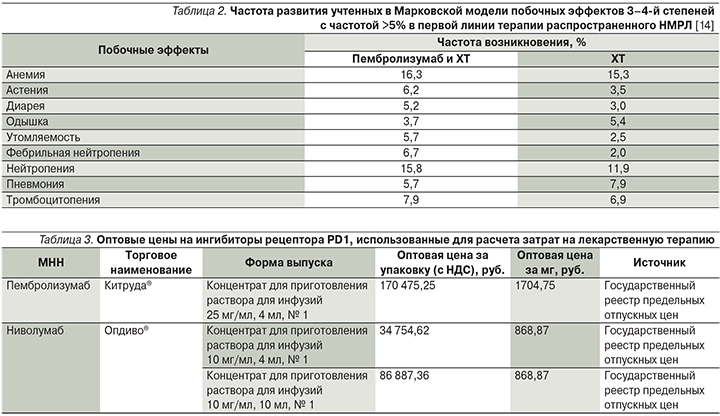
Для целей настоящего исследования при оценке безопасности применения исследуемых препаратов использовались данные по частоте выявления побочных эффектов 3–4-й степеней тяжести в 1-й линии терапии из исследования KEYNOTE-189 [14], встречающихся при использовании сравниваемых схем терапии с частотой более 5%. Вероятности побочных эффектов, учетные в Марковской модели, представлены в табл. 2.
Расчет учтенных затрат
Исследование проводилось с точки зрения системы здравоохранения РФ. Учитывались следующие прямые медицинские затраты, осуществленные в рамках программы государственных гарантий бесплатного оказания медицинской помощи [18]:
- расходы на лекарственную терапию 1-й линии (с использованием пембролизумаба, карбоплатина, цисплатина и пеметрекседа);
- затраты на терапию побочных эффектов 3-й и 4-й степеней, возникающих на фоне терапии 1-й линии;
- расходы на лекарственную терапию 2-й линии (с использованием пембролизумаба, ниволумаба, доцетаксела);
- затраты на амбулаторно-поликлинические введения лекарственных препаратов и услуги наблюдения.
Все расчеты выполнялись в рублевых ценах 2018 г. Результаты выражены в показателях прямых затрат и затратной эффективности (CER – cost-effectiveness ratio, CUR – cost-utility ratio). Дисконтирование затрат производилось по ставке 5% в год.
Для расчета затрат на лекарственную терапию в 1-й и 2-й линиях использовались оптовые цены на препараты, рассчитанные путем прибавления к наименьшим зарегистрированным предельным отпускным ценам производителя [19] (на момент 15.08.2018) с учетом 10% НДС. Оптовые цены на ингибиторы рецептора PD1, использованные для расчетов приведены в табл. 3.
Цены на препараты для ХТ приведены в табл. 4. В случае различной стоимости за 1 мг действующего вещества для разных форм выпуска для расчетов использовалась наименьшая стоимость за 1 мг с учетом подходящей дозировки. Таким образом, стоимость цисплатина, использованная в работе, составила 7,34 руб. за 1 мг вещества, карбоплатина – 5,29 руб. за 1 мг вещества.
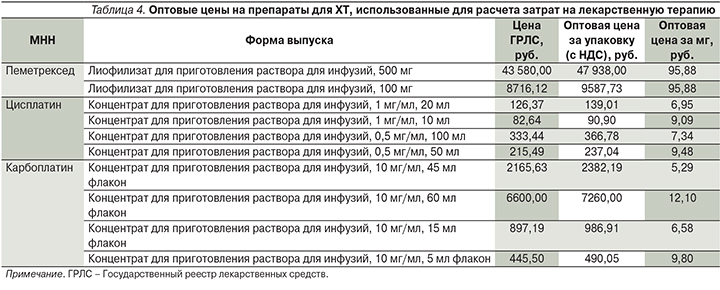
Схема приема препаратов сравнения в 1-й линии описана выше, она соответствовала таковой в оригинальных рандомизированных клинических исследованиях [14] и международных рекомендациях [15]. Затраты на один цикл введения и год терапии препаратами сравнения приведены в табл. 5.
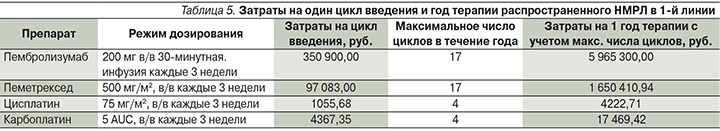
Затраты на лекарственную терапию и затраты на купирование побочных эффектов в модели в 1-й линии терапии рассчитывались как сумма соответствующих затрат на каждый цикл нахождения пациента в модели в состоянии «без прогрессирования».
Затраты на коррекцию побочных эффектов 3–4-й степеней оценивались, исходя из необходимости оказания пациентам в таком состоянии помощи в условиях стационара.
В соответствии с этим расчет затрат производился по законченному случаю лечения на основе клинико-статистических групп (КСГ) [20]. Расчет затрат на коррекцию побочных эффектов проводился для клинически значимых побочных эффектов 3–4-й степеней тяжести с частотой встречаемости ≥5%. Стоимость одного случая коррекции побочного эффекта с учетом КСГ приведена в табл. 6.
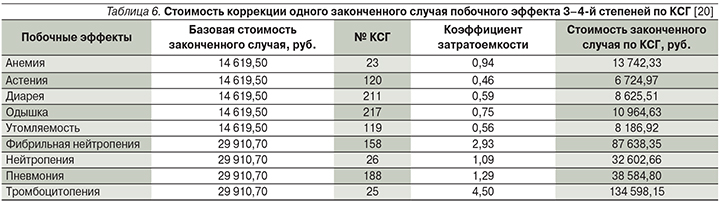
Вероятность назначения лекарственных препаратов во 2-й линии терапии оценивалась экспертным методом. На основании опроса специалистов было сделано предположение о том, что после прогрессирования на пеметрекседе с ХТ половина пациентов получат доцетаксел, в то время как второй половине пациентов, получавших пеметрексед с ХТ, будут назначены иммуноонкологические препараты ниволумаб и пембролизумаб в равных пропорциях. Следует отметить, что исследование KEYNOTE-189 [14] было перекрестным: иммуноонкологические препараты после прогрессирования на ХТ получали свыше 40% пациентов, что близко к результатам, полученным на основании экспертного опроса и легшим в основу настоящего исследования. Предполагалось, что после прогрессирования на пембролизумабе в комбинации с ХТ всем пациентам будет назначена ХТ доцетакселом.
Режимы назначения препаратов во 2-й линии терапии:
- доцетаксел: 75 мг/м2 в/в, 1 раз в 3 недели;
- пембролизумаб: 200 мг в/в, 1 раз в 3 недели;
- ниволумаб: 3 мг/кг в/в, 1 раз в 2 недели.
Длительность терапии ингибиторами рецептора PD1 после получения ХТ в 1-й линии определялась как среднее значение по данным KEYNOTE-189 и составила 185 дней, в то время как средняя длительность ХТ в группе пембролизумаба в комбинации с ХТ составила 72 дня [14, 23]. Затраты на лекарственную терапию во 2-й линии терапии рассчитывались как сумма затрат на каждый цикл нахождения пациента в модели в состоянии «прогрессирование» в соответствии с указанной выше длительностью применения препаратов.
Затраты на амбулаторно-поликлинические услуги в ходе лечения до начала прогрессирования во 2-й линии, учитывая инфузионный способ введения рассматриваемых препаратов, включали расходы на обращение по поводу заболевания при оказании медицинской помощи в амбулаторных условиях медицинскими организациями (их структурными подразделениями) за счет средств обязательного медицинского страхования (1267,70 руб. за одно обращение, согласно ПГГ на 2018 г. [18]). Частота процедуры соответствовала частоте применения препаратов (1 раз в 3 недели).
Контроль состояния пациента на протяжении всего периода анализа осуществлялся в условиях круглосуточного стационара с частотой 4 раза в год, согласно российским клиническим рекомендациям [21, 22], оплата соответствующих затрат производилась по законченному случаю лечения КСГ № 221 «госпитализация в диагностических целях с постановкой и подтверждением диагноза злокачественного новообразования», коэффициент затратоемкости (КЗ)=1 [20].
Считалось, что затраты на наблюдение за пациентом с распространенным НМРЛ после его прогрессирования на 2-й линии терапии включают расходы на ежемесячный прием врача-онколога для контроля состояния пациента (452,0 руб. за одно посещение специалиста, согласно ПГГ на 2018 г.) [18]). Затраты на ведение пациентов рассчитывались как сумма соответствующих затрат на каждый цикл нахождения пациента в модели.
Расчет показателей соотношения стоимости и эффективности
На основании результатов моделирования для каждой рассматриваемой схемы терапии были рассчитаны показатели «затраты/эффективность» (CER– cost-effectiveness ratio) и «затраты/полезность» (CUR – cost-utility ratio).
Показатель «затраты/эффективность» рассчитывался по формуле (1):
СЕR=DC/Ef→(1), где
СЕR – соотношение «затраты/эффективность», показывает затраты, приходящиеся на единицу эффективности;
DC – прямые затраты (общие затраты на одного больного);
Ef – эффективность применения препарата (число сохраненных лет жизни у одного больного).
Показатель «затраты/полезность» рассчитывался по формуле (2):
СUR=DC/Ut→(2), где
СUR – соотношение «затраты/полезность», показывает затраты, приходящиеся на единицу полезности (QALY);
DC – прямые затраты (общие затраты на одного больного);
Ut – полезность применения препарата (число сохраненных QALY у одного больного).
Соотношение «затраты/эффективность» представляет собой значение прямых медицинских затрат, необходимое для продления жизни пациента на один год. Соотношение «затраты/полезность» представляет собой значение прямых медицинских затрат, необходимое для получения 1 года дополнительной жизни с учетом качества.
Проведение анализа чувствительности результатов расчетов к колебаниям исходных параметров
Был выполнен детерминистский однофакторный анализ чувствительности полученных результатов к изменению основных исходных параметров модели – цен на препараты сравнения и клинической эффективности рассматриваемых схем терапии в пределах 10% (варьировалась стоимость или эффективность каждой схемы лекарственной терапии при фиксированной стоимости и эффективности схемы сравнения). Также был проведен анализ с учетом средневзвешенных цен аукционов для ингибиторов PD1. Выбор параметров для анализа чувствительности определялся типом анализа (затраты/эффективность), а также тем фактом, что затраты на лекарственную терапию в настоящем исследовании составили свыше 97% в структуре рассматриваемых прямых медицинских затрат.
Результаты и обсуждение
Результаты анализов «затраты/эффективность» и «затраты/полезность». Эффективность сравниваемых схем терапии распространенного НМРЛ в отсутствие мутаций в генах EGFR или ALK оценивали по разработанной модели Маркова (см. рисунок), опирающейся на данные исследования KEYNOTE-189 [14].
Средние значения расчетных параметров эффективности сравниваемых схем терапии (число сохраненных лет жизни и число сохраненных лет жизни с поправкой на качество), полученные при горизонте моделирования в 5 лет, представлены в табл. 7.

Результаты моделирования клинической эффективности 1-й линии терапии распространенного НМРЛ показали, что терапия пембролизумабом в комбинации с ХТ является существенно более эффективной по сравнению с ХТ: комбинированная терапия продемонстрировала значительное увеличение средней длительности ОВ, выраженной в числе сохраненных лет жизни (на 62%) и числе сохраненных лет жизни с поправкой на качество (на 76%) по сравнению с таковыми при использовании только ХТ.
Результаты моделирования общих прямых медицинских затрат на терапии препаратами сравнения в расчете на одного пациента с распространенным НМРЛ в промежутке в 5 лет приведены в табл. 8.
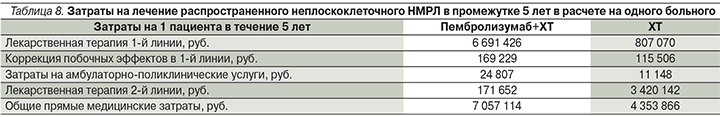
Общие прямые затраты при использовании пембролизумаба в комбинации с ХТ в 1-й линии терапии неплоскоклеточного НМРЛ оказались на 62,1% выше, чем затраты при применении только ХТ. Таким образом, моделирование показало более высокую эффективность пембролизумаба в комбинации ХТ по сравнению с применением только ХТ при больших общих прямых затратах, ассоциированных с использованием пембролизумаба в комбинации с ХТ. Существенно бóльшие прямые затраты при использовании комбинированной терапии объясняются более высокой стоимостью данной терапии, а также ее эффективностью в 1-й линии терапии, выраженной в большем значении ВБП для схемы, включающей пембролизумаб. Следует отметить, что затраты на амбулаторно-поликлинические услуги оказались выше при использовании схемы пембролизумаб в комбинации с ХТ, что также объясняется существенно большей длительностью ВБП для схемы, включающей пембролизумаб. Затраты на амбулаторно-поликлинические услуги на комбинированной терапии оказались в целом несущественными (<0,4% общих затрат). Следует отметить, что затраты на лекарственную терапию составили свыше 97% в структуре рассматриваемых прямых медицинских затрат, что является типичной долей затрат на современные лекарственные препараты для противоопухолевой терапии.
В случаях, когда более дорогая терапия является более эффективна для оценки целесообразности применения более затратной технологии, проводится анализ «затраты/эффективность» и (или) «затраты/полезность». Значения показателей «затраты/эффективность» (CER) по критерию сохраненные годы жизни (LY) сравниваемых схем терапии на промежутке в 5 лет приведены в табл. 9.
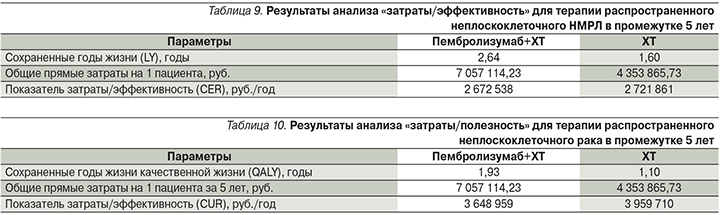
Значения показателей «затраты/полезность» (CUR) сравниваемых схем терапии на промежутке в 5 лет приведены в табл. 10.
Значения показателей «затраты/эффективность» и «затраты/полезность» при использовании комбинированной терапии оказались меньше, чем таковые при использовании только ХТ (на 1,8 и 7,9% соответственно). Данный факт говорит о том, что добавление пембролизумаба к ХТ в 1-й линии терапии пациентов с распространенным неплоскоклеточным НМРЛ, хотя и увеличивает общие затраты на терапию таких пациентов, приводит к тому, что «стоимость» добавленного года жизни и года качественной жизни оказывается меньше на терапии пембролизумабом в комбинации с ХТ по сравнению со стоимостью дополнительного года жизни на ХТ. Таким образом, добавление пембролизумаба в схемы 1-й линии терапии распространенного неплоскоклеточного НМРЛ целесообразно с клинико-экономической точки зрения.
Полученный результат объясняется существенно большей эффективностью комбинированной схемы терапии, а также тем, что большие затраты, связанные с применением пембролизумаба в сочетании с ХТ в 1-й линии терапии, компенсируются назначением дорогостоящих препаратов во 2-й линии терапии после прогрессирования на ХТ.
Анализ чувствительности показал, что полученные результаты в значительной степени зависят от распределения пациентов между различными вариантами терапии 2-й линии, а также длительности терапии ингибиторами рецептора PD1 в 1-й и 2-й линиях терапии, поскольку они вносят наибольший вклад в затратную компоненту анализа. Анализ чувствительности также продемонстрировал максимальную чувствительность модели к изменению цен на препараты сравнения и продемонстрировал устойчивость модели к колебанию основных параметров (цены на препараты сравнения, параметры клинической эффективности).
При анализе, проведенном с учетом средневзвешенных цен по данным аукционов на препараты пембролизумаб и ниволумаб (по состоянию на 17.08.2018), было отмечено, что цена на препарат пембролизумаб была значительно снижена в последних аукционах в различных регионах до уровня 166 158,00 руб. за упаковку концентрата для приготовления раствора для инфузий 25 мг/мл, 4 мл, № 1.
Результаты анализа затрат в случае анализа для минимальных цен аукционов на препараты ниволумаб и пембролизумаб показали следующее: разница в прямых медицинских затратах возросла до 60,6% (6923,7 тыс. руб. для схемы пембролизумаб в комбинации с пеметрекседом и ХТ и 4311,4 тыс. руб. для схемы пеметрексед и ХТ). Результаты анализа «затраты/эффективность» в этом случае все еще лучше для схемы пембролизумаб в комбинации с пеметрекседом и ХТ (2622,0 тыс. руб. для схемы пембролизумаб в комбинации с пеметрекседом и 2695,3 тыс. руб. для схемы пеметрексед и ХТ), так же как и результаты анализа «затраты/полезность» все еще лучше у схемы пебролизумаб в комбинации с пеметрекседом и ХТ (3580,0 тыс. руб. для схемы пембролизумаб в комбинации с пеметрекседом и 3921, 1 тыс. руб. для схемы пеметрексед и ХТ).
Для проведения альтернативного анализа чувствительности учитывали средневзвешенную цену на препараты ниволумаб и прембролизумаб за июль–август 2018 г., и она составила 188 448,20 руб. для упаковки пембролизумаба. Результаты анализа затрат показали наибольшую динамку – разница в прямых медицинских затратах возросла до 68% (7612,4 тыс. руб. для схемы пембролизумаб в комбинации с пеметрекседом и ХТ и 4530,7 тыс. руб. для схемы пеметрексед и ХТ). Результаты анализа «затраты/эффективность» в этом случае практически одинаковы для сравниваемых схем (2882,8 тыс. руб. для схемы пембролизумаб в комбинации с пеметрекседом и 2832,5 тыс. руб. для схемы пеметрексед и ХТ), в то время как результаты анализа «затраты/полезность» все еще лучше у схемы пебролизумаб в комбинации с пеметрекседом и ХТ (3936,1 тыс. руб. для схемы пембролизумаб в комбинации с пеметрекседом и 4120, 6 тыс. руб. для схемы пеметрексед и ХТ). Таким образом, можно заключить, что данная цена является погранично приемлемой для заключения о том, что данная схема предпочтительна для пациентов с распространенным неплоскоклеточным НМРЛ в качестве 1-й линии терапии.
Основные результаты анализа эффективности затрат применения препарата пембролизумаб в комбинации с ХТ по сравнению с ХТ в 1-й линии терапии распространенного неплоскоклеточного НМРЛ:
- Моделирование средних значений параметров клинической эффективности сравниваемых схем терапии подтвердило существенное преимущество комбинации пембролизумаба и ХТ по сравнению с ХТ: комбинированная терапия увеличила число сохраненных лет жизни на 65% (2,64 против 1,60 года) и число сохраненных лет жизни с поправкой на качество на 76% (1,93 против 1,1 QALY) по сравнению с таковыми при использовании ХТ на 5-летнем промежутке.
- Общие прямые медицинские затраты на одного пациента при терапии пембролизумабом и ХТ оказались на 62,1% выше, чем затраты на терапию ХТ и составили соответственно 7057,1 тыс. и 4353,9 тыс. руб. на 5-летнем промежутке моделирования.
- Комбинированная терапия пембролизумабом и ХТ характеризуется лучшим (меньшим) показателем «затраты/эффективность» по сравнению с терапией ХТ: в случае комбинированной терапии прямые медицинские расходы на 1 год дополнительной жизни составляют 2672,5 тыс., в случае ХТ – 2721,9 тыс. руб./год.
- Комбинированная терапия пембролизумабом и ХТ характеризуется лучшим (меньшим) показателем «затраты/полезность» по сравнению с терапией ХТ: в случае комбинированной терапии прямые медицинские расходы на 1 год дополнительной жизни с учетом качества составляют 3648,9 тыс., в случае ХТ – 3959,7 тыс. руб./год.
Выводы
Разработанная Марковская модель продемонстрировала клинико-экономические преимущества применения ингибитора рецептора PD1 пембролизумаба в комбинации с ХТ по сравнению с ХТ в 1-й линии терапии распространенного НМРЛ. Бóльшие затраты, ассоциированные с применением комбинированной терапии, компенсировались ее существенно более высокой клинической эффективностью, в результате комбинированная терапия пембролизумабом и ХТ обладает лучшими (меньшими) показателями «затраты/эффективность» и «затраты/полезность» по сравнению с ХТ. Данный вывод означает, что стоимость дополнительных лет жизни и лет качественной жизни, полученных вследствие применения комбинации пембролизумаба и ХТ, ниже, чем стоимость ХТ. Таким образом, добавление пембролизумаба к ХТ в 1-й линии терапии распространенного неплоскоклеточного НМРЛ целесообразно с клинико-экономической точки зрения.
Следовательно, препарат пембролизумаб может быть рекомендован для включения в стандарты медицинской помощи пациентам с неплоскоклеточным НМРЛ, перечень лекарственных препаратов для обеспечения отдельных категорий граждан, программы лекарственного обеспечения населения, региональные перечни лекарственных препаратов и формуляры.



