Проблема легочных кровотечений при раке легкого
Легочное кровотечение (ЛК) – одно из грозных осложнений рака легкого (РЛ). Больные нередко попадают в неспециализированные медицинские учреждения в ургентном порядке с распространенным опухолевым процессом. Эти обстоятельства во многом определяют прогноз заболевания и результаты лечения [1].
До сих пор нет четкой схемы последовательности действий при ЛК опухолевой природы, нет четкого определения продолжительности консервативной терапии и показаний к экстренным операциям. Как известно, экстренные вмешательства на высоте ЛК сопровождаются высокой частотой развития послеоперационных осложнений и высокой периоперационной летальностью. Поэтому существует необходимость внедрения малоинвазивных методик для остановки легочного кровотечения у тяжелого и малоперспективного контингента больных немелкоклеточного РЛ (НМРЛ), таких как эндоскопический и эндоваскулярный гемостаз [2]. Бронхоскопия и ангиография – основные методы топической диагностики ЛК, которые трансформируются в лечебные гемостатические процедуры при наличии показаний [3].
ЛК – достаточно редкая ургентная ситуация: 1–4% от общего количества кровотечений [2, 4]. У 7–10% больных РЛ ЛК в трахео-бронхиальное дерево является одним из первых проявлений заболевания [3, 5, 6]. По данным Д.М. Гиоргадзе (1989), кровохаркание как первое проявление опухолевого заболевания отмечено у каждого второго больного с воспалительными осложнениями РЛ, что способствовало более раннему выявлению заболевания и более ранней госпитализации больного в специализированный стационар [7]. Летальность при массивном ЛК обусловлена в основном не кровопотерей, а асфиксией [7, 8].
Источником ЛК чаще всего служат бронхиальные артерии (90–95%), при этом откашливаемая кровь алая и пенистая; выделение темной крови свидетельствует о кровотечении из ветвей легочной артерии [8–10]. Анемия развивается крайне редко [10]. По данным В.А. Шестовицкого (1997), увеличение кровотока в 10 раз и более на фоне гиперваскуляризации опухоли способствует развитию ЛК больших объемов из бронхиальных артериол [10]. Реже ЛК развивается при нарушении целостности ветвей легочной артерии в случае ее аррозии на фоне гнойного или/и опухолевого процесса, разрыва аневризмы в случае длительно существующих полостей распада различного генеза с массивным кровотечением, нередко молниеносного характера [10].
В основе лечебной тактики при ЛК лежит дифференциация кровохарканья и ЛК, которые отличаются в основном количественно [11]. Кровохарканье – это наличие крови в виде прожилок или сгустков в отдельных плевках мокроты в относительно небольшом количестве, которые чаще всего выделяются при кашле [3]. Под ЛК понимают выделение большого количества крови в просвет бронхов [10]. Как известно, кровохарканье во многих случаях предшествует массивному ЛК.
Жидкую или смешанную с мокротой кровь больные, как правило, откашливают. Часть крови из дыхательных путей они аспирируют или заглатывают. Кровь откашливается в большом количестве как одномоментно, так и с перерывами. Поэтому количественная оценка кровопотери при ЛК всегда приблизительна [4, 8].
В отечественной и зарубежной литературе представлено множество классификаций ЛК, которые учитывают их интенсивность, объем и реакцию организма на кровопотерю, принимая во внимание опасность развития асфиксии [3, 10, 12, 13]. Е.Г. Григорьев (2014) считает, что в основе классификации ЛК должен быть объективный показатель, определяющий прогноз: объем кровопотери за единицу времени [3, 13]. По мнению И.В. Васильева и соавт (2015), наибольшее практическое значение имеет классификация Е.Г. Григорьева (1990), основанная на определении скорости и объема кровопотери: I (А – 50 мл/сут, Б – 50–200 мл/сут, В – 200-500 мл/сут); II (А – 30–200 мл/ч, B – 200–500 мл/ч); III (А – 100 мл одномоментно, В – более 100 мл и/или обструкция трахео-бронхиального дерева, асфиксия) [9].
Некоторые авторы интенсивность ЛК оценивают в зависимости от объема и темпа кровопотери по В.И. Стручкову (1987): 1-я степень отражает объем кровопотери за сутки от 50 до 200 мл; 2-я – до 500 мл кровопотери за час; 3-я степень – более 500 мл в течение одного эпизода [4, 12]; 2-ю и 3-ю степени ЛК авторы относят к массивным. В.А. Шестовицкий (1997) описывает массивное кровотечение как кровопотерю 400 мл и более в сутки или кровопотерю 100 мл и более в течение часа [10].
Примесь любого количества крови в отделяемой мокроте служит показанием к госпитализации [9]. В случаях развития ЛК любой этиологии первоочередной задачей является профилактика асфиксии и остановка кровотечения [9, 14].
Кровохарканье не требует специального лечения и прекращается при проведении медикаментозной терапии (έ-аминокапроновая кислота, этамзилат, викасол). Но оно может и усилиться, несмотря на проводимое лечение [3, 4, 10, 11]. К дополнительным консервативным методам гемостаза относят управляемую артериальную гипотензию, эффективную при кровотечениях из сосудов большого круга кровообращения – из бронхиальных артерий. По мнению М.И. Перельмана (2006), снижение систолического артериального давления до 85–90 мм рт.ст. создает благоприятные условия для тромбоза и остановки кровотечения [8]. При кровотечениях из легочной артерии давление в ней снижают внутривенным введением эуфиллина (5–10 мл 2,4%-ного раствора разводят в 10–20 мл 40%-ного раствора глюкозы и внутривенно вводят в течение 4–6 минут) [9]. Кровохарканье может продолжаться от нескольких часов до нескольких дней. Даже незначительное кровохарканье опасно, т.к. в любой момент может перейти в угрожающее жизни ЛК, требуещее неотложных мероприятий [10].
Профузное ЛК объемом более 500 мл представляет большую опасность для жизни больного и может быстро привести к смерти в результате асфиксии, аспирационной пневмонии, легочно-сердечной недостаточности [2–4, 8, 10, 11]. Эффективно проведенная консервативная гемостатическая терапия в качестве предоперационной подготовки существенно снижает риск развития гемоаспирационной пневмонии [9, 15]. Аспирация даже небольших объемов крови приводит к формированию обтурационных ателектазов с развитием пневмонии и дыхательной недостаточности [4, 16]. Массивное ЛК требует неотложной терапии в ОРИТ под контролем показателей газообмена и кровообращения. Если откашливание крови не эффективно и сохраняется угроза асфиксии, проводят интубацию с аспирацией крови через интубационную трубку и экстренную бронхоскопию с попыткой провести гемостаз окклюзией бронха поролоновой губкой или баллонным катетером Фогарти, лазерной фотокоагуляцией [10].
Летальность при ЛК достигает 50–80%, при этом, по данным И.В. Васильева и соавт. (2015.), 75% больных умирают в течение первого часа [3, 5, 6, 9]. Летальность от степени ЛК и исходного соматического статуса пациента [9, 17].
Некоторые авторы рекомендуют избегать хирургического вмешательства в течение первых 48 часов от начала ЛК. При появлении острой дыхательной недостаточности вследствие обструкции дыхательных путей кровью на первом этапе показано выполнение экстренной бронхоскопии с целью санации бронхиального дерева и обеспечения адекватной вентиляции легких, определения источника кровотечения и выполнения гемостаза различными методами (коагуляция, окклюзия) [9, 10, 18, 19]. Современные возможности хирургической, эндоскопической (бронхоблокация, коагуляция, окклюзия), интервенционно-рентгенологической (эмболизация бронхиальных артерий – ЭБА, окклюзия межреберных и сегментарных артерий) техники предоставляют широкие диагностические и лечебные возможности в лечении опухолевого ЛК [5, 6, 20].
Оптимальной схемой при ЛК является этапное лечение, направленное на временное достижение гемостаза с целью создания условий для выполнения радикальных вмешательств в срочном и плановом порядке [8, 20–22]. Консервативная терапия в сочетании с эндоскопическими или эндоваскулярными вмешательствами позволяет добиваться временного гемостаза, стабилизируя ситуацию, верифицировать диагноз, определять распространенность и прогноз заболевания, определять показания к хирургическому вмешательству при наличии резектабельной опухоли [9, 23]. По мнению Я.Н. Шойхет и соавт. (2014), у большинства больных кровохарканье указывает на выраженную распространенность первичного процесса с перспективой выбора в пользу паллиативной остановки ЛК [24]. В онкологической практике ЛК указывает прежде всего на наличие центрального РЛ, не характеризуя распространенность опухолевого процесса. Но, по данным М.И. Давыдова и Б.Е. Полоцкого (1994), кровотечение при РЛ с распадом периферической локализации встречается в 16,8% случаев; в случаях центральной локализации – в 27,9% [1].
По мнению Е.С. Казанцевой и соавт. (2017), наиболее радикальным методом остановки кровотечения в трахео-бронхиальное дерево при РЛ считается операция. Но, по данным тех же авторов, только 15–30% больных операбельны на момент развития ЛК. При этом большая группа пациентов (70–85%) с неоперабельным РЛ подвергаются паллиативным или симптоматическим срочным и экстренным вмешательствам только с целью остановки ЛК из опухоли [5]. Е.С. Казанцевой и соавт. (2017) первый опыт применения методик паллиативного лечения пациентов с ЛК показал удовлетворительные результаты [5].
На сегодняшний день спектр эндоваскулярных вмешательств включает ЭБА, окклюзию межреберных артерий и сегментарных ветвей нижнедолевой легочной артерии. По данным Ш.Н. Даниелян и соавт. (2017), непосредственная эффективность ЭБА отмечена в 97% наблюдений [6]. Авторы считают, что при нетравматическом ЛК, источником которого, как правило, являются бронхиальные артерии, ЭБА – современный высокотехнологичный способ остановки кровотечений с доказанной эффективностью вмешательства и «золотой» стандарт лечения [6, 20]. По данным И.В. Васильева и соавт. (2015), успешной остановки ЛК при ЭБА можно добиться в 77–100% случаев [9].
Если источник ЛК четко определен при рентгенографии и бронхоскопии, применение эндоскопических методов гемостаза не имеет преимуществ перед эндоваскулярным вмешательством [9, 25].
По мнению Ш.Н. Даниелян и соавт. (2017), хирургические вмешательства при нетравматическом ЛК выполнялись в 12,3% случаев после достижения эндоскопического и эндоваскулярного гемостаза. По мнению авторов, дифференцированный подход к выбору метода гемостаза в зависимости от интенсивности ЛК позволяет улучшать результаты лечения и сокращать количество операций на высоте кровотечения [6].
Экстренное или срочное хирургическое вмешательство при ЛК показано в следующих случаях:
- Отсутствует техническая возможность выполнения эндоскопического гемостаза и эндобронхиальной окклюзии бронхиальных артерий.
- ЛК продолжается, несмотря на выполненный эндоскопический гемостаз или эмболизацию.
- При точно установленном источнике кровотечения, резектабельности опухоли и функциональной операбельности пациента [3, 9].
Операции при ЛК подразделяются на экстренные, срочные и плановые. Экстренные операции выполняются в течение 24 часов от начала ЛК и показаны при массивном и профузном кровотечении в случаях неэффективности консервативного гемостаза, включающего лекарственную терапию, эндоскопический и эндоваскулярный гемостаз [3]. Срочные операции выполняются в течение 24 часов 8 суток от начала ЛК в случаях нестабильного гемостаза на фоне проводимой гемостатической терапии и малоинвазивной остановки кровотечения. Плановые операции проводятся по поводу НМРЛ, ставшего источником ЛК, после получения данных о распространенности заболевания [3].
По данным Е.Г. Григорьева (2014), хирургическое вмешательство по поводу продолжающегося ЛК снижает летальность до 19% [3]. Современные возможности анестезиологии и реаниматологии позволяют проводить реконструктивно-пластические операции, тем самым улучшая качество лечения, расширяя границы операбельности и увеличивая продолжительность жизни больных распространенными формами НМРЛ. Выполнение расширенных комбинированных операций при НМРЛ позволяют остановить дальнейшее развитие тяжелых осложнений и создают условия для дальнейшего проведения противоопухолевого лечения [1, 26].
Таким образом, современные возможности хирургического лечения РЛ позволяют выполнять обширные вмешательства даже в экстренном и срочном порядке. Но у части больных НМРЛ на момент развития ЛК имеют место диссеминированные или нерезектабельные местнораспространенные опухолевые процессы. Также существует небольшая часть больных, которые не могут переносить вмешательства большого объема по причине выраженной сопутствующей патологии.
В таких случаях альтернативным и эффективным методом остановки ЛК является селективная ангиография с эмболизацией источника кровотечения [27].
Клинический случай
Больной Г. 53 лет, № истории болезни 2006/20738, мужчина, курил в течение 45 лет по 2 пачки сигарет в день, неоднократно переносил пневмонии. Опухолевые заболевания в семье отрицает. Впервые больной обратился за медицинской помощью в поликлинику по месту жительства в октябре 2006 г. с жалобами на одышку, слабость, гипертермию до 38оС, кровохарканье; была проведена антибактериальная терапия, но без эффекта. После проведенного обследования в поликлинике по месту жительства был выявлен рак правого легкого и пациент направлен к районному онкологу.
Далее больной был направлен в поликлинику ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, где диагноз был подтвержден, отдаленных метастазов не выявлено: центральный рак правого главного бронха, ателектаз нижней и средней долей, вторичная обструктивная пневмония с абсцедированием, кровохарканье,T2bN2M0 (IIIA-стадия). 14.12. 2006 больной был госпитализирован в хирургическое торакальное отделение торако-абдоминального отдела РОНЦ им. Н.Н. Блохина РАМН в состоянии средней тяжести. При поступлении пациент предъявлял жалобы на кашель, кровохарканье в виде прожилок крови в мокроте, слабость, одышку при физической нагрузке, гипертермию до 39оС, озноб.
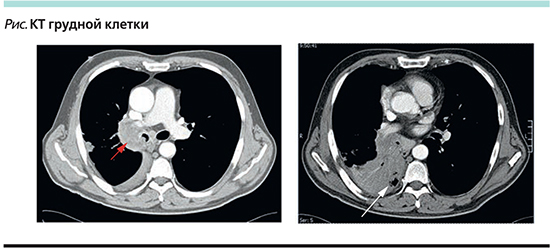
По результатам проведенного инструментального обследования (рентгенологическое исследование и компьютерная томография [КТ] грудной клетки) у больного выявлен центральный рак правого легкого размером около 6 см, охватывающий главный, верхнедолевой, среднедолевой и нижнедолевой бронхи с возможной инвазией средостения в области бифуркации трахеи, где имеются лимфоузлы до 1,5 см в диаметре, с метастатическим поражением лимфоузлов корня легкого, вторичное воспаление в нижней и средней долях легкого (см. рисунок). По данным бронхоскопии, у больного центральный рак правого легкого смешанного характера роста с поражением всех крупных бронхов, в т.ч. правого главного бронха с проксимальной границей инфильтрации на уровне 0,5 см от карины, с косвенными признаками поражения лимфоузлов корня правого легкого.
Гистологическое и цитологическое исследования биоптата опухоли: плоскоклеточный рак.
По данным инструментального обследования (радиоизотопное скенирование костей, ультразвуковое исследование брюшной полости, периферических лимфоузлов, магнитнорезонансная томогрпфия головного мозга), отдаленных метастазов не выявлено.
Лабораторные данные на момент поступления в стационар: лейкоциты – 20,2×109/л; гемоглобин – 14,8 г/л; гематокрит – 43,4%; эритроциты – 4,7×106/л; тромбоциты – 238×109/л; гранулоциты – 89,9%; палочкоядерные нейтрофилы – 10%. В биохимическом анализе крови выраженных отклонений от нормы не выявлено (глюкоза – 6,8 ммоль/л; креатинин – 90 мкмоль/л; общий билирубин – 26 мкмоль/л; прямой билирубин – 10 мкмоль/л; непрямой билирубин – 16 мкмоль/л; общий белок – 79,8 г/л; альбумин – 38,6 г/л; АСТ – 13,1 ЕД/л; щелочная фосфатаза –279 ЕД/л).
ЭКГ 30.10.2006: синусовая тахикардия с частотой сердечных сокращений 115 ударов в минуту.
Спирометрия 06.12.2006: выраженное (II степени) снижение легочных объемов. Умеренная обструкция (I степени). Выраженное (II степени) снижение резервов вентиляции. Из сопутствующей патологии выявлены хроническая обстуктивная болезнь легкого, транзиторная артериальная гипертензия.
В торакальном отделении больному была проведена антибактериальная терапия, на фоне которой пациент отмечал улучшение состояния, но при этом сохранялась температура тела до 38оС, в связи с чем больной был в срочном порядке оперирован после предоперационной антибактериальной подготовки. Утром 20.12.2006 до операции у больного отмечено одномоментное поступление темной крови объемом около 50 мл.
20.12.2006 в экстренном порядке выполнена комбинированная пневмонэктомия справа с резекцией перикарда. Торакотомия в 5-м межреберье справа. При ревизии: в правой плевральной полости умеренно выраженный спаечный процесс, локализующийся преимущественно в проекции верхней и средней долей. Ателектаз нижней и средней долей. В корне правого легкого определяется массивный опухолевый инфильтрат, сливающийся с увеличенными лимфатическими узлами корня легкого и бифуркации трахеи. Опухоль на значительном протяжении врастала в перикард и инфильтрировала правый диафрагмальный нерв. Рассечена легочная связка. Перикардиотомия медиальнее правого диафрагмального нерва. Интраперикардиально последовательно выделены, лигированы и пересечены сосуды правого легкого. Боковая стенка перикарда иссечена. Непарная вена лигирована и пересечена. Выполнена бифуркационная и паратрахеальная лимфодиссекция. Правый главный бронх пересечен на уровне трахеобронхиального угла, выполнена пластика культи бронха по Оверхольту. Линия швов бронха плевризована лоскутом медиастинальной плевры, проведенным под верхней полой веной. Контроль герметичности бронха. Гемостаз. Правая плевральная полость дренирована 1-м дренажем. Торакотомная рана ушита послойно. Из правой плевральной полости эвакуировано 600 мл воздуха. В конце операции была выполнена экстренная бронхоскопия в условиях искусственной вентиляции легких: в просвете незначительное количество слизистого содержимого с геморрагическим компонентом, в просвете долевых бронхов содержимого нет. Слизистая оболочка очагово гиперемирована. Произведена санация путем аспирации содержимого.
Течение анестезии – без особенностей. Пробуждение и экстубация больного на операционном столе, переведен в отделение реанимации и интенсивной терапии.
Гистологическое исследование операционного материала № 32495 от 21.12.2006. Макроскопическое описание: правое легкое с фрагментом правого главного бронха длиной 1,3 см.
На расстоянии 1,8 см от края резекции правого главного бронха в стенке верхнедолевого бронха имеется разрастание белесоватой мягкоэластичной ткани на протяжении 7 см, распространяющейся на второй сегментарный бронх с полной обтурацией просвета долевого бронха. На разрезе видно, что белесоватая ткань разрастается перибронхиально в виде белесоватого узла на площади 5×6×5 см, с инфильтрацией корня легкого и лимфоузлов корня легкого. Верхняя доля полнокровна, маловоздушна.
В нижнедолевом бронхе,на расстоянии 0,5 см от его начала и 2 см от края резекции правого главного бронха располагается участок разрастания белесоватой мягкоэластичной ткани размером 2×1см. Нижняя доля на разрезе красного цвета, воздушная. В средней доле субплеврально, соответственно 4-му сегменту легкого, располагается плотноватый белесоватый участок до 0,5 см с четкими границами, также в средней доле легкого располагаются множественные плотные участки диаметром от 1 до 1,5 см с зернистой поверхностью на разрезе. Слизистая оболочка среднедолевого бронха гладкая, блестящая.
Микроскопическое описание: в легком разрастание умеренно дифференцированной аденокарциномы с перибронхиальным ростом, с обширными зонами некроза. В прилежащих отделах легкого картина хронической абсцедирующей пневмонии. По линии резекции главного бронха элементов опухоли не обнаружено. В двух бифуркационных лимфоузлах метастазы рака. В лимфоузлах корня лекого реактивные изменения.
На 2-е сутки после операции эвакуировано около 500 мл геморрагического отделяемого без сгустков. Течение раннего послеоперационного периода без осложнений. Проведена антибактериальная терапия Сульперазоном по 2 г 3 раза в день внутривенно. На 3-и сутки после операции больной переведен из отделения реанимации и интенсивной терапии в торакальное отделение.
На 7-е сутки после операции в связи с сохраняющейся гипертермией до 37,5оС и сгущением легочного рисунка слева по данным рентгенографии грудной клетки больной переведен на внутривенное введение Тиенама 0,5 г 3 раза в день и Таваника 500 мг 2 раза в день. При пункции правой плевральной полости эвакуировано 300 мл серозно-геморрагической жидкости.
28.12.2006: общий анализ крови: лейкоциты – 6,8×109/л; эритроциты – 3,09×106/л; гемоглобин – 9,6 г/л; гемотокрит – 27,8%; тромбоциты – 402×109/л; палочкоядерные нейтрофилы – 11%, гранулоциты – 76,4%.
02.01.2007 больной был выписан в относительно удовлетворительном состоянии домой с диагнозом «центральный рак правого главного бронха, ателектаз нижней и средней долей, вторичная обструктивная абсцедирующая пневмония, рецидивирующее легочное кровотечение от 20.12.2006 г., pT3N2M0 (IIIA-стадия)». Продолжительность пребывания больного в стационаре – 19 койко-дней, из них до экстренной операции – 6 койко-дней.
В январе 2007 г. больной был консультирован радиологом РОНЦ: с учетом распространенности заболевания больному рекомендована лучевая терапия РОД-2 Гр, СОД- 40 Гр. Проведено два сеанса лучевой терапии, при этом отмечено резкое ухудшение состояния больного, в связи с чем лучевая терапия была отменена. При бронхоскопии был выявлен продолженный рост опухоли по линии резекции бронха: плоскоклеточный рак. От проведения химиотерапии и наблюдения в РОНЦ и в онкодиспансере по месту жительства больной отказался. В последующем у больного были эпизоды кровохарканья на фоне прогрессирования заболевания. Больной умер в августе 2009 г.
Общая продолжительность жизни с момента постановки онкологтческого заболевания составила 32 месяца.
Заключение
Таким образом, правильно определенная степень ЛК и выбранная, соответственно, хирургическая тактика в отношении данной тяжелой категории больных – это оптимальный способ лечения, позволяющий не только остановить кровотечение, но и удалить одномоментно опухоль как причину кровотечения, максимально продлить жизнь пациента даже при паллиативном характере вмешательства.
Кроме того, для части больных распространенными формами НМРЛ удаление опухоли как источника легочного кровотечения позволяет проводить химиолучевое лечение в послеоперационном периоде – важный компонент комбинированного лечения НМРЛ [1].


