Введение
Нейроэндокринные опухоли (НЭО) – группа редких опухолей, которые могут развиваться в любых органах, имеют свои уникальные особенности происхождения, течения и диагностики. НЭО объединяют разнородную группу опухолей, способных вырабатывать и запасать биологически активные вещества (гормоны, пептиды, нейропередатчики), экспрессировать нейроэндокринные маркеры, что является их основной характеристикой и нередко сопровождается яркими симптомами болезни.
Представления о НЭО развивались в течение длительного времени, которое потребовалось для накопления достаточного материала и формирования определенной концепции о природе данных опухолей.
Развитие визуальных, иммуногистохимических методов диагностики, идентификация основных биохимических маркеров, эффективный анализ большой выборки эпидемиологических данных, генетические исследования свидетельствуют о неуклонном росте заболеваемости и необходимости поиска новых подходов к диагностике и лечению НЭО.
В настоящее время наиболее перспективным решением служит корпоративное, или полидисциплинарное, взаимодействие между различными научными направлениями и медицинскими специальностями.
Для решения современных проблем эпидемиологии, диагностики и лечения НЭО в 2009 г. создано междисциплинарное сообщество МОЛНЭО (Медицинское общество по лечению нейроэндокринных опухолей), основным направлением деятельности которого и являются концентрация, анализ и пропаганда знаний о НЭО различных локализаций.
Эпидемиология НЭО
В России в настоящее время начал функционировать Регистр базы данных по заболеваемости НЭО, который также демонстрирует рост заболеваемости, аналогичный международным статистическим данным. Анализ базы данных SEER (Surveillance, Epidemiology and End Results) показал, что заболеваемость НЭО в 2010 г. достигла 5,25/100 тыс. в год. Несмотря на то что частота встречаемости НЭО составляет всего 1–2 случая на 100 тыс., при аутопсии данный показатель выше и равен 8,4 на 100 тыс. населения. Частота обнаружения НЭО при аутопсии свидетельствует о том, что их распространенность существенно выше регистрируемой [2, 3].
НЭО – это чаще всего медленнорастущие новообразования, диагностируемые на поздних стадиях [1].
Бронхопульмональные НЭО составляют до 3% всех злокачественных новообразований этой локализации и порядка 25% всех НЭО. Большая часть НЭО представлена опухолями органов желудочно-кишечного тракта (ЖКТ), включая поджелудочную железу (ПЖ). Эти новообразования составляют до 2% всех злокачественных новообразований пищеварительной системы и более 60% всех НЭО. Наиболее частыми локализациями в этой группе являются подвздошная кишка (17,1%), прямая кишка (16,3%), желудок (5,4%) и аппендикс (4,7%). Встречаются также НЭО редких локализаций (производных эмбрионального нервного гребешка, нейроэктодермы и эндодермы), частота которых составляет порядка 15% всех НЭО. Потому НЭО могут выявляться в эндокринных (феохромоцитома и параганглиома, медуллярный рак щитовидной железы, опухоли паращитовидных желез и передней доли гипофиза) и других органах (вилочковая, молочная, предстательная железы, почки, яичники, кожа).
Высокодифференцированные НЭО
I. НЭО пищеварительного тракта
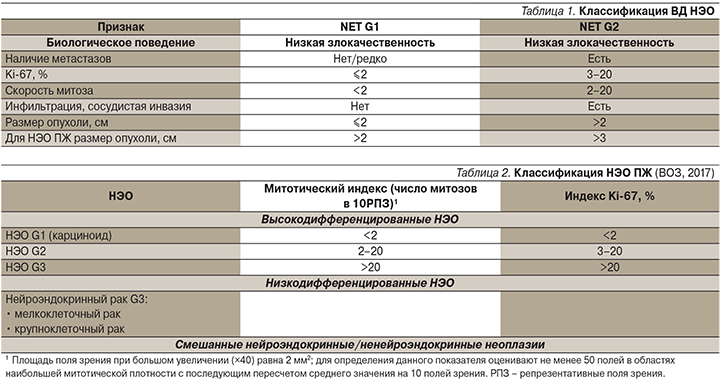
Согласно классификации Всемирной организации здравоохранения (ВОЗ, 2010), НЭО высокой степени дифференцировки подразделяются на высокодифференцированные (ВД) НЭО (NET) G1 и G2.
Для НЭО пищеварительного тракта митотический индекс NET G1<2, Ki-67≤2%, для NET G2 митотический индекс=2–20, Ki-67=3–20%.
Группа ВД НЭО характеризуется низким пролиферативным потенциалом, способностью секретировать разнообразные биологически активные вещества и низкой чувствительностью к химиотерапии.
К этой группе могут быть отнесены:
- карциноиды различного происхождения (эмбриогенетически развивающиеся в производных передней, средней и задней кишки);
- опухоли из хромаффинных клеток (феохромоцитома);
- медуллярная карцинома щитовидной железы.
Классификация высокодифференцированных НЭО основана на диагностических факторах, представленных в табл. 1.
Важно: чем выше индекс Ki-67, тем хуже прогноз!
Для НЭО панкреатической локализации в 2017 г. была впервые выделена группа G3 (ВД НЭО, демонстрирующие повышенную пролиферативную активность; табл. 2). В настоящее время увеличивается количество публикаций с использованием новой классификации НЭО ЖКТ.
Отдельную группу составляют нейроэндокринные карциномы (НЭК) G3, внутри которых выделяют крупно- и мелкоклеточный рак. Степень дифференцировки наряду с индексом пролиферации и спектром генетических мутаций должна стать основным составляющим в разграничении между НЭК G3 и НЭО G3.
II. НЭО легких и тимуса ВД опухоли:
- типичный карциноид, низкий митотический индекс <2/10РП31 G1;
- атипичный карциноид, высокий митотический индекс 2 – 10/10РП3 G2.
НЭО тимуса – редкие и агрессивные опухоли. Могут сочетаться с синдромом Кушинга (30%) и входить в МЭН (множественная эндокринная неоплазия) синдром.
Диагностический алгоритм НЭО
Обследование больного включает:
- клинический и биохимический анализы крови;
- обязательное гистологическое исследование с указанием степени дифференцировки и индекса пролиферации Ki-67;
- исследование уровня хромогранина А, серотонина в сыворотке крови, нейронспецифической енолазы при НЭО легких;
- гормоны адренокортикотропный (АКТГ) кортизол для НЭО тимуса;
- бронхоскопия с биопсией при НЭО легких;
- трансторакальная биопсия для НЭО тимуса;
- эзофагогастродуоденоскопия (ЭГДС);
- эндоскопическая ультрасонография (по показаниям);
- фиброколоноскопия (по показаниям);
- ультразвуковое исследование, компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) органов брюшной полости и малого таза;
- рентгенография, КТ органов грудной клетки;
- сцинтиграфия костей;
- КТ/МРТ головного мозга (по показаниям).
Дополнительно: сцинтиграфия с 111In-октреотидом (октреоскан). Оптимально определение уровня 5-гидрокси-3-индол уксусной кислоты мочи и других маркеров (гастрин, инсулин, соматостатин).
Лечение
С учетом индолентного течения заболевания (хотя в некоторых случаях возможно и достаточно агрессивное поведение опухоли) хирургический подход в настоящее время остается основным даже при распространенных формах НЭО. Всем пациентам, которым возможно удаление опухоли, необходимо проводить операцию. В данном случае циторедуктивные вмешательства позволяют наряду с контролем симптомов и повышением качества жизни увеличить длительность ремиссии и улучшить прогноз [4]. При поражении печени проводятся эмболизация и химиоэмболизация метастазов, радиочастотная аблация и криодеструкция в сочетании как с системной терапией, так и без таковой.
При карциноидном синдроме проводят лечение аналогами соматостатина.
Наряду с локальными методами воздействия на опухоль безусловный приоритет в лечении диссеминированного карциноида остается за системной терапией. На протяжении последних 20 лет активно изучалась эффективность цитостатиков и их комбинаций.
Пациентам с локализованными НЭО после выполнения радикального хирургического вмешательства рекомендуется обследование каждые 3–6 месяцев в течение первых 2–3 лет и каждые 6–12 месяцев в последующие 2–3 года. К адекватным методам обследования относятся ЭГДС, КТ или МРТ брюшной полости. Опухолевые маркеры (хромогранин А, серотонин) исследуются при исходном их повышении. Больным распространенными НЭО обследование следует выполнять чаще – каждые 2 месяца во время лечения и каждые 3 месяца после его завершения.
Для НЭО легких и тимуса после радикального хирургического лечения контроль проводится через 3 месяца (КТ грудной клетки, маркеры). Далее – контроль каждые 6 месяцев в течение 3 лет и 1 раз в год начиная с 4-го года.
Низкодифференцированные НЭО (НЭК)
Согласно классификации ВОЗ 2010 г., к НЭК относятся низкодифференцированные НЭО (G3) с Ki-67>20% или с числом митозов >20 в 10 полях зрения при большом увеличении (при этом для НЭК легкого и тимуса принимается во внимание только число митозов и значение >10 в 10 полях зрения). НЭК представляют собой опухоли с агрессивным течением, выраженной ядерной атипией и мультифокальными некрозами [5]. От других низкодифференцированных карцином НЭК отличается экспрессией нейроэндокринных маркеров – диффузной для синаптофизина, фокальной для хромогранина А. Все больше данных свидетельствуют о разнородности данной группы опухолей. Различие может определяться не только локализацией первичной опухоли (ЖКТ, ПЖ, легкие и т.п.), но и степенью дифференцировки. Например, известно, что НЭК с Ki-67>55% лучше отвечают на платиносодержащую химиотерапию, но в то же время продолжительность жизни на 4 месяца меньше, чем при НЭО с Ki-67 от 20 до 55% [5]. Среди НЭК отдельно выделяют мелко- и крупноклеточный нейроэндокринный рак. Для мелкоклеточного рака индекс пролиферации может составлять от 55 до 100%, а для крупноклеточного рака – от 40 до 70%. Дальнейшие морфологические и молекулярно-генетические исследования, возможно, позволят более четко разделить данную группу НЭО на ВД опухоли G3 и низкодифференцированную карциному G3.
Эпидемиология
НЭК гастроэнтеропанкреатической локализации составляет лишь 1% от всех злокачественных опухолей этой зоны. В 85% случаев выявляются метастазы, причем в 65% случаев – отдаленные [6, 22]. Наиболее часто выявляются метастазы в печени (70%), затем в легких (15%), костях (15%) и головном мозге (4%) [22]. У мужчин и женщин заболевание выявляется с одинаковой частотой. Средний возраст выявления заболевания составляет 60 лет [22]. Что касается НЭК грудной локализации, то мелкоклеточный рак составляет 20%, крупноклеточный нейроэндокринный рак – 3% всех случаев злокачественных опухолей легких. Мелкоклеточный рак легкого (МРЛ) выявляется, как правило, у мужчин с длительным периодом курения и в возрасте более 65 лет. Наиболее часто МРЛ метастазирует в печень, головной мозг, надпочечники, кости и костный мозг, причем в 2/3 случаев МРЛ выявляется уже с отдаленными метастазами.
Особенности клинических проявлений
В большинстве случаев НЭК не сопровождаются гормональными синдромами, а т.к. две трети опухолей диагностируются с наличием отдаленных метастазов, клинические проявления, как правило, характеризуются общими симптомами распространенного онкологического заболевания – анорексией, потерей массы тела и слабостью. Однако следует отметить следующие характерные гормональные синдромы, которыми иногда проявляется МРЛ, а именно синдром Кушинга (гиперсекреция адренокортикотропного гормона – АКТГ; в 4% случаев) и синдром неадекватной секреции антидиуретического гормона (АДГ; в 4% случаев). Клиническая картина синдрома Кушинга проявляется прежде всего ожирением, стриями на коже, избыточным ростом волос на теле, нарушением менструального цикла и бесплодием у женщин, снижением сексуального влечения и потенции у мужчин, мышечной слабостью, повышением артериального давления, развитием сахарного диабета и снижением иммунитета. При синдроме неадекватной секреции АДГ в результате задержки жидкости развиваются гиперволемия и симптомы водной интоксикации: олигурия, головные боли, головокружение, анорексия, тошнота, рвота, нарушение сна. Первые симптомы водной интоксикации появляются после снижения уровня натрия в плазме крови ниже 120 ммоль/л. При более выраженной гипонатриемии на первый план выходят симптомы со стороны центральной нервной системы: дезориентация, судороги, аритмия и коматозное состояние вследствие отека головного мозга.
Прогноз и выживаемость
Выживаемость при НЭК низкая и может составлять от 5 месяцев при диссеминированном процессе до 38 при локализованном [7]. При диссеминированном процессе лишь 5% больных имеют длительную продолжительность жизни [8]. Выживаемость без прогрессирования после платиносодержащей химиотерапии и общая выживаемость различаются в зависимости от локализации первичной опухоли – наихудшие показатели при НЭК пищевода, ободочной и прямой кишки в отличие от НЭК желудка и ПЖ [5]. К факторам неблагоприятного прогноза относятся плохое общее состояние, повышенный уровень лактатдегидрогеназы (ЛДГ) и тромбоцитоз.
Диагностика
Биохимические маркеры. При распространенных НЭК уровень хромогранина А в плазме может быть повышен у 2/3 пациентов [5], хотя значения в целом ниже таковых при высокодифференцированных НЭО [9, 10]. Напротив, уровень такого маркера, как нейронспецифическая енолаза, выше при низкодифференцированных опухолях и достоверно коррелирует с выживаемостью.
Эндоскопические и рентгенологические исследования. Эндоскопические исследования (бронхоскопия, гастроскопия, колоноскопия, энтероскопия) позволяют не только диагностировать первичную опухоль, но и брать биопсию. После подтверждения НЭК при гистологическом исследовании необходимо выполнить КТ или МРТ всех зон для оценки распространенности процесса и выработки тактики лечения. Позитронно-эмиссионная томография (ПЭТ) может быть полезной, если планируется радикальное оперативное вмешательство или если необходима оценка неоднозначных данных КТ или МРТ. Исследования с мечеными изотопами аналогами соматостатина не рекомендованы к использованию в рутинной практике, т.к. низкодифференцированные опухоли в основном не экспрессируют рецепторы к соматостатину. Хотя при НЭК некоторых локализаций возможно выполнение данного исследования. В частности, до 45% НЭК ПЖ позитивны при изотопных исследованиях с аналогами соматостатина [5] и особенно при более низких значениях Ki-67 (<55%). Выполнение КТ или МРТ головного мозга обязательно лишь при НЭК легких. При НЭК других локализаций частота метастазирования в головной мозг низкая и составляет <5% [5], поэтому такие исследования надо выполнять лишь при наличии неврологической симптоматики.
Гистология и генетика НЭК
В основе иммуногистохимического исследовании для выявления НЭК лежит оценка нейроэндокринного фенотипа. При крупноклеточной НЭК обязательно позитивное окрашивание на синаптофизин; окрашивание на хромогранин А носит непостоянный характер. Отсутствие экспрессии обоих маркеров редко встречается при мелкоклеточном раке <5% [5]. Другие нейроэндокринные маркеры, такие как нейронспецифическая енолаза и CD56, менее специфичны и должны интерпретироваться с осторожностью. Часто присутствуют распространенные некрозы. Определение рецепторов 2-го типа носит факультативный характер. Как и в случае МРК, НЭК других локализаций несут частые мутации в генах p53 и RB.
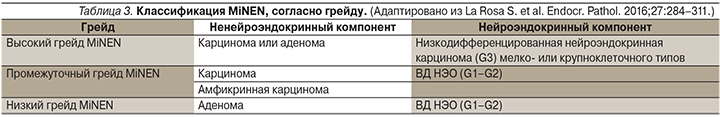
Что касается смешанных опухолей, то опухоль считается смешанной аденонейроэндокринной карциномой (MANEC), если доля ненейроэндокринного компонента в опухоли превышает 30%. Согласно последней классификации, эти опухоли переименованы в смешанные нейроэндокринные-ненейроэндокринные неоплазии (MiNEN). Они имеют три степени дифференцировки: высокий, промежуточный и низкий грейды. Подробное описание представлено в табл. 3.
Лечение НЭК
Хирургия. Операция обычно выполняется при локализованном процессе, и ретроспективные данные свидетельствуют о том, что результаты лучше при комбинированном лечении [11]. В связи с частыми рецидивами после радикальных оперативных вмешательств в качестве комбинированного лечения, как правило, используется адъювантная химиотерапии на основе производных платины. В частности, у больных, прооперированных по поводу мелкоклеточного рака пищевода, продолжительность жизни составила 5 месяцев без адъювантной химиотерапии и 20 – с адъювантной химиотерапией [12]. Схожие результаты получены и при МРЛ. При распространенном процессе циторедуктивные операции и удаление отдельных метастазов не рекомендуются.
Медикаментозное лечение. Химио-терапия – важная часть комплексного подхода к лечению. локализованных НЭК и основной метод в лечении распространенных НЭК. Продолжительность жизни пациентов с распространенным процессом, получающих химиотерапию, сильно различается и составляет от 7 до 19 месяцев, что значительно превосходит показатели продолжительности жизни при симптоматической терапии, которые составляют всего лишь около 2–3 месяцев. Химиотерапию следует начинать в ранние сроки, т.к. быстро может наступить ухудшение общего состояния больного. Основываясь на показателях эффективности комбинации этопозида с цисплатином при МРЛ, данная схема лечения получила широкое распространение и при гастроэтеропанкреатических НЭК [5, 13–18]. Частота объективного эффекта при гастроэтеропанкреатических НЭК составляет около 30%, а медиана продолжительности жизни – около года. По результатам одного крупного исследования (Sorbye et al.), оказалось, что ответ на химиотерапию лучше при индексе пролиферации Ki-67 более 55%, а продолжительность жизни меньше – 42 против 15% и 10 месяцев против 14 – соответственно. Другими негативными прогностическими факторами в этом исследовании стали плохое общее состояние, первичная опухоль толстой кишки, тромбоцитоз и повышенный уровень лактатдегидрогеназы. Альтернативные по эффективности замены цисплатина на карбоплатин и этопозида на иринотекан, одобренные для МРЛ, по всей видимости, допустимы и при гастроэтеропанкреатических НЭК, о чем свидетельствуют не очень крупные, но подтверждающие это исследования [13, 19–24].
Возможно применение схем на основе оксалиплатина (XELOX и FOLFOX) или схемы FOLFIRI, при применении которых эффективность может составлять от 23 до 40%. Темозоломид в монорежиме или в комбинации с капецитабином и бевацизумабом позволил достичь 33% объективного эффекта от 25 больных НЭК (17 больных гастроэтеропанкреатическими НЭК) [25]. Повторное назначение комбинации этопозида с цисплатином возможно при безрецидивном периоде более 3 месяцев и отсутствие кумулятивной токсичности (нейротоксичность, ототоксичность).
Другие виды лечения (лучевая терапия и пептидрецепторная радионуклидная терапия). В отличие от рекомендаций при локализованном МРЛ профилактическое облучение головного мозга не показано при НЭК внелегочной локализации, т.к. метастазирование в головной мозг бывает сравнительно редко у таких больных. Паллиативная лучевая терапия возможна с обезболивающей целью при метастазах в костях. У части больных НЭК отмечается высокая экспрессия рецепторов соматостатина, однако нет данных, свидетельствующих о возможности применения аналогов соматостатина в такой ситуации. В ряде опубликованных клинических случаев показаны длительные эффекты на пептидрецепторную радионуклидную терапию больных НЭО, но данная методика в большинстве своем неэффективна при НЭК [26].
Больным локализованными НЭК после выполнения радикального хирургического вмешательства рекомендуется обследование каждые 3–6 месяцев в течение первых 2–3 лет и каждые 6–12 месяцев в последующие 2–3 года. Адекватными методами обследования являются КТ или МРТ. Опухолевые маркеры (хромогранин А и нейронспецифическая енолаза) должны исследоваться, только если они были повышены перед операцией. Больным распространенными НЭК обследование следует выполнять чаще – каждые 2 месяца во время лечения и каждые 3 месяца после его завершения.


