Введение
В последние годы резко возросла частота кожных заболеваний, возникновение которых связывают с ультрафиолетовым излучением. К таким заболеваниям в первую очередь следует отнести актинический кератоз (АК), также известный как солнечный кератоз, который является наиболее распространенным предраковым новообразованием кожи [1, 2]. Первые упоминания АКТ относятся к концу ХIХ в., но уже к началу ХХ в. заговорили о злокачественном потенциале данного заболевания [5]. Умеренно выраженный АК встречается часто с преобладанием 15,4 и 34% мужчин и 5,9 и 18,2% женщин в 40- и 70-летнем возрасте соответственно. Высокая частота встречаемости АК в первую очередь связана с накопительным эффектом от пребывания на солнце или облучении в солярии, т.е. вовсе не обязательно получать солнечные ожоги, достаточно в течение ряда лет получать обычную для среднестатистического человека дозу солнечного облучения открытых участков кожи.
В связи с преимущественным поражением кожи лица, шеи, тыла кистей у пациентов развиваются косметические, личностные, психологические и социальные проблемы.
Основные факторы риска: пожилой возраст, светлый тон кожи, частая инсоляция в течение жизни и длительные иммуносупрессии [6, 8, 9]. Важно отметить, что хотя в массе случаев АК не превращается в инвазивный плоскоклеточный рак кожи, большинство инвазивных плоскоклеточных карцином развивается на месте АК [10].
Диагностика АК
В настоящее время для диагностики АК используется множество методов, среди них – гистологическое исследование, цитологическое исследование кожи, УЗИ кожи, дерматоскопическое исследование. Обычно АК диагностируется клинически и подтверждается с помощью цитологического, а также дерматоскопического или ультразвукового (УЗИ) исследований. Когда клинический диагноз сомнителен или в случаях клинических признаков, указывающих на злокачественное перерождение АК, необходимо гистологическое исследование.
Микроскопически АК характеризуется пролиферацией интраэпидермальных кератиноцитарных атипий (крупных плеоморфных и гиперхромных ядер) с потерей полярности и митотических показателей. Эти клетки сходны с кератиноцитами в инвазивном плоскоклеточном раке кожи, что и приводит в дальнейшем к перерождению ряда очагов АК [3]. Частота встречаемости инвазивной плоскоклеточной карциномы у больных АК, по разным источникам, составляет 5–20% в течение 10–25 лет, а скорость преобразования АК в плоскоклеточный рак – 0,1–0,24% в течение 1 года. Установлено, что 8,4–100% больных инвазивной плоскоклеточной карциномой на открытых участках кожи имели в анамнезе АК [3].
Клиническая картина
Клинически АК проявляется в виде единичных или множественных эритематозных, слегка инфильтрированных пятен небольших размеров округлых или овальных очертаний, покрытых плотно прилегающими серыми или желтовато-коричневыми чешуйками, после удаления которых обнаруживается сосочковая, иногда эрозированная поверхность.
Методы лечения АК
С учетом вышерассмотренных фактов актуален вопрос о лечении АК. В соответствии с российскими, американскими и европейскими клиническими рекомендациями на сегодняшний день существует несколько методов лечения АК. Выбор метода лечения определяется числом пораженных участков, их размером, продолжительностью заболевания и локализацией очага поражения, а также зависит от сопутствующих заболеваний, желаемых косметических результатов и пожеланий пациента. Методы лечения АК включают хирургическое иссечение, кюретаж и электрокоагуляцию, лазерную деструкцию, фотодинамическую терапию, аппликацию мази с 5-фторурацилом, криодеструкцию. Важность излечения АК объясняет такой широкий диапазон применяемых методов. В то же время каждый из используемых методов имеет ряд недостатков.
Хирургический метод лечения используется исключительно редко и только в том случае, когда АК представляет собой плотную бляшку с возможностью более глубокой инвазии. Выбор данной методики обычно обусловлен наличием признаков, указывающих на высокую вероятность развития плоскоклеточного рака. После иссечения пораженного участка накладывается косметический шов, однако вероятность косметических дефектов при данном методе очень высока.
Кюретаж – это разновидность хирургического вмешательства удаления образования с помощью выскабливания. Данный метод считается сильно устаревшим и редко используется для лечения АК в связи с недостаточной его эффективностью, а также часто возникающих косметических дефектов кожи после его проведения, длительностью восстановления кожных покровов и частой инфицированностью зоны его проведения в связи с недостаточным соблюдением пациентами рекомендаций врача по уходу за соответствующей зоной.
Электрокоагуляция – это деструкция, или разрушение образования путем прижигания высокочастотным электрическим током. Эффективность данного метода для лечения АК не подтверждена клиническими исследованиями, при этом высока вероятность образования рубцов.
Дермабразия используется для лечения множественного АК. Применяются алмазные фрезы или проволочные щеточки со скоростью вращения в диапазоне от 800 до 33 тыс. об/мин, неудобство метода заключается в том, что пациент должен находиться в стационаре минимум неделю.
Широко известны три вида медикаментозного лечения АК: аппликации мази с 5-фторурацилом – действие препарата направлено на нарушение синтеза ДНК, угнетение деления патологических клеток; применение имиквимода – действие препарата направлено на стимуляцию синтеза интерферона: вещества, уничтожающего раковые и предраковые клетки. Лечение данным препаратом длится около 4 месяцев; гель с диклофенаком и гиалуроновой кислотой назначают при высокой чувствительности кожи к другим видам лекарств. Активным компонентом в этом случае выступает диклофенак, его действие направлено на предотвращение появления плоскоклеточных карцином.
Данные методы лечения не учитывают пролиферативной способности клеток, определяющей их способность к инвазии, что приводит к рецидиву болезни. Криодеструкция – метод, основанный на локальном воздействии низких температур на пораженные ткани, однако очаг поражения не всегда ограничивается пораженными клетками и часто страдают здоровые ткани. Изменения, происходящие в клетках, связаны с преобразованием, которому подвергается вода в клетке: при охлаждении она превращается в лед прямо в тканях, соответственно, клетки ткани сдавливаются льдом. Кристаллы льда по мере образования вращаются вокруг центра кристаллизации и буквально «разрезают» клеточные и внутриклеточные мембраны. На время замораживания останавливается кровообращение, доставка кислорода, питательных веществ, все биохимические реакции прекращаются и клетки гибнут. К тому же при замораживании происходит скачок осмотического давления, который клетки не могут перенести. Воздействие холода приводит к необратимому разрушению тканей – некрозу. Однако в отличие от лазерной терапии данный метод не дает возможности определить нужную глубину поражения тканей, в результате чего страдают здоровые ткани, что увеличивает срок регенерации кожных покровов.
Лечение с помощью лазерной деструкции (СО2 лазером) АК происходит методом шлифовки верхних слоев кожи, применяется только при начальных стадиях заболевания, имеет ряд противопоказаний, связанных с наличием сопутствующих заболеваний (сахарный диабет, аутоиммунные заболевания, псориаз и т.д.), пожилого возраста [11–24]. Кроме того, косметические проблемы, возникающие после применения указанных методов лечения, в значительной мере усугубляют социально-психологические, межличностные отношения для большинства больных, часто вызывая тревогу и снижение качества жизни.
Фотодинамическая терапия решает вопрос неблагоприятных косметических последствий [25] и более остальных соответствует требованиям врача и пациента, однако экономические затраты по обеспечению медицинских организаций лазерными установками и фотосенсибилизаторами ограничивают ее широкое применение. В последние 20 лет особое внимание привлекает возможность применения гипертермии, в частности лазериндуцированной термотерапии (ЛИТТ) как самостоятельной органосохраняющей лечебной технологии при некоторых сóлидных опухолях человека. Метод ЛИТТ основан на локальном прогревании новообразования до 43–45°С с помощью лазера, длина волны которого имеет диапазон от 800 до 1064 нм.
В результате воздействия лазерного излучения на ткань происходит избирательное нагревание атипичных клеток, связанное с измененной структуры сосудистого русла в области новообразования, что приводит к образованию микротромбоза в пораженной области и как следствие – к гипоксии атипичных клеток, что в свою очередь запускает процессы некроза и апоптоза. Известно, что ЛИТТ позволяет достигать стабильно высокого цитодеструктивного действия на активно пролиферирующие клетки при минимальном повреждении окружающих здоровых тканей. В литературе имеются сообщения об эффективности ЛИТТ при базально-клеточном раке, саркоме Капоши, при этом подчеркивается, что метод в отличие от хирургического иссечения не инвазивен, по сравнению с химиотерапей не токсичен, а в отличие от лучевой терапии не является ионизирующим излучением и дает лучший косметический эффект [26, 27]. Важно отметить, что данные об исследованиях, посвященных изучению ЛИТТ при АК, в доступной литературе отсутствуют.
Распространенность заболевания, угроза трансформации в злокачественный процесс, осознание пациентом косметической неприемлемости, неблагоприятное влияние на психоэмоциональную сферу и социальную адаптацию обусловливают актуальность данной проблемы и необходимость разработки новых эффективных средств и схем лечения [5, 26, 28, 29].
 Клинический случай
Клинический случай
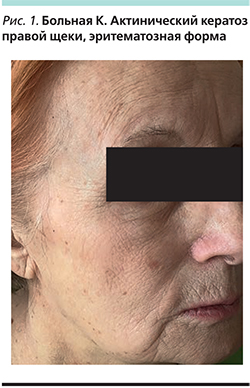
Пациентка К. 1945 г.р., пенсионерка. Поступила в январе 2017 г. в отделение дерматовенерологии и дерматоонкологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского с жалобами на пятно на коже правой щеки. Считает себя больной с июня 2016 г., когда без видимых причин отметила появление красного пятна размером 0,3×0,2 см на коже правой щеки, которое постепенно увеличивалось в размере. В течение жизни в весенне-летний период солнцезащитных средств не использовала. При осмотре: на коже правой щеки бляшка ярко-розового цвета округлой формы с четкими границами и диаметром 0,7×0,6 см, поверхность которой покрыта чешуйками и коркой (рис. 1). Общее состояние удовлетворительное.
Результаты цитологического исследования: изменения в дерме представлены дисплазией кератиноцитов и гиперкератозом.
При УЗИ образования АК выявлено увеличение толщины эпидермиса в виде полосы повышенной эхогенности и гипоэхогенной зоны, занимающей треть дермы, соответствующей солнечному эластозу. На основании жалоб, анамнеза, клинической картины патологического процесса, данных обследования установлен диагноз «актинический кератоз, эритематозная форма».
Больной проведена ЛИТТ, в качестве источника лазерного излучения применяли полупроводниковый лазерный аппарат ЛАМИ (регистрационный номер 29/10020203/5212-03 [20.05.2003], код – ОКП 944420, класс – IIA, длина волны – 1064 нм, мощность излучения на конце световода – 2,5 Вт).
Для подведения света использовался гибкий кварцевый моноволоконный световод диаметром 0,06 см. С целью измерения мощности лазерного излучения на выходе световода применяли дозировщик мощности ДИ-6А. Оценка температурного поля и достигаемой при воздействии лазерного излучения температуры проводилась до начала исследования с помощью ИК-камеры CEDIP.
Предварительно провели внутрикожную инфильтративную анестезию области новообразования 0,5 мл 2%-ным раствором лидокаина. Спустя 5 минут торцевой конец световода подвели к поверхности опухоли на 0,2 см без непосредственного соприкосновения с поверхностью кожи. Воздействие осуществлялось 10 минут. Непосредственно в процессе и сразу после проведения процедуры ЛИТТ в области очага поражения отмечены признаки гиперемии и незначительный отек окружающих тканей. Переносимость лечения была удовлетворительной. Изменения общего состояния не наблюдалось. Через 3 дня на месте деструкции очага визуализировалось незначительное шелушение кожного покрова, субъективные ощущения отсутствовали.
Эффективность ЛИТТ определялась по окончании сеанса терапии, через 24 часа, на 3-и сутки после лечения, а также через 3, 6 и 12 месяцев.
Оценка эффективности лечения проведена по следующим критериям:
- регресс очага – отсутствие видимого и пальпируемого очага с подтверждением отсутствия атипичных клеток цитологическим или гистологическим исследованиями;
- частичный регресс – уменьшение размеров более чем на 50% или видимом отсутствии очага поражения, но при обнаружении атипичных клеток в цитологическом или биопсийном материале;
- отсутствие эффекта – уменьшение размеров очага поражения менее чем на 50%, состояние без изменений и увеличение размеров очага поражения.
При оценке косметического эффекта учитывалось наличие или отсутствие рубца, атрофии, уплотнения кожи, пигментации или гипопигментация, гиперемии.
 Через 3 месяца после лечения на месте ранее существовавшего очага АК сформировался участок застойной гиперемии фиолетово-розового цвета, дерматоскопически в поле зрения визуализировалась псевдосетка с очагами гиперпигментации, ветвящимися структурами, формирующими округлый очаг с четкими границами и «изрезанными» краями, при УЗИ области ранее существовавшего образования в зоне эпидермиса отсутствовала полоса повышенной эхогенности и гипоэхогенная зона в области дермы.
Через 3 месяца после лечения на месте ранее существовавшего очага АК сформировался участок застойной гиперемии фиолетово-розового цвета, дерматоскопически в поле зрения визуализировалась псевдосетка с очагами гиперпигментации, ветвящимися структурами, формирующими округлый очаг с четкими границами и «изрезанными» краями, при УЗИ области ранее существовавшего образования в зоне эпидермиса отсутствовала полоса повышенной эхогенности и гипоэхогенная зона в области дермы.
Через 6 месяцев в области пролеченного очага АК клинически сохранялся участок гиперемии розового цвета. Через 12 месяцев клинически сохранялась незначительная гипопигментация в области ранее существовавшего очага АК (рис. 2). Цитологически отсутствовала дисплазия кератиноцитов и гиперкератоз.
Косметический результат был расценен как хороший (сохранялся участок незначительной гипопигментации).
С целью профилактики появления новых очагов АК пациентке было рекомендовано избегать инсоляции и при выходе на солнце использовать солнцезащитные кремы с максимальным фактором защиты.
Заключение
Распространенность заболевания, угроза трансформации в злокачественный процесс, осознание пациентом косметической неприемлемости, неблагоприятное влияние на психоэмоциональную сферу и социальную адаптацию обусловливают актуальность данной проблемы и необходимость разработки новых эффективных средств и схем лечения.
Считаем, метод ЛИТТ интересным для дальнейшего изучения в отношении лечения АК.


