Введение
Несмотря на разработанные стандарты по ведению пациентов с острым нарушением мозгового кровообращения (ОНМК), врачу-неврологу приходится решать две серьезные клинические задачи. Первая из них – исключение похожих по проявлениям несосудистых заболеваний головного мозга. При этом в отделения для лечения пациентов с ОНМК доставляется примерно 30% пациентов, не имевших инсульта. Вторая – уточнение ведущего фактора риска развития инсульта. В настоящее время известно более 300 факторов риска инсульта, крайне редко ОНМК возникает на фоне только одного фактора: как правило, имеет место комплекс возможных причин его развития. Подобная многофакторность может быть обусловлена как сочетанием разных нозологических форм патологии, встречающихся у конкретного больного, так и наличием системного заболевания, вовлекающего в патологический процесс разные органы и системы. Врачам сосудистых неврологических отделений не следует забывать о системных заболеваниях соединительной ткани, таких как ревматоидный артрит, системная красная волчанка, синдром Шегрена, системная склеродермия (СС).
СС является одной из наиболее редких форм коллагенозов, и как отмечают многие исследователи, при данном заболевании гораздо реже наблюдается первичное поражение центральной нервной системы (ЦНС) [1–4].
В литературе случаи развития инсульта и транзиторных ишемических атак (ТИА) у пациентов с СС, как правило, представлены единичными наблюдениями [1, 3, 5]. Однако при использовании современных методов нейровизуализации частота выявления лиц, перенесших инсульт на фоне СС, достигает 30–43% [6–9]. В любом случае СС не следует исключать из числа возможных причин острой церебральной дисфункции. Приводим собственное клиническое наблюдение пациента с трудностями диагностики СС в доинсультном периоде и при определении факторов риска перенесенного инсульта.
Клинический случай
У пациента К. 66 лет, находившегося на лечении в хирургическом отделении ГВВ № 3 ДЗ г. Москвы по поводу реампутации порочной культи правого бедра, остро развилась очаговая неврологическая симптоматика в виде нарушения речи по типу дизартрии, слабости мимической мускулатуры слева по центральному типу и пареза левой руки. Наличие дизартрии и снижение кровотока по правой позвоночной артерии (данные дуплексного сканирования экстракраниальных магистральных артерий головы) позволили предположить нарушение мозгового кровообращения в вертебрально-базилярной системе. По шкале инсульта Национального института здоровья (NIHSS) определено 8 баллов, что указывало на нетяжелый церебральный сосудистый процесс. Проведенная нейровизуализация (мультиспиральная компьютерная томография) в день развития очаговой симптоматики и через 2 дня после ее возникновения не выявила очагов ишемии. Поскольку наличие симптоматики было замечено после ночного сна и установить точное время ее возникновения было невозможно, тромболитическая терапия не проводилась.
Клиническая диагностика ОНМК у пациента с наличием множественных сосудистых факторов риска инсульта (гипертоническая болезнь, атеросклероз аорты и крупных артерий, хроническая сердечная недостаточность, дилатация полостей сердца, склероз клапанов сердца, хроническая анемия, мелкие кисты в базальных ядрах мозга с двух сторон, перивентрикулярный лейкоареоз, склерозирование сосудов основания мозга) не вызывала сомнений.
Анамнез заболевания
За 2 года до указанных событий у пациента возникли боль и трофические расстройства в правой стопе, в связи с чем он многократно обследовался и лечился в различных стационарах Москвы по поводу окклюзирующего атеросклероза артерий нижних конечностей. Проведена баллонная ангиопластика артерии без значимого эффекта. Через несколько месяцев от дебюта заболевания возникла острая боль в левой кисти, после чего «почернели» 3-й и 5-й пальцы и произошла самоампутация их ногтевых фаланг. При очередной госпитализации была осуществлена ампутация правой ноги на уровне средней трети бедра и ампутация 3-го и 5-го пальцев левой кисти. В тот же период пациент отметил гиперпигментацию и индурацию кожи левой ноги и передней брюшной стенки. Периодически отмечалась субфебрильная температура, наблюдалось практически постоянное ускорение СОЭ до 20–58 мм/ч. Диагноз СС был установлен через год после появления первых сосудистых осложнений лечащим врачом-хирургом Л.И. Бубманом и доцентом кафедры терапии № 2 МГМУ им. И.М. Сеченова С.В. Тополянской в ГВВ № 3 ДЗ г. Москвы. Клинико-анамнестические данные были подтверждены результатами гистологического исследования биопсийного материала кожи и мягких тканей передней брюшной стенки и иммунологического анализа крови (обнаружены антитела к антигену Scl-70).
В препарате мышечно-фасциального лоскута определены фрагменты фиброзно-жировой и мышечной ткани с участками склероза без морфологических признаков воспаления и инфильтрации ткани. В препаратах кожно-жирового лоскута наблюдалось истончение эпидермиса с незначительным акантозом, слабо выраженным гипер- и дискератозом, в базальном слое имело место отложение пигмента. Дерма значительно утолщена, диффузно склерозирована. Придатки кожи единичные в состоянии значительной атрофии, замурованы среди фиброзной ткани. Сосуды единичные в поле зрения, склерозированы, с периваскулярной лимфогистиоцитарной инфильтрацией умеренной степени выраженности. Отмечается наличие распространенных бессосудистых зон в дерме. Подкожно-жировая клетчатка обычного строения. Заключение: с учетом отсутствия инфильтрации в мышечно-фасциальном лоскуте и вышеописанных изменений в дерме следует полагать, что данная морфологическая картина, наиболее вероятно, может соответствовать одной из форм дерматосклероза.
После дополнительных исследований пациенту был выставлен диагноз: системная склеродермия: дерматосклероз, гиперпигментация кожи, микро- и макроангиопатия, трофические язвы, иммунологические нарушения (антинуклеарные антитела к Scl-70). Окклюзия правой поверхностной бедренной артерии. Стеноз артерий левой голени. Окклюзия левой лучевой артерии. Окклюзия дистального сегмента локтевой артерии справа и слева. Осложнения: хронический локтевой бурсит справа и слева, свищевая форма. Трофические язвы левой голени. Порочные культи 3-го и 5-го пальцев левой кисти.
На фоне проведенного курсового инфузионного лечения ангиопротектором алпростадилом (Вазапростан) большая часть трофических язв зарубцевалась. Однако через несколько месяцев вновь наросли трофические расстройства, была произведена резекция средней фаланги 3-го пальца левой кисти, в последующем – ампутация единственной левой ноги. Показанием к ампутации ноги стал интенсивный болевой синдром, не купирующийся анальгетиками, и выявление окклюзии артерий левой голени. В дальнейшем заболевание продолжало прогрессировать, пациент повторно госпитализировался в связи с открытием новых трофических язв на кистях, в области локтевых суставов, на культях бедер с двух сторон, что сопровождалось болями, стойкой бессонницей и пониженным настроением.
За месяц до последней госпитализации сформировалась порочная культя правого бедра, затем на культе правого бедра открылся свищевой ход с мутным отделяемым, появились выраженные боли в области трофических язв. В стационаре прведена операция – реампутация культи правого бедра.
В послеоперационном периоде у пациента развилась дезорганизация психической деятельности: совершал хаотичные движения руками, пытался удалить катетеры, следящую аппаратуру, был дезориентирован в месте и времени, считал, что находится в оздоровительном лагере, говорил, «хочу отсюда уволиться», иногда возникали зрительные галлюцинации, ночами кричал, срывал простыни, белье. Периодически жаловался на боль в области операционной раны, а также на боль по всему телу. На 13-й день после операции появилась очаговая неврологическая симптоматика и пациент был переведен в палату интенсивной терапии сосудистого неврологического отделения.
Течение и исход заболевания после развития у пациента инсульта
Больной долго оставался в сознании, очаговая неврологическая симптоматика не нарастала. Жаловался на непостоянные жгучие боли в культях обеих ног. Периодически отмечался насильственный плач, а также конфабуляции (сообщал, что до поступления в стационар «я снимался в кино», затем этот факт отрицал и вновь возвращался к нему). На 3-й день была диагностирована правосторонняя пневмония. На 6-й день выявлены единичные геморрагические эррозии субкардиального отдела желудка на фоне смешанного гастрита. На 10-й день инсульта в связи с прогрессированием интоксикации, развитием дыхательной недостаточности и угнетением сознания пациент переведен на искусственную вентиляцию легких. Состояние продолжало ухудшаться, для поддержания системной гемодинамики требовалась вазопрессорная поддержка дофамином. Периодически отмечалась гипертермия до 38–39°С. Нарастали анемия и лейкоцитоз со сдвигом влево до метамиелоцитов. Резко возросла активность трансаминаз. Пациент умер на 17-й день после развития инсульта при явлениях интоксикации и полиорганной недостаточности.
В качестве основных клинических диагнозов выставлено два конкурирующих заболевания: 1. Церебро-васкулярная болезнь: инфаркт головного мозга, атеротромботический патогенетический вариант, синдром вертебробазилярной артериальной системы. 2. Системная склеродермия.
Диагнозы были подтверждены результатами патологоанатомического исследования. В подкорковых ядрах головного мозга на фоне единичных мелких полостей до 0,2 см выявлено 2 очага размягчения вещества мозга серого цвета кашицеобразно-дряблой консистенции, диаметром 2 и 1,8 см, расположенных симметрично перивентрикулярно. Отмечено умеренное склерозирование оболочек мозга. Выявлены признаки отека головного мозга (мозг дряблый повышенной влажности, извилины равномерно умеренно уплощены, борозды сглажены). Интима сосудов основания мозга с умеренным количеством липидных, фиброзных, отчасти атероматозных бляшек, стеноз до 20%, площадь поражения до 20%.
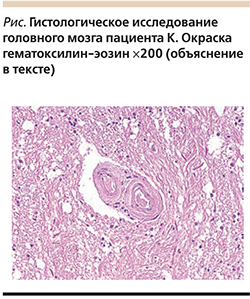 Гистологическое исследование головного мозга: неравномерно выраженный артериолосклероз, мукоидное набухание стенок мелких артерий. Полнокровие, умеренно выраженный глиоз, дистрофические изменения нейронов, умеренно выраженный отек вещества мозга. Очаги ишемического некроза с начальными признаками резорбции (см. рисунок).
Гистологическое исследование головного мозга: неравномерно выраженный артериолосклероз, мукоидное набухание стенок мелких артерий. Полнокровие, умеренно выраженный глиоз, дистрофические изменения нейронов, умеренно выраженный отек вещества мозга. Очаги ишемического некроза с начальными признаками резорбции (см. рисунок).
По заключению патологоанатомов, смерть наступила от сочетания ишемических инфарктов головного мозга и СС, осложнившихся двусторонней субтотальной очагово-сливной пневмонией.
Обсуждение
СС – аутоиммунное мультисистемное заболевание соединительной ткани, проявляющееся ишемией и фиброзом органов и тканей вследствие повреждения мелких сосудов и дисфункции фибробластов. Чаще всего при СС страдают кожа, опорно-двигательный аппарат, из внутренних органов – легкие, сердце, пищеварительный тракт, почки [10–13].
Существует мнение, будто ЦНС при СС поражается редко, возможно, вследствие малой представленности соединительной ткани в мозге и особенностей церебральных сосудов [1, 3]. Однако Ю.В. Каминский и соавт. (2016) установили практически облигатное поражение различных структур головного и спинного мозга при СС, назвав эти изменения склеродермической энцефаломиелопатией. Морфологическое исследование проведено у 12 женщин, страдавших СС [14]. Авторы обнаружили вовлечение в патологический процесс сосудов микроциркуляторного русла (вен, капилляров, артерий) с образованием микротромбов на фоне очагового мукоидного набухания и характерный циркулярный склероз интимы, ведущий к резкому сужению просвета сосуда. Подобные изменения сосудов выявлены при гистологическом исследовании и нашего пациента.
Следует обратить внимание и на другие структурные изменения, описанные в работе [14], также имевшие место в нашем наблюдении. Это изменение оболочек мозга, увеличение глиального индекса, преобладание изменений в сосудистом русле подкорковых узлов.
Приведенные морфологические изменения, а также клинические проявления (депрессия, развитие психоза в послеоперационном периоде, насильственный плач, периодически возникающие конфабуляции) указывали на фоновое поражение ЦНС (энцефалопатию) у нашего пациента. По данным литературы, у страдающих СС депрессия наблюдается с частотой 73,15%, когнитивные нарушения – 8,47% [4]. Таким образом, можно предположить, что при СС мозг уже подготовлен к ишемическому повреждению, и было достаточно воздействия каких-либо дополнительных реализующих факторов для развития сосудистой катастрофы.
В последнее время доказана ассоциация СС с инсультом и ТИА [7–9]. Результаты общенационального когортного исследования на Тайване с участием 1238 больных с СС и 12 380 без этого заболевания (контрольная группа) продемонстрировали статистически значимое повышение риска развития ишемического инсульта (на 43%) среди пациентов с СС (р=0,004), высказано предложение о выделении СС в качестве независимого фактора риска ОНМК [7].
До настоящего времени остаются неясными механизмы развития ОНМК у больных СС. Ряд исследователей считают, что острые церебральные сосудистые нарушения при СС развиваются вторично как следствие артериальной гипертензии на фоне почечной недостаточности [15, 16]. Другие авторы приводят клинические наблюдения развития инсульта без наличия артериальной гипертензии и патологии почек [1, 2]. У нашего пациента клинически диагностирована гипертоническая болезнь, однако высоких цифр артериального давления за время госпитализаций в ГВВ № 3 отмечено не было, не обнаружено подтверждения тяжелой гипертензии и при патологоанатомическом исследовании. Выявленные в нашем наблюдении небольшие зоны инфарктов мозга и лакунарные кисты свидетельствуют о том, что у больного пострадали мелкие сосуды мозга, что характерно не только для гипертонической болезни и сахарного диабета, но и для СС.
Тем не менее, по данным литературы, у пациентов с развитием инсульта на фоне СС поражаются не только малые церебральные сосуды, но и магистральные, а также артерии среднего калибра. По результатам ангио-графического исследования, у них выявлены стенозы М1 и М2 сегментов средней мозговой артерии, сегментарный стеноз верхней мозжечковой артерии и задней мозговой артерии, в также двустороннее стенозирование сонных артерий [1, 2, 5, 9].
Следует отметить, что инсульт при СС в большинстве случаев протекает достаточно легко. Как правило, формируются малые инфаркты мозга или ТИА, которые не приводят к летальному исходу [1, 2, 5, 6, 9, 12]. Интересен отмеченный факт обнаружения у пациентов с СС хорошего коллатерального кровоснабжения, обеспечивающего пострадавшие участки мозга, с перетоком крови из заднего циркуляторного русла в передние отделы, и наоборот [1]. В литературе механизмы развития ТИА у больных СС объясняют как Рейно-подобным вазоспазмом церебральных артерий, так и локализованной аутоиммунной ангиопатией [1, 3, 5].
Тяжесть состояния и прогноз болезни определяет патология внутренних органов. Причиной смерти при СС в большинстве наблюдений служат сердечная недостаточность, аритмии, патологии легких, легочная гипертензия, реже почечная недостаточность [9, 10]. У нашего пациента небольшие очаги церебрального некроза и смерть на 17-й день от момента развития инсульта указывают на то, что летальный исход не мог наступить непосредственно от инфаркта мозга, а причиной смерти стали осложнения – пневмония и полиорганная недостаточность.
Последнее время стали обращать больше внимания на ассоциацию сердечно-сосудистых заболеваний и СС. F. Cannarile et al. [9] отметили высокий риск заболевания периферических сосудов (ЗПС), инсульта и инфаркта миокарда среди пациентов с СС. Частота перечисленных заболеваний у 865 больных СС составила соответственно 7,6; 4,8 и 4,4 на 1000 человеко-лет против 1,9; 2,5 и 2,5 в контрольной группе (8 643 пациента). Характерно значительное преобладание ЗПС у пациентов с СС. Именно ЗПС с выраженными сосудисто-трофическими расстройствами в результате поражения сосудов разного калибра оказались ведущим клиническим проявлением на протяжении двух лет заболевания у нашего пациента.
В литературе обсуждается нарушение восстановления сосудов при СС. Тяжелая тканевая гипоксия, связанная с хроническим снижением кровотока, стимулирует экспрессию сосудистого эндотелиального фактора (VEGF) и аномальный ангиогенез [9]. Кроме того, восстановление кровотока после спазма может запускать у этих пациентов механизмы, приводящие к фиброзу и окклюзии сосудов [9]. Не исключено, что образование порочной культи у нашего пациента было обусловлено указанными механизмами. Вероятно, отмеченным дефектным васкулогенезом можно объяснить ограниченные показания к ампутации нижних конечностей при СС [17]. Основным показанием к ампутации служит отсутствие заживления ран, что имело место у нашего пациента.
Не исключается быстрое прогрессирование атеросклероза при СС, как это показано при других ревматических заболеваниях (ревматоидном артрите, системной красной волчанке) [9, 13, 18]. В подобных случаях можно предполагать формирование «микста» атеросклеротического и склеродермического поражений сосудов. В нашем наблюдении атеросклеротические изменения церебральных сосудов представлены минимально, несмотря на возраст пациента (66 лет). И первоначальное предположение о преимущественно атеротромботическом патогенетическом варианте развития инсульта оказалось неверным.
Предполагается возможность и аутоиммунного характера поражения церебральных сосудов [2, 3, 5, 7, 8], но непосредственные механизмы повреждения сосудов мозга и связь развития инсульта с конкретными аутоантителами не изучены.
К настоящему времени выделены различные специфические и неспе-цифические аутоантитела, подтверждающие аутоиммунный генез СС [19]. Специфические антинуклеарные аутоантитела впервые включены в диагностические критерии СС последнего пересмотра: Квалификационные критерии ACR/EULAR (2013). К их числу относятся аутоантитела к Scl-70, центоромерам, РНК-полимеразе-3 [12, 19]. В нашем наблюдении обнаружены аутоантитела к Scl-70. Их присутствие достоверно чаще указывает на более тяжелую диффузную форму СС, является предиктором легочного фиброза и дигитальных язв, а также свидетельствует о плохом прогнозе и высокой летальности [19].
У нашего пациента имела место быстропрогрессирующая форма СС, при которой летальный исход наступает через 1–2 года после манифестации. К другим неблагоприятным показателям прогноза течения и исхода СС относят дебют заболевания после 45 лет, мужской пол, наличие анемии, высокие показатели СОЭ, обнаружение белка в моче, изменения в легких, аритмию, поражение почек, возникающие в первые 3 года заболевания [20]. Большая часть указанных факторов имела место в представленном наблюдении.
Заключение
После обсуждения представленного наблюдения на общегоспитальной патолого-анатомической конференции (председатель – зав. кафедрой терапии № 2 МГМУ им. И.М. Сеченова, профессор Л.И. Дворецкий) была подтверждена причинно-следственная связь между СС и развившимся мультифокальным инфарктом мозга, пересмотрен патогенетический вариант ишемического инсульта: атеротромботический подтип был заменен на «другой установленной этиологии» по классификации ТОАSТ.
Данное наблюдение еще раз подтверждает, что инсульт не является самостоятельным заболеванием, а представляет собой осложнение, причем не только традиционных факторов риска, но и достаточно редких системных заболеваний, таких как СС.


