Эпидемиология
Острый диссеминированный энцефаломиелит (ОДЭМ) является редким заболеванием. Частота ОДЭМ, по результатам популяционных исследований, составляет 0,3–0,6 на 100 тыс. человек в год [1, 2]. По результатам национальных исследований, заболеваемость ОДЭМ в Калифорнии и Японии составляет 0,4 на 100 тыс. детей в год [3, 4], в Канаде – 0,2 на 100 тыс. в год [5]. Региональные медицинские центры США, Великобритании и Австралии отмечают 3–6 случаев ОДЭМ в год [6–8].
ОДЭМ встречается в любом возрасте. Так, известны случаи заболевания среди пациентов в возрасте старше 80 лет, но чаще ОДЭМ встречается у детей и взрослых до 40 лет. Около 80% детских случаев ОДЭМ приходится на пациентов в возрасте до 10 лет с пиком заболеваемости в 5–8 лет, 20% случаев ОДЭМ наблюдаются у пациентов во втором десятилетии жизни. Заболеваемость в зрелом возрасте составляет менее 3% всех зарегистрированных случаев ОДЭМ [9–13].
Авторы расходятся во мнении о гендерных различиях при ОДЭМ. Ряд исследований указывает на преобладание лиц мужского пола среди больных ОДЭМ, указывая соотношение М:Ж как 1,3:2,3 [9, 12, 13]. Другие авторы регистрируют одинаковую заболеваемость среди лиц мужского и женского полов [5, 11].
Специфического этнического распределения при ОДЭМ нет [3].
При ОДЭМ отмечено сезонное распределение, причем большинство случаев ОДЭМ приходится на зиму и весну [6, 14, 15], что, вероятно, обусловлено частотой встречаемости инфекций верхних дыхательных путей в холодное время года [9, 10, 14, 15].
История изучения
Впервые клиническую картину заболевания описал J. Lucas в ХVIII столетии. В тот период ОДЭМ был ассоциирован с корью, натуральной и ветряной оспой и сопровождался высокой смертностью. Клиническое и патологоанатомическое описание постинфекционного ОДЭМ послужило пусковым механизмом для создания первых экспериментальных моделей воспалительной демиелинизации на животных в 1920–1930 гг. Обезьяны иннокулировались экстрактом мозга, и у них развивались атаксия и слабость.
Гистологически в поврежденных тканях отмечали периваскулярное воспаление и демиелинизацию, таким образом сходство экспериментального аллергического энцефаломиелита (ЭАЭ) и постинфекционного ОДЭМ было очевидным [16].
В 1931 г. в журнале D. Lancet McAlpine описал три варианта ОДЭМ: постинфекционный, поствакцинальный и спорадический. Постинфекционный ОДЭМ связан с предшествовавшей или сопутствующей вирусной или бактериальной инфекциями, обычно в виде неспе-цифической инфекции верхних дыхательных путей. Предшествовавшая инфекция отмечена у 72–77% пациентов [6, 7, 19]. Вирусы, которые были вовлечены, включают коронавирус (coronavirus), коксаки (coxsackie), цитомегаловирус (cytomegalovirus), вирус Эпштейна–Барр (Epstein–Barr), вирус простого герпеса (herpes simplex), гепатита А (hepatitis A), ВИЧ (HIV), гриппа (influenza), кори (measles), краснухи (rubella), опоясывающего лишая (varicella zoster) и Западного Нила (West Nile virus) [20, 22–29]. Другие организмы, ассоциированные с ОДЭМ: боррелия (Borrelia burgdorferi), хламидия (Chlamydia), лептоспира (Leptospira), микоплазма пневмонии (Mycoplasma pneumoniae), риккетсии (Rickettsia) и β-гемолитический стрептококк (β-hemolytic streptococcus) [20, 30]. До разработки программ иммунизации ОДЭМ чаще был связан с корью (1:1000 случаев заболевания), ветряной оспой (1:1000 – 1:10 000) и краснухой (1:20 000) [9, 11, 14–16]. В настоящее время ОДЭМ чаще ассоциирован с вирусными инфекциями дыхательных путей и желудочно-кишечного тракта [9]. Неспецифические или неидентифицированные вирусные инфекции могут также предшествовать ОДЭМ.
В зависимости от предшествовавшего заболевания существует несколько вариантов фенотипа ОДЭМ: ОДЭМ, связанный с корью, чаще имеет тяжелое клиническое течение, в то время как ОДЭМ, обусловленный ветряной оспой, имеет хороший прогноз. Уникальный фенотип ОДЭМ у детей был представлен при гемолитической стрептококковой инфекции группы АB [31]. У 10 детей в возрасте от 3 до 14 лет развились типичные клинические проявления ОДЭМ, но с выраженными признаками экстрапирамидного синдрома (70%) и нарушением поведения и речи (50%). ОДЭМ, как правило, возникал вслед за острым фарингитом, клинически отличался от ревматической хореи и в сыворотке крови больных наблюдалось повышение уровня антител к базальным ядрам.
Поствакцинальный ОДЭМ составляет менее 5% всех случаев ОДЭМ. Дебютирует как у взрослых, так и у детей через 2–30 дней (в среднем 8–21 день) после иммунизации [9, 12]. The Collaborating Center for Reference and Research on Viral Hepatitis of the World Health Organization предлагает максимальный период до трех месяцев для диагностики вакцин-ассоциированного ОДЭМ [32].
Поствакцинальный ОДЭМ ассоциирован с иммунизацией против бешенства, гепатита B, гриппа, японского энцефалита, дифтерии/коклюша/столбняка, кори, паротита, краснухи, пневмококка, полиомиелита, натуральной и ветряной оспы, вируса папилломы человека [9, 11, 12, 30]. P. Pellegrino et al. провели анализ 441 случая поствакцинального ОДЭМ [12]. Распределение по причинному фактору поствакцинального ОДЭМ в разных возрастных группах представлено следующим образом: у детей грудного и раннего детского возраста (до 5 лет) – прививки от кори, эпидемического паротита, краснухи, гриппа (13% всех случаев), затем следуют пневмококковая конъюгированная вакцина (11%) и АКДС (9%); в возрасте 6–17 лет – вакцины против вируса папилломы человека и менингококка (21–26%); в группе пациентов старше 18 лет – вакцина против сезонного гриппа (32% случаев поствакцинального ОДЭМ).
Имеется сообщение о развитии ОДЭМ после экспериментального лечения болезни Альцгеймера вакциной, содержащей синтетические фрагменты белка – предшественника амилоида [13]. Также известны случаи развития ОДЭМ после укусов насекомых, трансплантации почки, травмы [13, 33]. Описан случай ОДЭМ в виде ограниченного мезодиэнцефального поражения [34].
Важно отметить, что увеличение числа вакцинаций не сопровождается соответствующим увеличением числа ОДЭМ. Более того, необходимо признать существенную разницу между вакцин-ассоциированной ОДЭМ, при иммунизации живой вакциной кори (1–2 случая на 1 млн) и заболеваемостью ОДЭМ, ассоциированной непосредственно с вирусом кори (1 из 1000) [35]. Введение вакцинации заметно сократило распространенность кори в развитых странах, хотя ОДЭМ, ассоциированный с вакциной, описывается в 2 случаях на 1 млн.
Патогенез
Патогенез ОДЭМ до конца непонятен. Однако ОДЭМ представляется аутоиммунным заболеванием центральной нервной системы (ЦНС), которое провоцируется внешними стимулами у генетически предрасположенных индивидуумов.
Начальные события цепи патогенеза разворачиваются не в ЦНС, а на периферии, где происходит специфическое распознавание внешних антигенов (вирусов) Т/В-лимфоцитами и дифференциация в эффекторные Т- и В-клетки [36]. В результате активации Т-лимфоциты становятся способными «защищать» организм не только от чужеродных, но и от собственных антигенов, т.е. становятся аутоагрессивными. Необходимым условием для развития аутоиммунного повреждения служит активация на периферии анергичных аутореактивных Т-клеток.
Предложено несколько специфических механизмов первичной активации реактивных Т-клеток: молекулярная мимикрия, двойная экспрессия Т-клеточного рецептора, участие суперантигенов. В основе гипотезы молекулярной мимикрии находится предположение о тесной гомологии белковых последовательностей различных эпитопов аутоантигенов (ААГ) с вирусными и бактериальными антигенами: многие вирусные агенты имеют короткие аминокислотные последовательности, аналогичные ААГ. В результате после «предоставления» их на поверхности моноцитов распознаются Т-клеточным рецептором как «свои» [37, 38].
Общие антигенные детерминаты обнаружены у вируса кори, краснухи, вируса Эпштейна–Барр, герпеса, цитомегаловируса и ААГ миелина, такими как основной белок миелина (ОБМ), протеолипидный белок миелина и миелин олигодендроцитарный белок [30]. Например, вирус Эпштейна–Барр содержит пентапептидную последовательность в своем ядерном антигене (EBNA), которая гомологична с эпитопом ОБМ, главным белком миелиновой оболочки [39]. Антивирусные антитела или клеточно-опосредованный ответ на патоген перекрестно реагирует на ААГ миелина, что приводит к развитию воспаления. Данный механизм также подтверждается исследованием лимфоцитов у детей с ОДЭМ. В одном исследовании частота Т-клеточных линий, реагирующих на ОБМ, была повышена в 10 раз у пациентов с ОДЭМ по сравнению с пациентами с энцефалитами и здоровыми добровольцами из контрольной группы [21].
Воспалительный процесс запускается после того, как предполагаемый ААГ, например ОБМ, презентируется лимфоциту макрофагом или другой антиген – презентирующей клеткой. Активированные Т-клетки мигрируют в ЦНС через посткапиллярные венулы в периваскулярное пространство. В пространстве Вирхова–Робина Т-клетки вновь сталкиваются со своим родственным антигеном в контексте молекул человеческого лейкоцитарного антигена II класса (HLA), экспрессированных дендритными клетками [41]. Эта реактивация позволяет Т-клеткам мигрировать через пограничную глиальную мембрану и проникать в паренхиму мозга. Проникнув в ЦНС, Т-клетки, уже активированные по отношению к ААГ, взаимодействуют с антиген-презентирующей клеткой. ААГ в ЦНС являются белки миелина: ОБМ, протеолипидного белка, миелин-олигодендроцитарного гликопротеида (МОГ). Вид антигена определяет и топографию поражения. Антигены, представленные в компактном миелине – ОБМ и ПЛБ, вызывают повреждение в зонах с самыми плотными миелиновыми оболочками (спинной мозг и ствол мозга). Напротив, МОГ связан с повреждением проводников с тонкой миелиновой оболочкой, расположенных перивентрикулярно и в белом веществе мозжечка.
Таким образом, основной гипотезой иммунопатогенеза аутоиммунной воспалительной демиелинизации является положение об активном проникновении через гематоэнцефалический барьер в ткань мозга Т-лимфоцитов, сенсибилизированных к антигенам миелина. Т-лимфоциты под действием ряда факторов активируются, пролифирируют и «запускают» эффекторные реакции, повреждающие миелин и аксоны. Молекулы адгезии, хемокины, матриксная металлопротеиназа и другие клеточные факторы играют важную роль в возникновении и развитии заболевания. Уровни интерлейкина-1β (ИЛ-1β), -2, -4, -5, -6, -8, -10, интерферона-γ (ИФН-γ), фактора некроза опухоли α (ФНО-α) и макрофагального воспалительного белка-1β значительно повышены в цереброспинальной жидкости (ЦСЖ) у больных ОДЭМ. Содержание гранулоцитарного колониестимулирующего фактора повышается в ЦСЖ в 38 раз. Повышение уровней ИФН-γ, ИЛ-6 и -8 достоверно коррелирует с цитозом и концентрацией белка в ЦСЖ у больных ОДЭМ [10].
В настоящее время допускается, что первичная системная активация Т-клеток монофазна и уменьшается при исчезновении провоцирующих факторов, например инфекции. Во время фазы уменьшения клинической и МРТ (магнитно-резонансная томография) активности возрастает системная продукция противовоспалительных цитокинов, таких как трансформирующий ростовой фактор-β (TGF-β) и ИЛ-10. Большое значение имеют также и местные факторы, ограничивающие повреждение, такие как элиминация аутореактивных Т-клеток или их апоптоз. Кроме того, один и тот же фактор в зависимости от стадии заболевания может играть двойную роль – про- и противовоспалительную. Так, одни и те же клетки, первоначально продуцирующие провоспалительные сигналы, позднее могут продуцировать противовоспалительные факторы. В исследованиях in vitro показана способность аутореактивных СD4+ Т-клеток и В-клеток продуцировать нейротрофичеcкие факторы. Процесс ремиелинизации начинается с активации и пролиферации астроцитов.
Клинический исход при ОДЭМ, подтвержденный нейровизуализацией, чаще всего демонстрирует полное выздоровление. Вместе с тем могут быть тонкие различия между восстановленным и неповрежденным миелином по толщине миелина, перераспределении каналов натрия, миелиновых пептидов, что создает уязвимость для повторного повреждения [42]. Возможно, этим объясняется наличие мультифазного ОДЭМ.
Гистопатологические проявления при ОДЭМ включают периваскулярную демиелинизацию и воспаление с обилием лимфоцитов и макрофагов.
Клинические особенности ОДЭМ
Диагноз определенного вирусного заболевания или проведение вакцинации чаще устанавливается в пределах 1-го месяца, предшествующего появлению неврологических симптомов. Заболевание с повышением температуры тела встречается у 50–75% детей за 4 недели до появления типичных неврологических симптомов [32]. Неврологические симптомы обычно появляются через 4–13 дней после инфицирования или вакцинации [6, 7, 19].
Начальные симптомы ОДЭМ часто включают лихорадку, рвоту, головную боль и вялость и могут сохраняться в период госпитализации [7, 43]. Начало заболевания острое с прогрессированием в течение нескольких часов до пика в днях. Прогрессирование неврологических симптомов наблюдается в течение 4–7 дней [6, 19]. Характерной особенностью является энцефалопатия, которая обычно развивается быстро в сочетании с многоочаговым неврологическим дефицитом [7]. Энцефалопатия проявляется изменением поведения: раздражительностью (иногда у подростков отмечается психоз), спутанностью сознания; угнетение сознания может варьироваться от вялости, сонливости до глубокой комы [44].
Эпилептические приступы встречаются только у трети пациентов [19]. Менингеальные симптомы нехарактерны для ОДЭМ, но если выявляются, то при постинфекционном ОДЭМ чаще, чем при поствакцинальном. Выраженность неврологических симптомов зависит от места повреждения в ЦНС и, как правило, представлено симптомами поражения пирамидного тракта (монопарез, гемипарез), ствола головного мозга (альтернирующие синдромы), черепных нервов (невропатии, в т.ч и двусторонний оптический неврит), мозжечка (атаксией). Афазия и сенсорные нарушения встречаются редко.
Симптомы поперечного миелита проявляются пара-, тетрапарезом с четким уровнем нарушения чувствительности при неврологическом осмотре. Верхние конечности могут быть вовлечены в процесс при демиелинизации на шейном уровне спинного мозга. Дыхательная недостаточность может наблюдаться при высоком цервикальном повреждении с распространением отека и воспаления в ствол головного мозга. Дисфункция кишечника и мочевого пузыря приводит к запорам и задержке мочи. Миелит как проявление ОДЭМ встречается только в четверти всех случаев ОДЭМ.
Острая фаза ОДЭМ обычно длится 2–4 недели. Больные обычно полностью выздоравливают, хотя некоторые имеют неврологические осложнения [6,7,19].
Острый геморрагический лейкоэнцефалит служит сверхострым вариантом ОДЭМ и может проявляться как:
- острый геморрагический лейкоэнцефалит (ОГЛ);
- острый геморрагический энцефаломиелит (ОГЭМ);
- острый некротизирующий геморрагический лейкоэнцефалит (ОНГЛ) Weston Hurs.
Эти геморрагические варианты по течению более острые и тяжелые, чем типичный ОДЭМ. Их симптоматика подобна ОДЭМ: менингизм, головная боль, судороги, многоочаговые неврологические симптомы, асимметричный неврологический дефицит и кома. Обычно им предшествует инфекция верхних дыхательных путей.
На МРТ головного мозга выявляется диффузные поражения белого вещества, часто крупные с отеком головного мозга [45–47]. Поражение белого вещества может быть обнаружено на МРТ в течение 72 часов после появления первых симптомов, но кровоизлияние можно не увидеть на Т2 и Т2 FLAIR режимах.
В ЦСЖ обычно обнаруживают увеличение числа нейтрофилов, эритроцитов и уровня белка. Некоторые пациенты при своевременной терапии выздоравливают, но прогноз по выживаемости и восстановлению неврологических функций при ОГЛ хуже, чем при ОДЭМ.
 Диагностика ОДЭМ
Диагностика ОДЭМ
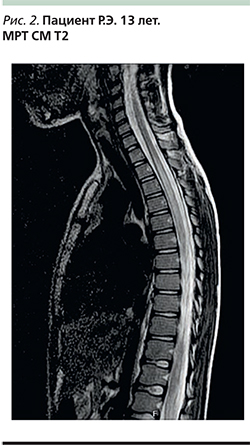
Нейровизуализация. Наиболее достоверным методом и «золотым» стандартом диагностики ОДЭМ является МРТ головного и спинного мозга. МРТ повреждения лучше всего определяются на Т2-ВИ и T2-FLAIR-режиме (рис. 1). На МРТ головного мозга выявляется многоочаговое поражение: очаги в церебральном и церебеллярном белом веществе, иногда в базальных ганглиях. Перивентрикулярные поражения и вовлечение corpus collosum являются редкостью при ОДЭМ по сравнению с рассеянным склерозом. Число очагов широко варьируется у пациентов с ОДЭМ. Например, S.N. Murthy et al. выявили от 4 до 56 очагов на исходной МРТ головного мозга у пациентов с ОДЭМ [8]. Поражения при ОДЭМ часто большие, хотя мелкие очаги диаметром <5 мм [6, 8, 19] также могут обнаруживаться. Иногда имеются крупные сливные очаги с перифокальным отеком, вызывающие масс-эффект – смещение окружающих структур. В крупных воспалительных участках могут отмечаться кровоизлияния (характерно для геморрагических форм). Поражения обычно двусторонние, асимметричные и, как правило, слабоокаймленные. Гипоинтенсивные очаги на Т1-ВИ (т.е. черные дыры) не характерны для ОДЭМ [48, 49]. Серое вещество иногда поражается сочетанно с белым, особенно у детей [19, 50, 51], при этом наиболее часто повреждаются таламус и базальные ганглии и, как правило, симметрично. Поражение ствола мозга и спинного мозга на МРТ характерно для ОДЭМ. В спинном мозге типичны крупные сливные интрамедуллярные поражения, распространяющиеся на несколько сегментов (рис. 2). МРТ с контрастным усилением выявляет гомогенное накопление контрастного препарата в очагах поражения. Через несколько недель можно отметить уменьшение числа очагов в головном или спинном мозге и отсутствие новых очагов. Исчезновение или уменьшение очагов в головном или спинном мозге, по данным МРТ, через 6 месяцев после дебюта заболевания говорит в пользу подтверждения диагноза ОДЭМ. Однако, несмотря на нормализацию МРТ-картины, рекомендуется в течение 5 лет периодически проводить детям МРТ-контроль [52].
 Лабораторные исследования. Изменения в ЦСЖ выявляются у 50–80% пациентов с ОДЭМ: лимфоцитарный плеоцитоз до 1000/мм3, небольшое повышение уровня белка (≤70 мг/дл). Олигоклональные полосы иммуноглобулина G (IgG) могут выявляться у 7–10% больных, но не являются специфичным маркером для ОДЭМ, они чаще обнаруживаются при рассеянном склерозе, также могут выявляться при хронических инфекциях ЦНС и невропатиях. В некоторых случаях ЦСЖ также может быть без изменений (нормальной).
Лабораторные исследования. Изменения в ЦСЖ выявляются у 50–80% пациентов с ОДЭМ: лимфоцитарный плеоцитоз до 1000/мм3, небольшое повышение уровня белка (≤70 мг/дл). Олигоклональные полосы иммуноглобулина G (IgG) могут выявляться у 7–10% больных, но не являются специфичным маркером для ОДЭМ, они чаще обнаруживаются при рассеянном склерозе, также могут выявляться при хронических инфекциях ЦНС и невропатиях. В некоторых случаях ЦСЖ также может быть без изменений (нормальной).
У многих детей выявляются неспе-цифические признаки воспаления в анализе крови: лейкоцитоз – у 2/3 пациентов, ускоренное СОЭ, повышение уровня С-реактивного белка.
На электроэнцефалограмме может отмечаться фоновая медленно-волновая биоэлектрическая активность, характерная для энцефалопатий.
Диагноз ОДЭМ основывается на клинико-рентгенологических особенностях. Не существует специфического биологического маркера или подтверждающего теста. Диагноз следует заподозрить у ребенка, у которого развиваются многоочаговые неврологические нарушения с энцефалопатией (например, спутанность сознания, чрезмерная раздражительность), особенно в тех случаях, когда неврологические симптомы появляются через одну-две недели после вирусной инфекции или вакцинации. В отсутствие специфических диагностических тестов ОДЭМ рассматривается как диагноз исключения. Заболевания, которые мимикрируют ОДЭМ, особенно те, которые требуют другого лечения, должны быть исключены. Что касается детей, то в первую очередь необходимо исключить нейроинфекцию (бактериальные и вирусные менингиты, энцефалиты).
У 40% детей с ОДЭМ в сыворотке крови выявляются аутоантитела (ААТ) – сывороточные IgG-АТ к миелин-олигодендроцитарному гликопротеину (анти-MOГ-АТ) [10]. Хотя анти-MOГ-АТ, скорее всего, неспецифичны для ОДЭМ, тем не менее некоторые авторы связывают их обнаружение с течением заболевания. У пациентов с анти-МОГ-АТ чаще встречаются крупные, двусторонние и широко распространенные поражения и продольный обширный поперечный миелит, по данным МРТ, вместе с тем отмечен также более благоприятный исход по сравнению с пациентами с отрицательным анти-MOГ АТ. Однако у пациентов с неизменно высоким титром анти-MOГ-АТ наблюдались рецидивы ОДЭМ [10, 53]. Таким образом, оценка титров анти-MOГ-АТ у пациентов с ОДЭМ может быть полезной для прогнозирования исхода заболевания. Для пациентов с обнаруженными титрами анти-MOГ-АТ повторное тестирование должно проводиться каждые 6 месяцев в течение не менее одного года. Уровень анти MOГ-АТ у пациентов с монофазным ОДЭМ уменьшался или становился отрицательным в течение нескольких месяцев–лет. Однако у пациентов с неизменно высоким титром анти-MOG-АТ велик риск рецидива ОДЭМ.
МРТ головного и спинного мозга имеет большое значение в постановке диагноза ОДЭМ. МРТ в динамике иногда необходима для подтверждения диагноза ОДЭМ, т.к. развитие рецидивов с новыми поражениями на МРТ несовместимо с диагнозом монофазной ОДЭМ, и предполагает, что правильным диагнозом является либо мультифазная ОДЭМ, либо рассеянный склероз в зависимости от клинико-нейровизуализационных особенностей [7].
Диагностические критерии ОДЭМ у детей были предложены Меж-дународной исследовательской группой по рассеянному склерозу у детей (IPMSSG) в 2007 г. и обновлены в 2012 г. [54, 55].
Основные критерии:
- Первый эпизод многоочагового поражения ЦНС, предположительно воспалительной демиелинизации.
- Энцефалопатия в отсутствие других объективных причин (лихорадка, системное воспаление или постиктальное состояние).
- Изменения на МРТ в острой стадии заболевания.
- Отсутствие новых клинических и МРТ-признаков в течение ≥3 месяцев от дебюта.
- Типичные изменения на МРТ головного мозга:
- большие (≥1–2 см) повреждения с нечеткими границами, затрагивающие преимущественно белое вещество головного мозга;
- отсутствие на Т1 гипоинтенсивных повреждений;
- допустимы поражения глубокого серого вещества.
Монофазный ОДЭМ. Клинические симптомы ОДЭМ обычно следуют за инфекционным заболеванием, хотя они могут колебаться по тяжести и развиваться в первые 3 месяца после начала заболевания [55]. Любые новые и флуктуирующие симптомы, возникающие в течение 3 месяцев после первого демиелинизирующего события, считаются частью одного и того же воспаления.
Мультифазный ОДЭМ. Мульти-фазный ОДЭМ определяется как два эпизода, соответствующих ОДЭМ с интервалом в 3 месяца, независимо от лечения глюкокортикостероидами (ГКС), но не сопровождающихся какими-либо дальнейшими событиями [55]. Второе событие ОДЭМ может включать или новый, или повторное появление предшествующих неврологических симптомов и результатов МРТ. По определению, как первое, так и второе событие должно включать клиническую картину энцефалопатии.
Рецидивы после второго обострения уже не согласуются с ОДЭМ и указывают на хроническое заболевание, такое как рассеянный склероз (РС) или заболевание спектра оптиконейромиелита (NMOSD – Neuromyelitis optica spectrum disorder) [55]. Первоначальный демиелинизирующий ОДЭМ-подобный эпизод считается первым обострением хронического заболевания.
Второе обострение, отмеченное через 3 или более месяцев после первого эпизода и при котором не наблюдается энцефалопатии, может рассматриваться как обострение РС, если результаты МРТ соответствуют радиологическим критериям диссеминации в пространстве или оптиконейромиелиту, если соответствует критериям NMOSD.
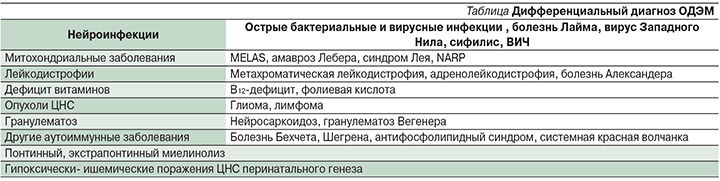
Дифференциальный диагноз
Спектр дифференциального диагноза достаточно широкий и будет предметом другой статьи (см. таблицу).
В первую очередь у ребенка с инфекционным, общемозговым и очаговым синдромами необходимо исключить нейроинфекцию (вирусный или бактериальный менингит, энцефалит).
В отсутствие данных за нейроинфекцию дифференцировать необходимо с другими сходными демиелинизирующими заболеваниями:
- РС;
- неврит зрительного нерва;
- поперечный миелит;
- заболевания спектра оптиконейромиелита (NMOSD);
- другие редкие состояния.
Лечение
Иммунотерапия является стандартом терапии ОДЭМ. Внутривенное введение высоких доз ГКС является базисной терапией [56, 57]. ГКС могут быть назначены в период начальных проявлений заболевания и одновременно с антибиотиками и ацикловиром до исключения инфекционной этиологии болезни. Дополнительные варианты лечения включают внутривенный иммуноглобулин (ВВИГ) и плазмаферез (ПФ) [20]. Однако эффективность этих методов лечения (ГКС, ВВИГ и ПФ) для ОДЭМ окончательно не доказана, т.к. не проводилось проспективных клинических исследований для определения оптимального лечения, включая дозу препарата и длительность терапии.
Применение ГКС изучено в нескольких обсервационных исследованиях: лечение ОДЭМ внутривенным введением метилпреднизолона (МП) (10–30 мг/кг/сут, максимальная доза –1000 мг/сут) или дексаметазона (ДМ) (1 мг/кг/сут) в течение 3–5 дней, затем пероральный прием ГКС в течение 4–6 недель, привело к полному выздоровлению 60–90% пациентов [6, 7, 19]. При сравнении этих методов лечения внутривенное введение МП (n=21) ассоциировано с лучшим исходом (по Расширенной шкале инвалидизации), чем внутривенное введение ДМ (n=25), разница статистически значима [19]. К сожалению, данное исследование ограничено небольшим числом пациентов, отсутствием рандомизации и слепого лечения.
Также нет убедительного доказательства эффективности перорального приема ГКС после внутривенной пульс терапии МП. В двух небольших наблюдательных исследованиях сообщается о более высокой частоте рецидивов у детей с ОДЭМ, получавших лечение более коротким курсом (3 недели или менее) по сравнению с более длительным лечением [6, 58].
Исходя из нашего опыта и рекомендаций других исследователей, иммуносупрессивную терапию ОДЭМ детям необходимо проводить внутривенным введением ГКС в высоких дозах в качестве начальной терапии. МП – 30 мг/кг/сут (максимальная суточная доза 1000 мг) в течение пяти дней. Детям с сохраняющимися неврологическими симптомами после завершения внутривенного МП можно назначать ГКС перорально (преднизолон из расчета 1 мг/кг/сут, но не более 60 мг/сут), при улучшении состояния постепенное снижение дозы (по 2,5–5 мг через день) общая продолжительность лечения должна составлять 6–8 недель. Некоторым пациентам (склонным к флюктуации неврологических симптомов) можно сохранить поддерживающую терапию низкими дозами преднизолона перорально более длительно или проводить ежемесячные внутривенные иммуноглобулины (ВВИГ), что для детей более предпочтительно.
ВВИГ необходим в качестве неотложной терапии пациентов с ОДЭМ, которые не реагируют на внутривенное введение МП [59–61] или в качестве начальной терапии ОДЭМ [11]. Доза ВВИГ должна быть высокой (2 г/кг массы тела на курс), курсовая доза вводится в течение 3–5 дней [59–62]. ПФ показан детям с ОДЭМ, не получавшм лечения ВВИГ и/или МП [63–66] или рефрактерных к МП и ВВИГ [66], а также пациентам с ОДЭМ в сочетании с миелопатией [67]. Предпочтительный режим – 6 обменов через день, состоящий от 1 до 1,5 объемов плазмы.
Лечение острого геморрагического лейкоэнцефалита. Как отмечено выше, прогноз по выживаемости и восстановлению неврологической функции хуже для гиперострых вариантов ОДЭМ, таких как острый геморрагический лейкоэнцефалит (ОГЛ), чем для типичных ОДЭМ. В некоторых публикациях сообщается о благоприятном исходе при рано начатом лечении большими дозами ГКС у детей [19, 68] и у взрослых [69] с сверхострым геморрагическим вариантом ОДЭМ. В другом клиническом случае у взрослого пациента с ОГЛ пролонгированная комбинированная иммуносупрессивная терапия (ГКС, циклофосфамид) и ПФ имели хороший эффект и отмечен благоприятный исход с полным восстановлением нарушенных функций [17].
Прогноз
Современные исследования ОДЭМ у детей показывают невысокую смертность или ее отсутствие, более ранние исследования свидетельствовали, что смертность от постинфекционных ОДЭМ достигала 5% [32]. Большинство детей с ОДЭМ полностью выздоравливают в течение 4–6 недель. Степень восстановления не зависит от тяжести заболевания. Полное восстановление может наблюдаться даже у детей с амаврозом, тетрапарезом, находившихся в коме. В катамнезе (через 3–5 лет от момента заболевания) 60–90% детей, переболевших ОДЭМ, имеют минимальный неврологический дефицит или нормальный неврологический статус [6–8, 18–19, 40]. Долгосрочный риск для развития РС составляет 25%.


