Введение
Согласно современным воззрениям, функциональные нарушения занимают лидирующее положение в структуре заболеваний органов пищеварения у детей раннего возраста, составляя, по разным данным, 90–95% от их общего числа.
Функциональными заболеваниями (или нарушениями) принято считать ситуации, когда в ходе обследования не удается обнаружить анатомических, морфологических, метаболических или иных нарушений, которые могли бы объяснить имеющиеся у ребенка симптомы.
Согласно уже ставшему классическим определению D.A. Drossman (1994), «функциональные нарушения желучочно-кишечного тракта (ЖКТ) – это разнообразная комбинация гастроинтестинальных симптомов без структурных и биохимических нарушений».
Некоторые авторы считают это определение несколько устаревшим, поскольку по мере развития медицинской науки появляются новые методы исследования, позволяющие выявлять воспалительные и прочие изменения в органах и системах на более тонком уровне. В частности, у некоторых пациентов с функциональной диспепсией находят инфекцию Helicobacter pylori, у больных с синдромом раздраженного кишечника (СРК) – микропризнаки колита по данным гистологического исследования.
Признавая право на существование этой точки зрения, мы, тем не менее, хотели бы предложить ориентироваться на классическое определение, по крайней мере до того времени, когда гистологические, генетические и молекулярные исследования прочно войдут в повседневную клиническую практику.
Причины функциональных нарушений – это расстройства регуляции органа, обусловленные «внеорганными» (психоэмоциональными, стрессорными, эндокринными и др.) факторами [1, 2].
Симптомы функциональных нарушений ЖКТ развиваются из-за комбинации нескольких известных физиологических детерминант:
- нарушение моторики;
- висцеральная гиперчувствительность;
- изменение мукозального иммунитета и воспалительного потенциала, включая изменения в бактериальной флоре, а также изменения регулирования оси ЦНС–ЭНС (энтеральная нервная система), находящейся под влиянием психологических и социокультурных факторов [2].
В Римских критериях-IV, предложенных Комитетом по изучению функциональных расстройств у детей и Международной рабочей группой по разработке критериев функциональных расстройств в 2016 г., функциональные расстройства кишечника разделяют на две группы в зависимости от возраста [3].
G. Функциональные расстройства у новорожденных и детей раннего возраста (0–3 года):
- G4. Младенческая колика.
- G5. Функциональная диарея.
- G6. Младенческая дисхезия.
- G7. Функциональный запор.
Н. Функциональные расстройства у детей и подростков (4–18 лет):
- H2b. Синдром раздраженного кишечника.
- H3а. Функциональный запор.
Как видно из представленных данных, диагноз СРК неправомочен для детей до 4 лет.
СРК представляет собой функциональное расстройство кишечника, при котором боль или неприятные ощущения (дискомфорт) в животе связаны с дефекацией, изменениями частоты и характера стула или другими признаками нарушения опорожнения кишечника [3].
Синонимы СРК: спастический колит, невроз толстой кишки, спастический запор, спастическая толстая кишка, слизистая колика, нервная диарея, функциональная колопатия и др.
Эпидемиология
Частота выявления СРК у взрослых находится в диапазоне от 9 до 48% (в среднем 20%) в зависимости от географического положения, социально-экономических условий, характера питания и др.
Частота выявления СРК у детей составляет 0,2%, по данным первичного амбулаторного звена, и 22–45%, по данным специализированных стационарных отделений в странах Западной Европы. По другим данным, распространенность СРК находится в диапазоне от 6 до 14% у детей и 22–35,5 % у подростков [2, 4, 5].
Римские критерии-IV приводят данные по частоте СРК в общей детской популяции в диапазоне от 1,2 до 2,9% в США и от 4,9 до 5,4% в Колумбии и Шри-Ланке [3].
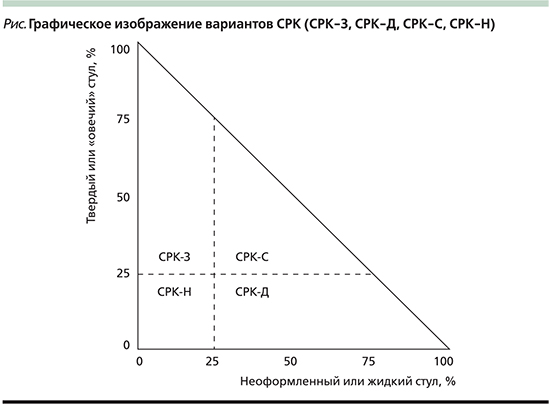
Классификация СРК (F.Weber, R. McCallum, 1992):
- СРК, протекающий с преобладанием диареи;
- СРК, протекающий с преобладанием запоров;
- СРК, протекающий преимущественно с болями в животе и метеоризмом.
В последние годы эта классификация претерпела некоторые изменения и в современной редакции выглядит следующим образом:
- СРК, протекающий с преобладанием диареи (СРК-Д);
- СРК, протекающий с преобладанием запоров (СРК-З);
- СРК смешанного типа (СРК-С);
- СРК неспецифический (СРК-Н).
Приведенный выше рисунок иллюстрирует эти положения.
Коды по Международной классификации болезней 10-го пересмотра (МКБ-10):
- К 58. СРК.
- К 58.0. СРК с диареей.
- К 58.9. СРК без диареи.
- К 59.0. Запор.
- К 59.1. Функциональная диарея.
- К 59.2. Неврогенная возбудимость кишечника, не классифицируемая в других рубриках.
- К 59.8. Другие уточненные функциональные нарушения кишечника.
- К 59.9. Функциональные нарушения кишечника неуточненные.
СРК – биопсихосоциальная функциональная патология
Фундамент СРК как биопсихосоциального расстройства составляют два основных патологических механизма – психосоциальное воздействие и сенсорно-моторная дисфункция кишечника, т.е. нарушения висцеральной чувствительности и двигательной активности кишечника [3, 6, 7].
Биопсихосоциальная модель болезни основывается на сложном взаимодействии генетических, экологических, физиологических и психологических факторов и их влияния на симптомы и болезни. Это служит краеугольным камнем для понимания этиологии СРК [8].
Генетические факторы в развитии СРК основаны на выявлении симптомов и диагностике кластеров внутри семей и близнецов. В частности, известно, что у детей, мать которых страдает СРК, в большинстве случаев также развивается СРК [9, 10]. Специфические гены, которые могут быть ответственны за предрасположенность к развитию СРК, неизвестны, но гены, кодирующие выработку серотонина, белков, участвующих в норадренергической сигнализации, и цитокины изучаются [11].
Этиопатогенез
Патогенез СРК до конца не выяснен, однако, согласно доминирующей на сегодняшний день концепции, основными его факторами являются нарушения взаимодействия в системе «головной мозг–кишка», представленные следующими положениями:
- нарушение нервной регуляции (корковые и подкорковые центры – лимбическая система, гипоталамус, сегментарный уровень);
- нарушение гуморальной регуляции (гастроинтестинальные гормоны – ВИП, мотилин, холецистокинин; биологически активные вещества – гистамин, серотонин; эндокринная патология);
- нарушение восприятия и трансформации периферического афферентного потока импульсов в коре головного мозга;
- висцеральная гиперчувствительность (гипералгезия, аллодиния).
СРК – «родом из раннего детства». Такой тезис не выглядит странным, когда начинаешь глубже изучать особенности развития ребенка с момента рождения. В частности, стресс в младшем возрасте, как полагают, приводит к развитию гиперчувствительности или изменению реакции на патологические воздействия в дальнейшей жизни [8, 12].
Риск развития СРК также увеличивается при травмирующих переживаниях в раннем возрасте, например отсутствие заботы или потеря одного из родителей. Минимальный уровень стресса или боли, которые могут приводить к долгосрочным проблемам со здоровьем, не определен. Кроме того, непонятно, что делает некоторых детей более уязвимыми, в каком возрасте дети наиболее подвержены неблагоприятным воздействиям [8, 13]. Например, дети, которым по разным причинам вводился назогастральный зонд в периоде новорожденности, достоверно чаще страдают от болей в животе в подростковом возрасте по сравнению со своими братьями и сестрами [14].
Отношения между СРК и сопутствующими психическими расстройствами хорошо изучены у детей. Известно, что отмечается рост распространенности СРК в подростковом возрасте. Если среди детей младшего и среднего школьного возраста отсутствуют гендерные различия относительно частоты СРК, то среди подростков доминируют лица женского пола, что аналогично эпидемиологии тревожных и депрессивных симптомов и расстройств [15]. Есть данные литературы, согласно которым пациенты с СРК представляют собой группу риска по развитию в дальнейшем тревожных и депрессивных расстройств [16].
Вместе с тем точное соотношение между психическими особенностями, психиатрическими жалобами и СРК остается неясным. Есть доказательства того, что тревожность и депрессивные расстройства, скорее всего, предвосхищают жалобы со стороны ЖКТ. Возможно, у этих лиц психологические особенности предрасполагают к повышенному вниманию к жалобам со стороны ЖКТ и запускают механизм болей. Существует точка зрения, будто психологические расстройства и СРК могут иметь общие факторы риска или же это просто разные проявления особого причинного процесса [8, 16].
Известно, что факторы окружающей среды влияют на микробиоценоз кишечника. У детей, перенесших острые бактериальные гастроэнтериты, высока вероятность развития СРК по сравнению с контрольной группой [17, 18]. Аналогичные данные получены и в другой работе; там же в качестве дополнительного предиктора воспаления отмечен женский пол [17, 19]. Среди взрослых пациентов вероятность развития СРК выше у лиц, перенесших бактериальную инфекцию, по сравнению с больными, перенесшими вирусную инфекцию [20].
Существуют микробиологические различия в составе кишечной микрофлоры у пациентов с СРК и здоровых лиц. Имеющиеся в литературе эпидемиологические, физиологические и клинические данные свидетельствуют о роли кишечных бактерий в патогенезе заболевания [8,21]. Известно, что некоторые пробиотические штаммы снижают риск стойких симптомов СРК (в частности, Lactobacillus reuteri и Lactobacillus GG).
Данные об использовании пробиотиков детьми с СРК имеют ограниченный характер, но и указывают на их позитивный эффект. Однако указывается на необходимость использования разных пробиотиков для конкретных условий, симптомов и конкретных пациентов [21–23].
В патогенезе СРК играют роль воспаление слизистой оболочки, нарушение регуляции кишечного иммунитета, нарушение микробиоценоза и проницаемости слизистой оболочки кишечника [6]. По некоторым данным, у детей с СРК отмечен более высокий уровень фекального кальпротектина по сравнению с контрольной группой [24]. У лиц с этой патологией отмечен синдром избыточного бактериального роста (СИБР). Причиной такого состояния, как известно, является микробная контаминация тонкого кишечника микрофлорой толстой кишки. В результате СИБР происходят избыточное образование газов, изменение моторики кишки и чувствительности слизистой оболочки кишечника, а также активация кишечной иммунной системы [25].
Одним из триггеров развития СРК может выступать пищевая аллергия. Исследования взрослых пациентов доказали, что при активации тучных клеток, расположенных в непосредственной близости от нервных окончаний в стенке кишечника происходит изменение висцерального восприятия, что провоцирует болевой абдоминальный синдром [26, 27]. Кроме того, использование стабилизаторов тучных клеток (кетотифена) снижает висцеральную чувствительность и приводит к повышению абдоминального болевого синдрома у взрослых пациентов с СРК [28].
Интересные данные получены М.Ю. Типикиной (2014). В частности, было показано:
- наиболее значимыми факторами риска развития СРК у детей и подростков являются перенесенные стрессовые ситуации, отягощенный неврологический анамнез, длительная и повторная антибиотикотерапия, перенесенные кишечные инфекции, регулярные нарушения диеты и режима питания;
- СРК сопровождается признаками минимального хронического воспаления в кишечнике: в 97,5% случаев имеет место микроскопический хронический дистальный колит. У детей с СРК повышен уровень провоспалительных цитокинов в слизистой оболочке толстой кишки (у 45% больных повышен интерлейкин (ИЛ) 8, у 90% – интерферон-γ); у 27,3% больных повышен уровень фекального кальпротектина;
- СРК характеризуется изменением состава микрофлоры во всех отделах кишечника: у 100% детей имеются дисбиотические нарушения в толстой кишке, 85,1% диагностируется СИБР [38].
Серьезной проблемой служит вариант постинфекционного СРК (ПИСПК). Так, по данным А.И. Парфенова и соавт. (2009), удельный вес ПИ-СРК после перенесенной острой кишечной инфекции (ОКИ) составляет 24–32%. Заболеваемость ПИ-СРК после бактериального гастроэнтерита составляет 98,2 на 10 тыс. человек в год [39]. По данным Н. Tomblom et al. (2007), частота ПИ-СРК у детей до 6 лет составляет 7–33% [42].
По мнению А.И. Парфенова (2009), к факторам риска возникновения ПИ-СРК относятся:
- женский пол;
- лечение инфекционной диареи антибиотиками;
- наличие органического заболевания пищеварительной системы;
- признаки социально-психологической дезадаптации (тревожность, депрессия, склонность к соматизации, хронический стресс, диссомнические расстройства).
Те же авторы приводят перечень наиболее значимых в генезе ПИ-СРК инфекционных агентов: Salmonella, Escherichia coli, Shigella, Campylobacter jejuni, энтеро-, ротавирусы и др.
Среди генетических факторов, определяющих предрасположенность к развитию ПИ-СРК, обычно называют снижение частоты экспрессии аллели ИЛ-10, увеличение частоты промежуточной аллели фактора некроза опухоли α, дисбаланс цитокинов, снижение показателей уровней ИЛ-10, ИЛ-12 и трансформирующего ростового фактора β [39].
По мнению И.Н. Ручкиной и соавт. (2006), к критериям диагностики ПИ-СРК относятся:
- соответствие Римским критериям- IV;
- обнаружение маркеров ОКИ в субстратах от больного;
- нарушение микрофлоры в бактериологических исследованиях кишечника;
- СИБР;
- изменение мукозной микрофлоры слизистой оболочки тонкого кишечника;
- положительная динамика от лечения антисептиками и пробиотиками [41].
Определенная роль в генезе СРК отводится висцеральной гиперчувствительности или гипералгезии. Однако данное утверждение применительно к детям нуждается в системной доказательной базе [29, 30]. Симптомы СРК могут иметь больше общего с патологическим усилением физиологических стимулов, а не истинной нейросенсорной гиперчувствительностью [31].
Моторные нарушения долгое время считались основой формирования функциональных нарушений кишечника. Вместе с тем, согласно литературным данным, патогномоничные именно для СРК нарушения не выявлены [32]. Многие из моторных нарушений, описанных у пациентов с СРК, найдены с более низкой частотой и у здоровых людей.
Нарушение моторики, как правило, приводят к вторичным изменениям внутренней среды кишечника, развитию изменений состава микрофлоры, нарушению процессов переваривания и всасывания. Последнее неизбежно усиливает дисбаланс кишечной микрофлоры, усугубляет нарушение моторики (что провоцирует болевой синдром), тем самым замыкая порочный круг.
Клиническая картина
Согласно Римским критериям-III (2006), диагностические критерии СРК у детей включают:
1. Абдоминальный дискомфорт в течение по меньшей мере 2 месяцев (неприятные ощущения, не описываемые как боль) или боли, ассоциированные с ≥2 из следующих симптомов на протяжении по меньшей мере 25% времени:
- облегчение после дефекации;
- начало связано с изменением частоты стула;
- начало связано с изменением характера стула.
2. Отсутствуют признаки воспаления, анатомические, метаболические или неопластические изменения, которые могли бы объяснить имеющиеся симптомы.
Римские критерии-IV (2016) несколько уточняют эти положения:
1. Боли в животе (не менее 2 месяцев до момента постановки диагноза), по крайней мере 4 дня в течение месяца+следующие признаки:
- связь с актом дефекации;
- изменение частоты стула;
- изменение формы стула.
2. У детей, страдающих СРК с запором, боли не проходят после ликвидации запора (если они проходят, это функциональный запор).
3. После соответствующей оценки симптомы не могут быть объяснены другими причинами [3].
Хочется обратить особое внимание клиницистов на пункт 2 как на важный дифференциально-диагностический практический критерий.
К симптомам, подтверждающим диагноз СРК, относятся:
- патологическая частота стула: ≥4 раз в день и ≤2 раз в неделю;
- патологическая форма кала: комками/плотный или жидкий/водянистый;
- патологический пассаж каловых масс: избыточное натуживание, тенезмы, императивные позывы, чувство неполного опорожнения;
- избыточное слизеотделение;
- вздутие живота и чувство распирания.
Особенностями клинических появлений СРК являются:
- абдоминальная боль: вариабельность интенсивности, отсутствие постоянной локализации, рецидивирующий характер, сочетание с метеоризмом и флатуленцией, снижение интенсивности после дефекации и отхождения газов;
- метеоризм: не выражен в утренние часы, нарастает в течение дня, преимущественно в нижних отделах живота, непостоянен, связан с погрешностью в диете;
- чередование диареи и запоров с преобладанием одного из симптомов;
- особенности диареи: отсутствие полифекалии, жидкий стул 2–4 раза только в утреннее время, после завтрака, на фоне психотравмирующей ситуации, императивные позывы, чувство неполного опорожнения.
К дополнительным диагностическим критериям СРК относятся:
- полиморфизм жалоб: многообразие вегетативных и неврологических нарушений, внекишечные проявления, признаки функциональных нарушений со стороны других органов;
- высокая обращаемость к врачам разных специальностей;
- несоответствие между длительностью заболевания, многообразием жалоб, удовлетворительным внешним видом и физическим развитием пациента;
- отсутствие прогрессирования симптоматики;
- отсутствие клинических проявлений в ночное время;
- связь с психотравмирующей ситуацией.
В англоязычной литературе приводится оригинальная и удобная для запоминания система ABCDE, отражающая основные диагностические критерии СРК (N.J. Talley, 2012):
- A – abdominal (stomach or bowel) pain or discomfort (боли в животе или дискомфорт в проекции желудка или кшечника);
- B – bloating, feeling swollen, or even visible swelling, like one in pregnant (вздутие живота, увеличение его размеров как при беременности);
- C – constipation (запоры);
- D – diarrhea (диарея);
- E – extra-bowel symptoms in some cases, such as nausea, tiredness, backaches, or muscle aches (внекишечные симптомы в ряде случаев, такие как тошнота, усталость, боли в спине или мышцах).
Приведенные выше диагностические критерии имеют большую клиническую значимость и позволяют по крайней мере заподозрить СРК у ребенка. Появление у пациента т.н. симптомов тревоги («красные флаги», «red flags») заставляют врача подумать об органической (воспалительной, инфекционной и др.), но не функциональной природе заболевания. Знание этих симптомов обязательно для врача-педиатра любого профиля.
К симптомам тревоги («red flags») относятся:
- стереотипность болевого синдрома, иррадиация болей;
- постоянная боль в правом верхнем или нижнем квадранте живота;
- упорная рвота;
- сохранение симптомов в ночное время;
- наличие крови в стуле, рвота с примесью крови, мелена;
- дисфагия;
- нарушения физического развития, задержка роста;
- немотивированная потеря массы тела;
- задержка полового развития;
- лихорадка неясного генеза;
- боли в суставах, артриты;
- перианальные поражения;
- лимфаденопатия;
- упорная диарея, ночная диарея, полифекалия;
- постоянное увеличение живота;
- гепато-(сплено)мегалия.
- любые изменения в клиническом и/или биохимическом анализе крови;
- отягощенная по онкопатологии кишечника, воспалительным заболеваниям кишечника, целиакии, язвенной болезни наследственность.
Дифференциальный диагноз обычно проводится со следующими заболеваниями:
- кишечные инфекции, паразитозы;
- синдром мальабсорбции (целиакия, аллергическая энтеропатия, синдром короткой кишки и др.);
- эндокринная патология (гипотиреоз, тиреотоксикоз, сахарный диабет);
- нейроэндокринные опухоли ЖКТ (випома, гастринома);
- гинекологическая патология;
- воспалительные заболевания кишечника (неспецифический язвенный колит, болезнь Крона, болезнь Уипла);
- колоректальный рак, дивертикулез, полипоз кишечника;
- туберкулез, амилоидоз кишечника;
- интестинальная ишемия;
- ятрогенные факторы (длительное применение лаксативов, препаратов железа).
Комплекс обследования при подозрении на СРК включает следующие диагностические методы:
- эндоскопические исследования: ректороманоскопия, фибросигмоидоскопия, фиброколоноскопия (ФКС), эзофагогастродуоденоскопия;
- ультразвуковое исследование органов брюшной полости, почек, органов малого таза или компьютерная томография;
- лабораторное исследование крови: гемограмма, биохимический анализ крови;
- общий анализ мочи;
- иследование кала: микроскопия, паразитологическое исследование, на скрытую кровь, эластаза, микробиологическое исследование на углеводы и др.;
- водородный тест для исключения гиполактазии и мальабсорбции фруктозы;
- исключение целиакии (серологические маркеры, генетическое обследование и исследование биоптата слизистой оболочки двенадцатиперстной кишки).
К дополнительным методам обследования относятся:
- оценка состояния ЦНС и вегетативной нервной системы, психологического статуса пациента;
- ФКС с эндобиопсией (по показаниям, при запоре);
- колодинамическое исследование;
- рентгеноконтрастное исследование кишечника (ирригография);
- допплерография и ангиография сосудов брюшной полости;
- серологическое исследование крови (патогенная кишечная флора);
- аллергологическое обследование (пищевая сенсибилизация);
- иммунограмма.
Необходимо отметить, что в большинстве случаев у педиатра и детского гастроэнтеролога нет явных оснований для проведения серьезных инструментальных и инвазивных исследований при подозрении на СРК. Обычно правильно собранного анамнеза, физикального обследования и полученных параклинических данных достаточно для постановки диагноза. Появление у ребенка «симптомов тревоги» заставляет врача менять тактику и проводить обследование, направленное на исключение органической патологии кишечника.
Резюмируя положения вышеизложенной части материала, можно вывести интегральные критерии диагностики СРК у детей:
- соответствие клинической симптоматики Римским критериям-IV;
- отсутствие «симптомов тревоги»;
- отсутствие органической патологии по данным физикального обследования;
- адекватная оценка возрастных и ростовых особенностей ребенка;
- наличие триггерных факторов по данным анамнеза;
- особенности психологического статуса, психотравма.
СРК – это диагноз исключения, который можно поставить лишь после того, как надежно отвергнута органическая природа заболевания («диагноз стационара»).
СРК не может быть диагностирован у детей раннего возраста.
Лечение
Немедикаментозная коррекция
С чего нужно начинать? Необходимо успокоить ребенка и его родственников, разъяснить особенности заболевания и возможные причины его формирования.
Комплекс мер немедикаментозной коррекции признаков СРК у детей представлен следующим образом:
- устранение возможных причин кишечной симптоматики;
- модификация образа жизни пациента (режима дня, пищевого поведения, физической активности, диетических пристрастий);
- нормализация психоэмоционального состояния (устранение психотравмирующих ситуаций, ограничение школьных и внешкольных нагрузок, различные варианты психотерапевтической коррекции, создание комфортных условий для дефекации и т.д.).
- диетическая коррекция.
- физиотерапия, ЛФК, массаж с седативным или стимулирующим эффектом (в зависимости от типа моторных нарушений);
- фитотерапия с седативным эффектом.
Диетотерапия ребенка с СРК должна выстраиваться в соответствии со следующими положениями:
- индивидуализированная диета в соответствии с пищевым стереотипом ребенка;
- исключение индивидуально непереносимых продуктов, газированных напитков, бобовых, цитрусовых, шоколада, овощей, богатых эфирными маслами;
- ограничение употребления молока, продуктов с грубой клетчаткой, а также продуктов, вызывающих метеоризм.
За основу обычно берется стол № 4, в который вносятся индивидуальные коррективы.
Медикаментозная коррекция
1. Коррекция моторики: препараты с преимущественно спазмолитическим эффектом:
- топические кишечные модуляторы – селективные блокаторы натриевых каналов гладкой мускулатуры кишечника: мебеверин, дицетел;
- миотропные спазмолитики: дротаверин, папаверин, в т.ч. ректальные свечи;
- препараты с холинолитическим действием: гиосцина бутилбромид (Бускопан), Метеоспазмил, препараты красавки, в т.ч. ректальные свечи;
- регулятор моторики кишечника – тримебутин.
Следует отметить, что из перечисленных препаратов официально в педиатрии кроме дротаверина, папаверина и препаратов красавки разрешены гиосцина бутилбромид (с 6 лет) и тримебутин (с 3 лет).
2. Устранение метеоризма: препараты симетикона: Боботик, Эспумизан, Саб Симплекс, Дисфлатил, комбинированные препараты (Метеоспазмил, Панкреофлат).
3. Этапная коррекция нарушений микробиоценоза кишечника: кишечные «антисептики» (эрцефурил, энтерофурил, нифурател и др.), энтеросорбенты, слабительные средства, пре- и пробиотики).
Среди энтеросорбентов несомненным лидером является диоктаэдрический смектит (Смекта). Также могут использоваться препараты Зостерин-Ультра, Латкофильтрум, Энтеросгель и др.
Классификация слабительных средств:
- Средства, вызывающие химическое раздражение рецепторного аппарата кишки – производные антрахинонов (препараты сенны, крушины, ревеня) и дифенилметана (Бисакодил, Дульколакс, Гутталакс), а также жирные кислоты (касторовое масло). Из этой группы применение в педиатрии имеет только Гутталакс (у детей старше 2 лет).
- Средства, обладающие осмотическими свойствами: магния сульфат, соль карловарская, лактулоза, полиэтиленгликоль 4000 (ПЭГ; Форлакс), лактитол (Экспортал).
- Средства, увеличивающие объем содержимого кишечника: отруби, морская капуста, семена Plantago ovatae (Мукофальк) и т.д.
- Средства, способствующие размягчению каловых масс и их скольжению: вазелиновое и миндальное масло.
Осмотические слабительные являются препаратами первой лини как при терапии функциональных запоров, так и при лечении больных СРК с запорами. По результатам многолетних исследований сравнительной эффективности препаратов этой группы можно заключить, что ПЭГ оказался эффективнее лактулозы по следующим аспектам: частота стула в неделю, форма стула по Бристольской шкале, купирование болевого абдоминального синдрома на фоне хронических запоров, необходимость жесткого соблюдения диеты для получения эффекта. Выводы касаются как детей, так и взрослых. Исключение – купирование болевого синдрома: различия в частоте этого признака при применении ПЭГ и лактулозы были выявлены только у детей [33].
4. Ферментотерапия: применяются по показаниям (признаки внешнесекреторной недостаточности поджелудочной железы) препараты панкреатических ферментов (Креон, Пангрол, Мезим форте и др.).
5. По специальным показаниям применяется психофармакотерапия, однако следует помнить, что, по имеющимся данным, эффективность плацебо для больных СРК сравнима с таковой при назначении амитриптилина (56 и 63% соответственно) [34].
6. Пребиотики: среди пребиотиков при СРК у детей наиболее часто применяется лактулоза, разумеется, при прео-
бладании запоров. Убедительных данных о высокой эффективности препарата Хилак форте при СРК у детей нам не встретилось.
7. Пробиотики: об их достаточно высокой эффективности у части детей с СРК говорилось выше.
В клинической практике могут оказаться эффективными как моно-, так и комбинированные пробиотики (симбиотики и синбиотики) –
Бифиформ, Линекс, Нормобакт L, Примадофилус, Релалайф, а также препарат, содержащий Saccharomyces boulardii (Энтерол).
8. В литературе обсуждается вопрос о возможности применения блокатора опиоидных рецепторов, препарата лоперамид, который замедляет транзит по толстой кишке. Он показал свою эффективность для взрослых пациентов с СРК и диарейным синдромом [35]. Аналогичные исследования у детей и подростков в настоящее время отсутствуют.
Согласно данным Кокрейновского обзора, несмотря на широкий спектр возможных вариантов фармакологических воздействий, хорошо контролируемые педиатрические исследования терапии СРК отсутствуют, поэтому «вопрос об истинной эффективности препаратов в терапии функциональных нарушений кишечника у детей остается открытым» [36].
Принятие биопсихосоциальной модели функциональных нарушений кишечника, в частности СРК, создало основу для использования психосоциального вмешательства, в т.ч. семейной терапии, когнитивно-поведенческой терапии, методов релаксации, гипнотерапии, биологической обратной связи. Многие из этих стратегий не только оказывают прямое воздействие на соматические симптомы, но и способствуют самостоятельному управлению симптомами ребенком. Мета-анализ и систематические обзоры показали, что психологические методы лечения эффективны при лечении соматических симптомов у взрослых и детей с СРК [37].
Около 40% детей с СРК ежегодно используют методы т.н. альтернативной медицины. К ним относятся иглоукалывание, остео-, гомеопатия, фитотерапия и др. Убедительные доказательства, подтверждающие эффективность этих методов для детей с СРК, в настоящее время отсутствуют [38].
Заключение
На основании собственного клинического опыта и изучения документации из различных медицинских учреждений нашей страны, авторы пришли к выводу о гиподиагностике СРК у детей. Причина этого явления, по-видимому, кроется в отсутствии достаточных знаний педиатров первичного звена по обсуждаемой проблеме и, соответственно, в снижении настороженности в отношении нее. Приведенные выше критерии постановки диагноза СРК должны помочь педиатру сориентироваться в дифференциально-диагностических хитросплетениях и выйти на правильный диагноз. Дальнейшую помощь в организации лечебных программ могут оказать врачи-гастроэнтерологи, неврологи, психотерапевты.


