Введение
В последние годы благодаря более глубокому пониманию патологических процессов, лежащих в основе хронической обструктивной болезни легких (ХОБЛ), и обогащению терапевтического потенциала современного врача существенно изменились и подходы к ведения этой категории пациентов. Стратегия, предлагаемая экспертами GOLD, основана на учете трех основных переменных характеристик ХОБЛ: степени тяжести бронхиальной обструкции, выраженности клинических симптомов и частоте повторных обострений болезни [1]. Напротив, испанские эксперты в основу разработанного ими терапевтического алгоритма положили принцип клинической фенотипизации больных ХОБЛ [2], нашедший поддержку и в ряде других стран. Впрочем, знакомство с обновленными версиями этих документов [3, 4] свидетельствует, что, несмотря на имеющиеся различия, оба они объединены глобальной целью повышения индивидуализации лечения.
Здесь же следует указать и еще на одно положение, сплачивающее эти и другие документы [5–7]: основным «инструментом» в достижении симптоматического контроля и снижении риска таких событий, как обострения ХОБЛ, прогрессирующее падение легочной функции и смерть больного, остаются бронходилататоры, тем более что возможности этого направления терапии претерпели сегодня радикальные изменения.
Выбор бронходилататоров в качестве приоритетного направления лечения больных ХОБЛ аргументируется их многочисленными саногенетическими эффектами (табл. 1), достигаемыми главным образом прямым стимулирующим действием на β2-адренорецепторы (β2-агонисты) и непрямым – посредством блокады влияния ацетилхолина на мускариновые холинорецепторы (холиноблокаторы или антихолинергические препараты).

β2-агонисты
Краткая история создания и применения
История применения симпатомиметиков с лечебной целью, продолжающаяся в наши дни созданием селективных β2-агонистов короткого, длительного и ультрадлительного действий, берет свое начала в недрах традиционной китайской медицины (3000 лет до н.э.). Уже в то время существовала практика использования экстракта растения Ephedra vulgaris (Ma Huang) в лечении больных одышкой [12] (рис. 1). Начало XIX в. ознаменовалось многочисленными усилиями по выделению экстракта надпочечников и использованию его в клинической практике. Первая успешная попытка подкожного введения эпинефрина (адреналина) с целью купирования астматического приступа датируется 1903 г., хотя бронходилатирующие свойства препарата будут установлены лишь через 4 года [14]. Инъекции водного раствора и суспензии эпинефрина в ургентной терапии острого бронхоспазма будут широко применяться вплоть до начала 1980-х гг. Менее популярным был опыт клинического использования препарата в форме аэрозоля [15].
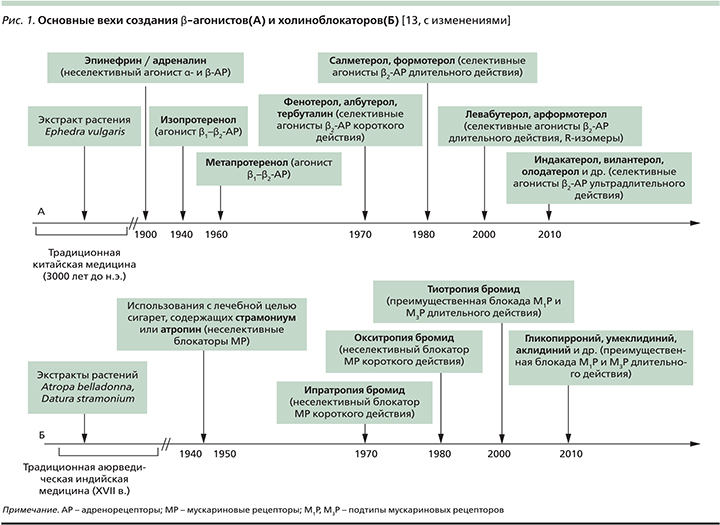
В 1950-х гг. создаются первые неселективные β1/β2-агонисты в форме аэрозоля – изопротеренол и метапротеренол, которые на ближайшие несколько десятилетий станут «препаратами выбора» в лечении больных астмой [16]. Однако, несмотря на демонстративный бронходилатирующий эффект, эти препараты ввиду неселективности их β-агонистической активности, т.е. стимуляции β1-рецепторов сердечной мышцы, гладких мышц внутренних органов и др., характеризовались широким спектром серьезных нежелательных лекарственных реакций (табл. 2).

Начало 1980-х гг. было ознаменовано созданием прототипа селективных β2-агонистов – сальбутамола, характеризовавшегося быстрым началом и ограниченной продолжительностью (4–6 часов) бронходилатирующего эффекта. За этим последовала очередь β2-агонистов длительного действия (до 12 часов) – салметерола, формотерола, и наконец «венцом» эволюции этого класса лекарственных препаратов стали β2-агонисты ультрадлительного действия (до 24 часов) – индакатерол, олодатерол, вилантерол, кармотерол, абедитерол, PF-610355, AZD-3199 и др. [18].
Механизм действия
В основе механизма действия β-агонистов лежит их связывание с одной или несколькими цепочками ассоциированного с G-белком адренорецептора, следствием чего является стимуляция аденилатциклазы (рис. 2).

Аденилатциклаза, в свою очередь, стимулирует превращение аденозинтрифосфата в циклический 3’-5’-аденозинмонофосфат, активирующий протеинкиназу [20]. Далее, под влиянием протеинкиназы происходит фосфорилирование кальциевых каналов гладкомышечных клеток бронхов, что приводит к снижению захвата Ca2+ из внеклеточного пространства, усилению его депонирования в саркоплазматическом ретикулуме миоцита, и как итог, – к падению внутриклеточной концентрации и связанной с этим миорелакции. Напротив, фосфорилирование кальциевых каналов миокарда сопровождается усилением притока Ca2+ из внеклеточного пространства, что, обусловливая повышение активности контрактильных белков, характеризуется положительными инотропным и хронотропным эффектами.
Поскольку β2-адренорецепторы помимо миокарда и гладкомышечных клеток бронхов представлены еще и в подслизистых железах, эндотелии кровеносных сосудов, на поверхности тучных клеток, лейкоцитов, эозинофилов и лимфоцитов, то это объясняет многообразие «бронхолегочных» эффектов β2-агонистов:
- релаксация гладкомышечных клеток бронхов (бронходилатация);
- ингибирование высвобождения медиаторов из тучных клеток;
- уменьшение экстравазации и отека слизистой бронхов;
- улучшение мукоцилиарного клиренса;
- повышение секреции бронхиальных желез;
- ограничение парасимпатической передачи;
- противокашлевое действие.
Холиноблокаторы/антихолинергические препараты
Краткая история создания и применения
В течение нескольких столетий (с XVII в.) аюрведические хилеры в Индии использовали ингаляции паров Dature spp., содержащие алкалоиды белладонны (атропин, скополамин), для лечения больных астмой [13] (рис. 1). В последующем практика курения с лечебной целью сигарет, содержащих листья дурмана («divine stramonium» – «божественный, или волшебный, дурман»), была «импортирована» в Англию и просуществовала вплоть до конца 1970-х гг. [22]. Позднее удалось создать синтетические производные природных алкалоидов, относящиеся к четвертичным аммониевым соединениям, характеризующихся минимальной системной абсорбцией и ограниченной гематоэнцефалической проницаемостью. Минимальными оказались и другие потенциальные нежелательные лекарственные реакции синтетических холиноблокаторов, включая возможное влияние на объем экспекторируемого бронхиального секрета и его реологические свойства [18].
В 1987 г. первым коммерчески доступным ингаляционным холиноблокатором стал ипратропия бромид [23]. Он демонстрировал неселективную блокаду М1-, М2- и М3-холинорецепторов и относительно небольшую продолжительность бронхолитического действия. А на рубеже XX и XXI вв. появился тиотропия бромид, который в отличие от ипратропиума не только обеспечивал длительную бронходилатацию (≈24 часа), но и обладал т.н. кинетической селективностью, т.е. обеспечивал более продолжительную блокаду М1- и М3-рецепторов. Последнее представлялось очень важным с клинической точки зрения, поскольку антагонизм с эффекторными М3-рецепторами корреспондирует с выраженностью бронхолитического эффекта препарата [24] и сдерживает гиперсекрецию муцина, «запускаемую» нейтрофильной эластазой [25]. «Монополия» тиотропия как единственного холиноблокатора длительного действия закончилась через 10 лет, когда один за другим стали появляться и остальные представители этого подкласса антихолинергических препаратов – гликопиррония бромид, аклидиния бромид, умеклидиния бромид, CHF 5407, троспиум (ALKS27) и PF-4522971 [18].
Механизм действия
Три (М1–М3) из пяти выделенных подтипов мускариновых холинорецепторов локализуются на протяжении парасимпатических нервных волокон, ответственных за контроль тонуса воздухоносных путей, на поверхности гладкомышечных клеток бронхов и бронхиальных желез (рис. 3). Передача нервных импульсов через парасимпатический ганглий осуществляется при участии никотиновых и М1-холинорецепторов, возбуждение которых ускоряет процесс нейротрансмиссии. Возбуждение пресинаптических М2-холинорецепторов прерывает высвобождение ацетилхолина в синаптическую щель, а стимуляция постсинаптических М3-холинорецепторов вызывает сокращение гладкомышечных клеток бронхов. Суммарный эффект холиноблокаторов характеризуется падением тонуса воздухоносных путей и улучшением бронхиальной проходимости [26].
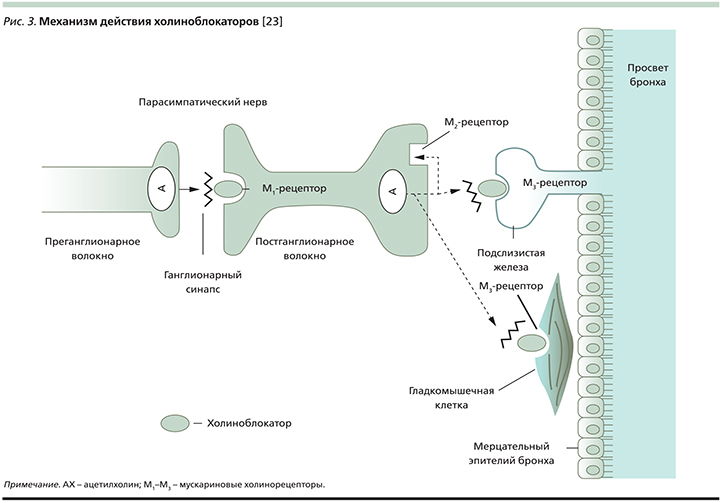
Наибольшее клиническое значение играет блокада постсинаптических М3-холинорецепторов. И здесь важно подчеркнуть, что современные холиноблокаторы (тиотропий и др.) обладают селективным антагонизмом в отношении соответствующих подтипов мускариновых рецепторов, а именно, характеризуясь сопоставимо высокой степенью сродства к М1–М3-холинорецепторам, они демонстрируют существенно более медленную диссоциацию с М3-рецепторами (в отличие от М2-рецепторов), что обеспечивает продолжительную бронходилатацию и исключает парадоксальный бронхоспазм [27].
Роль и место бронходилататоров в лечении ХОБЛ
Как уже говорилось выше, декларируемым международными экспертами целям фармакотерапии ХОБЛ (контроль симптомов заболевания, повышение переносимости физических нагрузок, улучшение качества жизни, снижение частоты и тяжести обострений) [28] наилучшим образом соответствует терапия бронходилататорами длительного действия, возможности которой за последнее время существенно расширились (табл. 3).
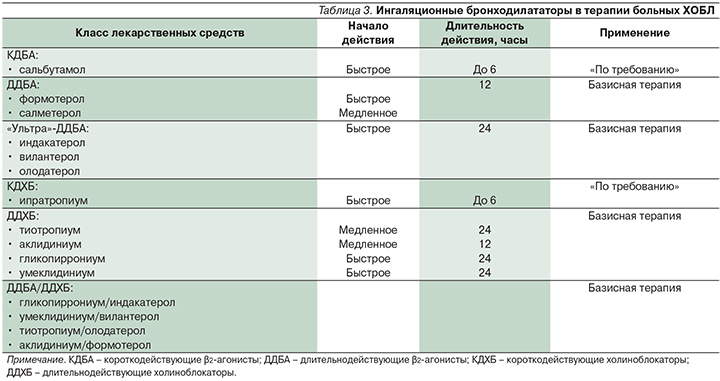
С внедрением в клиническую практику во второй половине 1990-х гг. длительно действующих β2-агонистов (ДДБА) – формотерола и салметерола – было показано, что у больных с стабильным течением ХОБЛ эти препараты имеют очевидные клинические преимущества по сравнению с плацебо и бронходилататорами короткого действия. Причем это касалось не только более удобного режима дозирования соответствующих лекарственных средств и, как следствие, – лучшей приверженности пациентов врачебным рекомендациям [29], но и оптимизации таких спирометрических/клинических параметров, как объем форсированного выдоха за первую секунду (ОФВ1), качество жизни пациентов, частота обострений забо-левания [30–32].
Новые возможности терапии больных ХОБЛ появились с выходом на фармацевтический рынок бронходилататоров, эффект которых сохранялся ≥24 часов. И первым в этом ряду суждено было стать длительнодействующему холиноблокатору (ДДХБ) тиотропия бромиду. Препарат на долгие годы обрел устойчивые позиции «лидера» в ряду бронходилататоров, что аргументировалось многочисленными доказательствами его благотворного влияния на функциональные параметры, качество жизни пациентов, частоту повторных обострений заболевания, а у отдельных категорий больных – на скорость падения ОФВ1 и кумулятивную смертность [33–36].
2010-е гг. ознаменовались появлением ряда ДДБА и ДДХБ (табл. 3), а также их фиксированных комбинаций (табл. 4).

По мнению экспертов программы GOLD, фиксированные комбинации ДДБА/ДДХБ следует рассматривать как препараты «первой линии» для большинства больных с симптоматическим течением ХОБЛ и практически для каждого, кто нуждается в регулярной поддерживающей терапии [1]. Более точное определение места фиксированным комбинациям ДДБА/ДДХБ мы находим на страницах Испанских рекомендаций – их назначение приоритетно для всякого больного высокого риска независимо от клинического фенотипа, что определяется тяжелой/крайне тяжелой бронхиальной обструкцией или выраженной одышкой (mMRC1 ≥2), или, по крайней мере, двумя эпизодами нетяжелого обострения, или потребовавшим госпитализации одним эпизодом тяжелого обострения за истекший год, или комбинациями указанных факторов [4].
Фармакологическая основа кооперативного взаимодействия между β2-агонистами и холиноблокаторами очень сильна. Действительно, β2-агонисты вызывают бронходилатацию посредством релаксации гладкомышечных клеток бронхов независимо от характера констриктивных стимулов, т.е. выступают в качестве функциональных антагонистов бронхоконстрикции. В противоположность этому, холиноблокаторы ингибируют бронхоконстрикторные эффекты ацетилхолина, вступают с ним в конкурентный антагонизм за взаимодействие с эффекторными мускариновыми рецепторами, дополняя и потенцируя функциональный антагонизм β2-агонистов [37].
К настоящему времени накоплен огромный фактический материал по оценке эффективности и безопасности фиксированных комбинаций ДДБА/ДДХБ, полученный в рамках плацебо-контролируемых исследований и исследований с активным контролем (ДДБА, ДДХБ и ИГКС/ДДБА2) [38, 39]. Так, в частности, согласно выводам недавно опубликованного систематического обзора и метаанализа, включивших 23 исследования (20 185 больных), фиксированные комбинации ДДБА/ДДХБ в ходе рандомизированных контролируемых исследований продолжительностью ≥12 недель превосходят холиноблокаторы и ИГКС/ДДБА по величине прироста «наименьшего» (предбронхолитического) ОФВ1, причем в большинстве случаев прирост этого показатели превышал минимальные клинически значимые величины (>100 мл); достоверным было превосходство комбинированной терапии и во влиянии на выраженность одышки (транзиторный индекс одышки), формализованные критерии качества жизни (вопросник SGRQ3), на частоту ситуационного применения брнходилататоров короткого действия. Важнейшим с клинической точки зрения стало достоверное преимущество ДДБА/ДДХБ над ИГКС/ДДБА во влиянии на частоту среднетяжелых и тяжелых обострений ХОБЛ (отношение шансов [ОШ] – 0,82; 95% доверительный интервал [ДИ] – 0,75–0,91) [40]. Более привлекательным представлялся и профиль безопасности фиксированных комбинаций ДДБА/ДДХБ, характеризовавшийся по сравнению с ИГКС/ДДБА меньшим риском развития нежелательных лекарственных реакций (ОШ – 0,94; 95% ДИ – 0,89–0,99), в т.ч. и ятрогенной пневмонии (ОШ – 0,59; 95% ДИ – 0,43–0,81]), а также минимальной (по сравнению с ДДХБ) вероятностью прекращения терапии ввиду ее неэффективности (ОШ – 0,66; 95%ДИ – 0,51–0,87) или (по сравнению с ИГКС/ДДБА) вследствие развития нежелательных лекарственных реакций (ОШ – 0,83; 95% ДИ – 0,69–0,99) [40].
Таким образом, фиксированные комбинации ДДБА/ДДХБ по эффективности превосходят монокомпонентную терапию и комбинацию ИГКС/ДДБА, характеризуясь меньшим риском развитии ятрогенной пневмонии по сравнению с лечебной программой, включающей ИГКС. Назначение последних становится оправданным лишь в случаях повторных обострений ХОБЛ, несмотря на продолжающийся прием ДДБА/ДДХБ, а также для отдельных категорий больных, воспалительный профиль заболевания которых предполагает «ответ» на ИГКС [41, 42].
Как уже говорилось выше, в настоящее время доступны пять фиксированных комбинаций ДДБА/ДДХБ, четыре из которых зарегистрированы в нашей стране (табл. 4). И в связи с этим возникает закономерный вопрос: являются ли продемонстрированные в ходе контролируемых исследований, систематических обзоров и метаанализов эффекты различных фиксированных комбинаций ДДБА/ДДХБ в равной степени характерными для каждого из представителей этого класса лекарственных средств, а если нет, то какое клиническое значение могут иметь существующие между ними различия?
Однозначно ответить на этот вопрос сегодня не представляется возможным. Во-первых, большинство из проведенных ранее исследований, где оценивалась эффективность и безопасность фиксированных комбинаций ДДБА/ДДХБ, отличались между собой характеристиками пациентов, длительностью самих исследований, выбором препаратов активного контроля и «конечных точек» оценки эффективности. Во-вторых, до недавнего времени отсутствовали исследования прямого сравнения («head-to-head») отдельных представителей класса ДДБА/ДДХБ.
Очевидно, первым подобным опытом прямого сравнения стало рандомизированное перекрестное открытое исследование G.J. Feldman et al. [43], в ходе которого сравнивались вилантерол/умеклидиниум (25/62,5 мкг 1 раз в сутки) и олодатерол/тиотропиум (5/5 мкг 1 раз в сутки) в группе симптоматических больных ХОБЛ (mMRC ≥2) 40 лет и старше (n=236) со среднетяжелой бронхиальной обструкцией (70% ≥ОФВ1 ≥50%), не получавших ИГКС (рис. 4). Авторами было показано, что эффективность вилантерола/умеклидиниума при оценке степени повышения конечного («наименьшего» или предбронхолитического) ОФВ1 к исходу 8-недельного лечебного периода (первичная «конечная точка») превосходила таковую олодатерола/тиотропиума на 41%: 180 и 128 мл соответственно (р<0,01), при этом различие в приросте у пациентов ранее не получавших базисной терапии («наивные» пациенты), было еще бóльшим и составляло 51% (р<0,01) в пользу комбинации вилантерол/умеклидиниум [44]. Как через 4, так и через 8 недель применение вилантерола/умеклидиниума по сравнению с олодатеролом/ тиотрпиумом сопровождалось более чем двукратным увеличением шансов минимального клинически значимого повышения ОФВ1 (≥100 мл): ОШ – 2,09 и 2,05 соответственно (р<0,001). Подобные различия в динамике суррогатного показателя бронхиальной проходимости корреспондировали с бóльшим в случае приема вилантерола/умеклидиниума приростом емкости вдоха (+39%), более демонстративным регрессом клинических симптомов и меньшей потребностью ситуационного применения бронходилататоров короткого действия: -0,94/сут против -0,68/сут (р<0,001).
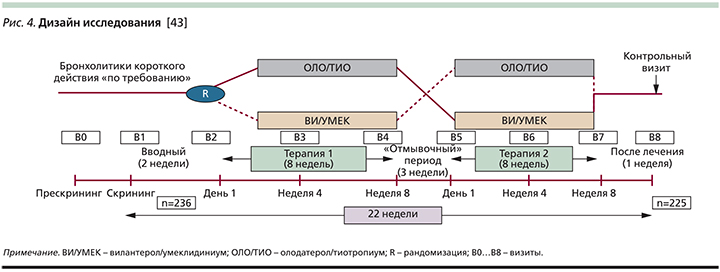
Очевидно, что результаты данного исследования следует принимать с известными оговорками ввиду отсутствия плацебо-контроля, относительно небольшой продолжительности лечебного периода (8 недель), открытого дизайна исследования и ряда других ограничений. Однако вывод авторов о существовании некоего «градиента эффективности» в ряду фиксированных комбинаций ДДБА/ДДХБ представляется вполне аргументированным и совпадает c выводами ранее проведенных непрямых сравнительных исследований [45].
Заключение
Таким образом, сегодня мы располагаем многочисленными свидетельствами того, что фиксированные комбинации ДДБА/ДДХБ обеспечивают оптимальную бронходилатацию и играют первостепенную роль в предотвращении обострений ХОБЛ. Превосходя плацебо и активный контроль (ДДБА, ДДХБ, ИГКС/ДДБА), комбинированные бронходилататоры могут отличаться по своему терапевтическому потенциалу, хотя имеющаяся доказательная база (неравнозначная по числу, масштабу и дизайну исследований), в т. ч. и единичные прямые сравнительные исследования, не позволяют сделать в каждом конкретном случае однозначный выбор в пользу той или иной фиксированной комбинации ДДБА/ДДХБ.
Впрочем, до некоторой степени острота дискуссии о «лучшей из возможных» фиксированных комбинаций ДДБА/ДДХБ может снизиться уже сейчас, и объясняется это выходом на авансцену фармакотерапии больных ХОБЛ тройных фиксированных комбинаций (ИГКС/ДДБА/ДДХБ), демонстрирующих новые возможности контроля над течением заболевания. Так, в частности, недавно были опубликованы результаты масштабного рандомизированного многоцентрового двойного слепого исследования в параллельных группах4, продолжавшегося 52 недели и включившего 10 355 больных с тяжелой/крайне тяжелой степенью бронхиальной обструкции и больных со среднетяжелой бронхиальной обструкцией, с историей перенесенных в течение предыдущего года нетяжелых/тяжелых обострений ХОБЛ [46]. При сравнении трех режимов терапии – флутиказона фуроат/вилантерол/умеклидиниум, 100/25/62,5 мкг 1 раз в сутки; флутиказона фуроат/вилантерол, 100/25 мкг 1 раз в сутки и вилантерол/ умеклидиниум, 25/62,5 мкг 1 раз в сутки – в группе пациентов, получавших тройную фиксированную комбинацию, была отмечена достоверно меньшая частота среднетяжелых и тяжелых обострений заболевания. Правда, при этом частота пневмонии в группах пациентов, получавших ИГКС в рамках двойной и тройной комбинаций, в 1,5 раза ожидаемо превосходила таковую по сравнению с таковой у пациентов, получавших ДДБА/ДДХБ.
Очевидно, накопление в ближайшей и среднесрочной перспективе данных из реальной клинической практики, дополненных результатами бóльшего числа прямых сравнительных исследований, облегчат врачу выбор «правильного препарата» для «правильного пациента» ХОБЛ.


