Введение
Инфекции дыхательных путей (ИДП) остаются основным показанием к назначению антибиотиков, – на их лечение приходится до 2/3 всех выписываемых антибактериальных препаратов [1]. С формальной точки зрения выбор антибиотика практикующим врачом, руководствующимся известными принципами рациональной антибактериальной терапии (АБТ), не должен представлять серьезных затруднений.
Принципы рациональной АБТ внебольничных ИДП [2, с изменениями]:
- Назначать антибиотики следует только в тех случаях, когда имеются доказательства или обоснованные подозрения на наличие бактериальной инфекции.
- Целесообразно использовать все многообразие доступных диагностических подходов с целью ограничения необоснованного назначения антибиотиков.
- Проводимая антибактериальная терапия должна обеспечить максимально возможное снижение микробной «нагрузки» на дыхательные пути или эрадикацию возбудителя.
- Следует использовать антибиотики с оптимальной для достижения эрадикации возбудителя фармакодинамикой.
- При выборе соответствующей АБТ необходимо учитывать данные мониторинга локальной антибиотикорезистентности потенциально патогенных возбудителей ИДП.
- Стоимость антибиотика(ов) зачастую оказывается несопоставимой с возможными последствиями терапевтической неудачи.
На практике же подобный выбор представляет немалые сложности, объясняемые в т.ч. и тем, что, несмотря на более чем 75-летнию историю клинического применения антибиотиков, лишь в отношении очень небольшого перечня инфекционных заболеваний была получена серьезная доказательная база, аргументирующая соответствующую продолжительность АБТ.
К сожалению, внебольничные ИДП – самые распространенные инфекционные заболевания современного человека – не относятся к их числу.
Между тем накопленные к настоящему времени свидетельства сопоставимой терапевтической эффективности коротких и длительных («традиционных») курсов АБТ бактериальных инфекций [3, 4] позволяют утверждать, что сокращение сроков приема антибиотика сопровождается уменьшением риска нежелательных лекарственных реакций, снижением вероятности селекции лекарственноустойчивых штаммов возбудителей, повышением приверженности больного врачебным рекомендациям и оказывается более экономичным [5–7].
Бактериологическая эффективность антибиотиков
Основное «предназначение» антибиотиков состоит в скорейшем достижении микробной эрадикации, или как минимум, – в значительном уменьшении пула делящихся потенциально патогенных микроорганизмов. Однако при проведении клинических исследований лишь в отдельных случаях (инфекции мочевых путей, стрептококковый фарингит/тонзиллофарингит, инфекции, передаваемые половым путем) удается надежно доказать бактериологическое выздоровление при повторном сборе исследуемых образцов. В повседневной клинической практике в отношении абсолютного большинства внебольничных инфекций доказательств эрадикации получить не удается. Вместо этого мы чаще говорим о предполагаемой эрадикации, основываясь на констатации клинического улучшения/выздоровления. Впрочем, данный подход имеет под собой известное основание. Так, в частности, при пневмококковой пневмонии обратное развитие симптомов заболевания, в т.ч. и стойкая апирексия, достигаемые в первые трое суток лечения, корреспондируют со снижением микробной нагрузки или даже с эрадикацией «виновного» возбудителя [8]. При ряде других инфекционных заболеваний бактериальная эрадикация также достигается достаточно быстро. Например, при инфекциях мочевых путей уже спустя 10 часов после однократного введения антибиотика наблюдается значимое падение выраженности бактериурии с 105 колониеобразующих единиц (КОЕ)/мл до 103 КОЕ/мл [9], а спустя 2–3 дня – эрадикация возбудителя [10]. При неосложненной гонорее эрадикация Neisseria gonorrhoeae достигается в ближайшие 48 часов от введения антибиотика [11]. При бактериальном менингите по прошествии 2 дней от начала клинически эффективной терапии спинномозговая жидкость становится стерильной [12]. В противоположность этому, при остром среднем отите (ОСО) для достижения эрадикации требуется более продолжительный временной промежуток, зависящий от возраста больного ребенка [13]. Эти примеры наглядно свидетельствуют о том, что скорость бактериологического выздоровления зависит от локализации инфекции, вида возбудителя, его чувствительности к назначаемому антибиотику, а также от факторов противоинфекционной защиты «хозяина». Несмотря на ограниченное число доказательств связи между клиническим и бактериологическим выздоровлением, на примере внебольничных ИДП (бактериальное обострение хронического бронхита), тем не менее удается продемонстрировать положительную линейную корреляцию между бактериологической неэффективностью проводимого лечения и терапевтической неудачей [14].
Для понимания роли и места стратегии коротких курсов АБТ весьма важно определение круга инфекционных заболеваний, требующих очень длительной терапии. К классическим примерам последних относятся туберкулез и бруцеллез, для эффективного излечения от которых требуются многие месяцы. Одним из возможных объяснений этого является тот факт, что такие внутриклеточные возбудители, как Mycobacterium и Brucella spp., локализуются в фаголизосомах, имеющих кислую среду, что в свою очередь обусловливает снижение активности большинства антибиотиков и, соответственно, значительное удлинение сроков лечения для достижения надежной эрадикации патогена [15, 16]. Короткие курсы АБТ неприемлемы также и при инфекционном эндокардите, что объясняется, в частности, высокой концентрацией микробов в вегетациях и плохой проницаемостью последних для антибиотиков [17]. Вегетации также не способны экспрессировать соответствующие антитела, а значит, иммунная система пациента не может усилить антимикробный эффект антибиотиков, направленный на эрадикацию возбудителя. В силу указанных обстоятельств короткие курсы АБТ не могут быть применены и у больных с серьезными нарушениями иммунитета.
Внебольничные инфекции верхних дыхательных путей
Знакомство с современными клиническими рекомендациями [18, 19] убеждает в том, что продолжительность приема антибиотиков никогда не относилась к числу приоритетных характеристик АБТ внебольничных инфекций верхних дыхательных путей (ИВДП) – стрептококкового тонзиллита/тонзиллофарингита, ОСО и максиллярного синусита/риносинусита. В противоположность этому, авторы указанных документов делали акцент на назначении антибиотиков выбора/альтернативы, основывающимся на вероятной этиологии заболевания, знании локальной антибиотикорезистентности, доказательствах клинической эффективности, безопасности и экологическом влиянии. Рекомендации же по длительности АБТ внебольничных ИВДП носили общий характер (табл. 1).

Справедливости ради следует сказать, что поиск ответа на вопрос, какова оптимальная длительность АБТ внебольничных ИВДП, затруднен тем обстоятельством, что данные респираторные инфекции характеризуются высокой частотой спонтанного выздоровления, а это в свою очередь ограничивает доказательства эффективности тех или иных режимов лечения при проведении сравнительных исследований «non-inferiority» [20, 21]. Здесь необходимо указать и на следующий немаловажный факт, а именно, в отличие от ОСО и риносинусита при стрептококковом тонзиллофарингите такая «конечная точка» оценки эффективности, как бактериальная эрадикация, более надежна и воспроизводима.
Авторы представленных в табл. 2 клинических исследований, кокрейновских обзоров и метаанализов единодушны в признании сопоставимой клинической и бактериологической эффективности коротких (5-дневных) и длительных/«традиционных» (7–10-дневных) курсов АБТ в лечении ОСО, стрептококкового тонзиллофарингита и острого риносинусита у детей и взрослых. Пожалуй, единственным исключением стали случаи ОСО у детей младше 2 лет и/или сопровождавшиеся эпизодами отореи, где удалось продемонстрировать превосходство «традиционной» 10-дневной терапии.
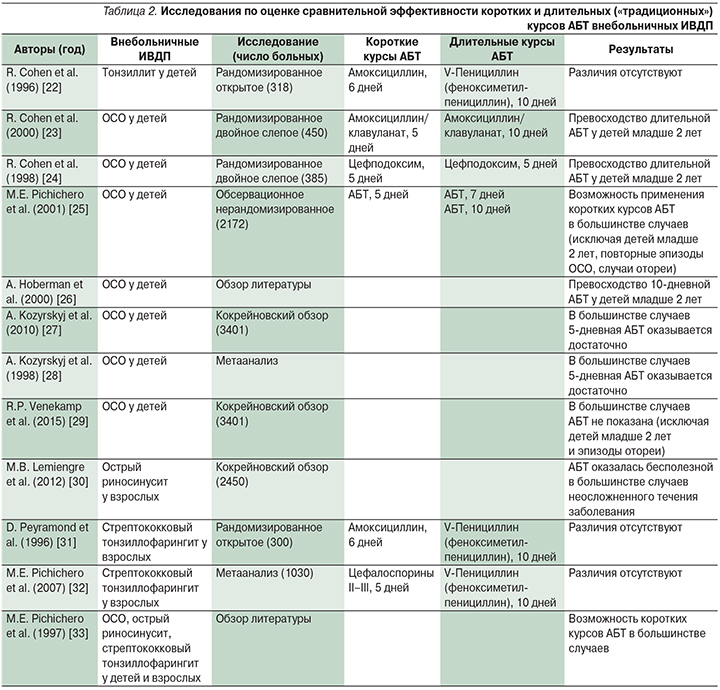
Внебольничные инфекции нижних дыхательных путей
На страницах современных рекомендаций мы встречаемся с достаточно противоречивыми высказываниями, касающимися длительности АБТ внебольничных инфекций нижних дыхательных путей (ИНДП) – обострения хронической обструктивной болезни легких (ХОБЛ) и внебольничной пневмонии (ВП). Так, в частности, эксперты Общества инфекционных болезней франкоговорящих стран предлагают при лечении обострений ХОБЛ 10-дневную АБТ [33], тогда как в опубликованной в 2018 г. очередной версии программы GOLD [34] речь идет о более лаконичной продолжительности лечения (≤7 дней). Впрочем, аргументация последних основывается на результатах всего лишь одного исследования, продемонстрировавшего сопоставимую бактериологическую и клиническую эффективность 5- и 7-дневной терапии левофлоксацином больных, переносящих обострение ХОБЛ [35].
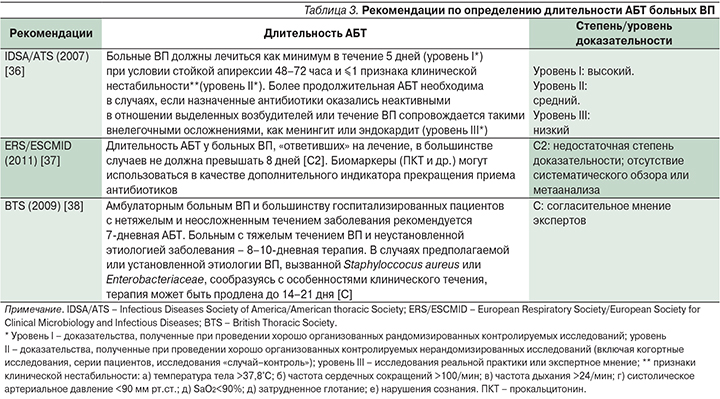
Вопрос об определении оптимальной продолжительности АБТ больных ВП также остается предметом оживленных дискуссий (табл. 3). При этом подчеркивается, что неадекватный/«избыточный» воспалительный ответ организма пациента на микробную инвазию может служить непосредственной причиной смерти, несмотря на достигнутую бактериальную эрадикацию [39]. Одновременно обращается внимание на то обстоятельство, что в ряду факторов риска селекции лекарственноустойчивых пневмотропных возбудителей наряду с применением низкодозных режимов АБТ важное место занимает необоснованно длительное лечение и, напротив, короткие курсы приема амоксициллина корреспондируют с меньшей вероятностью орофарингеального носительства Streptococcus pneumoniae по окончании приема антибиотика [40, 41].
Аргументируя возможности коротких курсов АБТ при обострении ХОБЛ, как правило, принято ссылаться на мета-анализ M.E. Falagas et al. [42], включавший 7 рандомизированный контролируемых исследований, объединенных сходным дизайном: в каждом из них применялся один и тот же антибиотик (фторхинолоны, цефиксим или кларитромицин), назначаемый в эквивалентной дозе в течение короткого (5 дней) и длительного/«традиционного» (7–10 дней) лечебного периода. Авторами была показана сопоставимая клиническая и бактериологическая эффективность сравниваемых режимов АБТ при достоверно меньшей частоте побочных эффектов в случаях короткого периода лечения.
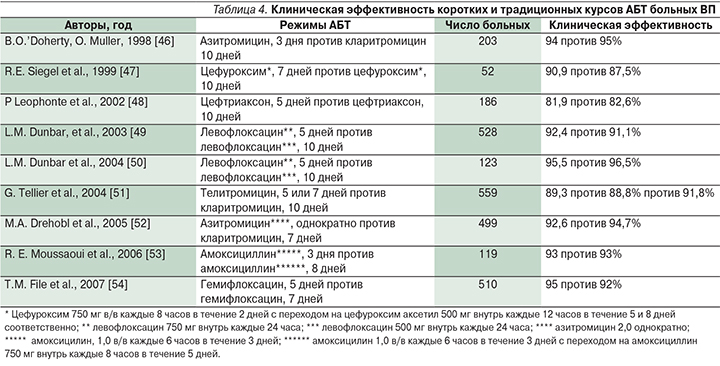
В противоположность обострению ХОБЛ за последние 20 лет были опубликованы многочисленные оригинальные исследования (табл. 4) и систематические обзоры/мета-анализы, свидетельствующие о сопоставимой клинической эффективности коротких и длительных/«традиционных» курсов АБТ (β-лактамы, макролиды, фторхинолоны) у больных ВП. Причем если поначалу акцент делался в основном на больных с нетяжелым течением заболевания, получавших лечение в амбулаторных условиях, то позднее речь шла уже и о госпитализируемых пациентах, в т.ч. и с тяжелой ВП [43–45].
Биомаркеры и длительность АБТ больных внебольничными ИДП
В последнее время для определения оптимальной длительности АБТ внебольничных ИДП с учетом динамики соответствующих клинических симптомов заболевания стали использоваться и биомаркеры (прежде всего прокальцитонин – ПКТ) [55]. Наибольший опыт в этом направлении накоплен в отношении больных ВП. При этом разработан своеобразный алгоритм, ориентируясь на который, врачу предлагается либо продолжить лечение, либо прекратить дальнейшее назначение антибиотиков (см. рисунок).

В настоящее время стали доступными результаты ряда масштабных исследований, в ходе которых длительность АБТ, ориентированная на повторно определяемые концентрации ПКТ, сравнивалась с принятой в повседневной клинической практике продолжительностью лечения. Так, в частности, в исследовании ProHOSP, где в качестве критерия рекомендованного назначения/продолжения приема антибиотиков принималась концентрация ПКТ ≥0,25 мкг/л; длительность ПКТ-ориентированной и «общепринятой» АБТ внебольничных ИНДП, в т.ч. и ВП, составила 5,9 и 7,4 суток соответственно [58]. Сходные результаты продемонстрированы и в ряде других рандомизированных клинических исследований [59–61].
В позднее выполненном исследовании SAPS, включившем пациентов с тяжелым/критическим течением инфекций (в т.ч. и респираторных), несмотря на меньшую длительность (7,5 и 9,3 дня соответственно), ПКТ-ориентированная АБТ характеризовалась меньшими показателями кумулятивной летальности на 28-й день (20 и 25% соответственно) и по прошествии 12 месяцев (36 и 43% соответственно) по сравнению со стандартными терапевтическими подходами [62].
Однако, несмотря на установленные закономерности между актуальной концентрацией ПКТ, длительностью АБТ, результатами лечения и исходами ВП, следует принимать во внимание и известные ограничения практики применения биомаркеров. Так, если при пневмококковой ВП концентрации ПКТ оказываются закономерно высокими [63], этого зачастую не наблюдается у больных «атипичной» пневмонией (в частности, микоплазменной) [64]. Помимо этого предшествующая АБТ, парапневмонический плеврит, локализованная инфекция (эмпиема плевры), начальная стадия заболевания и т.д. нередко сопровождаются низким уровнем ПКТ [65]. Напротив, неспецифическое повышение концентрации ПКТ в отсутствие бактериальной инфекции может иметь место в послеоперационном периоде, при остром нарушении мозгового кровообращения, грибковых инфекциях, малярии, у больных со злокачественными новообразованиями (например, при раке щитовидной железы, бронхогенной карциноме) [66–68].
Заключение
Трудно изменить глубоко укоренившиеся в сознании врачей и пациентов убеждения даже при наличии веских доказательств. Вера в то, что прекращение приема антибиотика на ранних стадиях инфекционного заболевания может приводить к селекции лекарственноустойчивых микроорганизмов, широко распространена как в профессиональном сообществе, так и на бытовом уровне [69, 70]. С другой стороны, хорошо известно, что необоснованная «антибиотическая агрессия» служит одной из основных причин формирования резистентности, хотя до недавнего времени в повседневной клинической практике редко рассматривали «надлежащее» применение антибиотиков как действенный инструмент ее предотвращения [71–74].
Между тем осознание того, что каждая принятая пациентом доза антибиотика повышает риск развития устойчивых к нему возбудителей склоняет к необходимости применения коротких курсов АБТ всякий раз, когда мы располагаем доказательствами эффективности и безопасности последних.
Сокращение продолжительности приема антибиотиков может значительно уменьшить воздействие на микробиоту человека, тем самым снизив риск селекции лекарственноустойчивых возбудителей и предотвратив суперинфекцию [75].
В амбулаторных условиях, где осуществляется лечение антибиотиками большинства бактериальных инфекций, в т.ч. и внебольничных ИДП, обеспечить надлежащий контроль за разумной и достаточной длительностью АБТ весьма сложно. И здесь ключевым фактором является обучение врачей с формированием у них культуры адекватной АБТ (по выбору препарата, его дозировки, пути введения и длительности применения) [76].
Таким образом, повседневная клиническая практика и результаты контролируемых исследований продолжают опровергать распространенную мантру о необходимости продолжения приема антибиотиков вплоть до полного разрешения симптомов инфекции, и на примере большинства внебольничных ИДП мы убеждаемся в сопоставимости клинических исходов при сравнении коротких и длительных /«традиционных» курсов АБТ.


