Актуальность
Начало XXI в. ознаменовалось содружественным ростом как числа оперативных вмешательств в экстренной и плановой абдоминальной хирургии, так и числом пациентов со спаечным процессом брюшины. Последний аспект по сути служит «миной замедленного действия» в плане развития острой спаечной кишечной непроходимости, что встречается в 30–67% случаев наличия спаечного процесса [1, 2]. Несмотря на бурное развитие анестезиолого-реаниматологической службы, внедрение программ ускоренной реабилитации, применение всего спектра малоинвазивных технологий, на сегодняшний день частота регистрации острого спаечного илеуса не имеет тенденции к снижению, а послеоперационная летальность может достигать внушительных цифр (8,1–22%) [3].
Возникновение внутрибрюшных висцеро-висцеральных и париетальных сращений возможно после любого трансперитонеального вмешательства: в пределах 67–93% после операций обшехирургического профиля и до 95–97% после гинекологических вмешательств, особенно при применении лапаротомного доступа [2, 4–6]. Важен рост материальных затрат на оказание специализированной помощи пациентов со спаечной болезнью брюшины, что сопряжено с необходимостью повторных, а порой многократных операций [7]. Имеются данные о ежегодно госпитализируемых 117 человек на 100 тыс. населения с общими затратами на их лечение в 1,3 млн долл. лишь только в США [4].
К сожалению, выполнение оперативного пособия на фоне спаечной кишечной непроходимости способствует осложнению раннего послеоперационного периода явлениями моторно-эвакуаторных нарушений в виде паралитического илеуса или ранней спаечной кишечной непроходимости. Риск вероятности рецидива спаечной болезни при проведении оперативного вмешательства возрастает при отеке кишечной стенки, явлениях «денудации» брюшины, необходимости объемного адгезиолизиса и возможной десерозации кишечной стенки, диапедеза из области спаечных сращений и создания плацдарма для неоадгезиоформации. Проведенные исследования убедительно доказали прямую связь между регистрацией пареза и ростом затрат на лечение подобных больных, что в числовом эквиваленте выражается в увеличении затрат на 8316 долл. на пациента при выполнении колоректальных хирургических операций [8]. Развитие динамической послеоперационной кишечной непроходимости приводит к пролонгации госпитального (порой и реанимационного) этапа лечения в 1,5–2 раза [9]. Суммарные ежегодные затраты на лечение подобных пациентов по оценочным данным превышают 750 тыс. долл. [9, 10].
Частота возникновения послеоперационных моторно-эвакуаторных нарушений пищеварительного зависит от многих факторов, в т.ч. от типа операции: операции с лапаротомным доступом и манипуляциями с петлями кишечника имеют большую вероятность развития пареза, чем операции с минимальной агрессией в брюшной полости (например, холецистэктомия) [11]. По мнению A. Artinyan et al. [8], независимыми факторами риска пареза следует считать объем интраоперационной кровопотери, суммарную дозу опиоидных анальгетиков, а также ожирение [12]. Риск развития динамических нарушений пищеварительного тракта повышается при наличии синдрома системной воспалительной реакции (p<0,01), коморбидности патологии (p=0,02), высокой степени анестезиологического риска (p=0,01), а также после операции с использованием открытого доступа [11]. Важно отметить, что пациенты с явлениями острой кишечной непроходимости имеют статически более высокий риск развития динамической послеоперационной кишечной непроходимости [11, 13].
Приведенные выше данные диктуют необходимость не только лечения непосредственно спаечной болезни, осложненной острой спаечной тонкокишечной непроходимостью, но и профилактики и терапии моторно-эвакуаторных нарушений пищеварительного тракта в послеоперационном периоде.
Целью настоящего исследования стала оценка эффективности резонансной электростимуляции перистальтической активности пищеварительного тракта в комплексной коррекции моторно-эвакуаторных нарушений у пациентов в послеоперационном периоде после устранения острой неопухолевой тонкокишечной непроходимости.
Методы
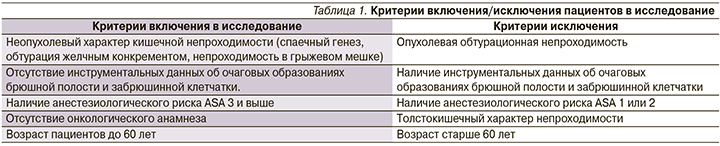
В ходе работы был подвергнут анализу исход лечения 65 пациентов за 2015–2018 гг., находившихся на стационарном лечении в хирургических клиниках кафедры хирургических болезней и клинической ангиологии ФГБОУ ВО МГМСУ им. А.И. Евдокимова. Все пациенты, включенные в исследование, удовлетворяли критериям включения и исключения (табл. 1). Критерием невключения в исследование считался письменный отказ пациента. Опухолевый характер кишечной непроходимости был не случайно выбран противопоказанием к включению в исследование, т.к. выполняемая операция (с учетом онкологических принципов) требует проведения должного объема лимфодиссекции, а также не всегда позволяет завершить операцию без колостомии. Последние аспекты служат отягощающим неспецифическим фактором в развитии динамического пареза [11] и не позволяют осуществлять объективизацию данных на малой выборке больных.
Среди анализируемых пациентов отмечено преобладание лиц мужского пола (соотношение – 1,5:1), средний возраст – 53,4±3,7 года. Параметр «возраст» намеренно был выбран нами как один из критериев включения/исключения, согласно дизайну исследования, т.к. для возрастных коморбидных пациентов с исходными нарушениями микроциркуляции кишечной стенки крайне трудно оценивать эффективности той или иной процедуры по профилактике/лечению пареза. У большинства пациентов (n=62; 95,4%) в анамнезе имелись трансперитонеальные вмешательства (в среднем 2,3±1,1 операции на человека). У пациентов с вентральными грыжами средний размер грыжевых ворот составил 8,3±2,4 см, анамнез грыженосительства у всех больных превышал 3 года. При герниолапаротомии на завершающем этапе операции при исходных размерах грыжевых ворот более 5 см в диаметре (все пациенты) выполнялась ненатяжная герниопластика аллотрансплантатом.
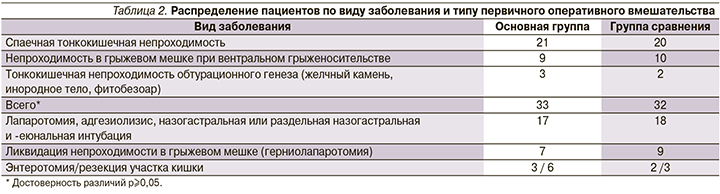
С целью объективизации данных для адекватного анализа нами было выделено 2 группы исследования: основная (n=35, оценивалась за 2017–2018 гг.) и группа сравнения (n=32, анализ за 2015–2016 гг.). Обе группы были соизмеримыми по возрасту, полу и тяжести состояния. Распределение пациентов по виду заболевания и характеру выполненного оперативного пособия представлено в табл. 2.
При поступлении у всех пациентов были отмечены клинические признаки острой тонкокишечной непроходимости. Предоперационная подготовка, тактика и лечение осуществлены согласно установленным нормативным документам (приказ № 320 до 01.2017 включительно, с 02.2017 приказ № 83 ДЗ г. Москвы). В рамках предоперационной подготовки производилась манометрия внутрибрюшного давления (ВБД) трансвезикально по методу I.L. Kron et al. [14]. Уровень и степень внутрибрюшной гипертензии оценивался по 4-степенной классификации Всемирного общества по изучению абдоминального компартмент-синдрома (WSACS) [15]. На основании полученных значений ВБД проводились расчеты абдоминального перфузионного давления (АПД): дельта между средним артериальным давлением и ВБД. Полученные параметры ВБД и АПД представлены в табл. 3.

Все больные были оперированы после обследования и адекватной предоперационной подготовки. Виды проведенных операций представлены в табл. 2. Оперативное вмешательство завершалось установкой назогастрального зонда в 100% наблюдений, а установка назоеюнального зонда выполнена 26 (78,8%) пациентам основной группы и 25 (78%) группы сравнения (p≥0,05). Остальным больным дополнительное шинирование тонкой кишки на основании интраоперацинной картины признано непоказанным.
В основной группе в послеоперационном периоде для коррекции пареза кишечника, профилактики прогрессирования внутрибрюшной гипертензии, стимуляции перистальтической активности желудочно-кишечного тракта (ЖКТ) проводились сеансы резонансной электростимуляции аппаратом «Резонансный стимулятор ЖКТ» [патент РФ № 2062126] с регистрацией колебательных спектров на «селективном полиграфе ЖКТ» [патент РФ № 2023419] в виде графиков динамики активности основных отделов ЖКТ и/или спектров (рис.1 а–в) [16]. В группе сравнения выполнялась регистрация колебаний перистальтической активности без выполнения электростимуляции.
Через 6–8 часов после выполнения оперативного пособия выполнена аппликация электродов на переднюю брюшную стенку в проекции обоих фланков живота. Регистрация собственной перистальтической активности (т.н. фоновый режим; рис. 1 а, в) выполнялась в течение 5–10 минут, после чего начиналась электростимуляция токами до 12 мА транскутанно на все отделы пищеварительной трубки (рис. 1б). Данная процедура производилась последовательно (желудок→дуоденум→тонкая кишка→толстая кишка) до достижения синхронизации всех спектров колебаний перистальтической активности [патент РФ № 2648819]. Длительность и кратность подобной терапии оценивались в динамике лечения.

В послеоперационном периоде до стабилизации состояния больные несколько суток находились в отделении реанимации, в последующем – в отделениях госпитального профиля. Лечение соответствовало общепринятым стандартам терапии больных острой кишечной непроходимостью: инфузионно-дезинтоксикационное лечение, энтеральный лаваж через установленный желудочный или интестинальный зонд спустя 12–24 часа с момента оперативного пособия [17], рациональную антибиотикотерапию, обезболивание, раннюю активизацию пациентов.
Для объективизации данных производился анализ визуально-аналогового шкалирования (ВАШ) в послеоперационном периоде [18]. Оценка по ВАШ осуществлена по шкале от 0 до 10, где крайние точки представляют наихудшее и наилучшее самочувствие соответственно. Статистическая обработка полученных цифровых данных осуществлена с использованием пакета программ «Microsoft Word 2010» и «Microsoft Excel 2010».
Полученные в ходе исследования данные обработаны статистически с расчетом средней арифметической (М), и средней ошибки (m). Количественные параметры сравнивали с использованием t-критерия достоверности.
Результаты
Всем пациентам обеих групп в раннем послеоперационном периоде (спустя 6–8 часов после завершения операции) проведена оценка моторно-эвакуаторной функции пищеварительного тракта методом селективной полиграфии с регистрацией четырех кривых, соответствующих желудочной, дуоденальной, тонко- и толстокишечной пропульсивной активности. Отмечена активность возбудимых структур (до 10,2±2,5 мкВ) с единичными хаотичными колебаниями.
В группе сравнения после регистрации исходной активности реализовывался стандартный протокол ведения пациентов после операции ликвидации острой кишечной непроходимости. В основной группе после проведения селективной полиграфии в рамках комплексной терапии послеоперационного периода последовательно проведена резонансная стимуляция на все структуры пищеварительного тракта.
По результатам селективной полиграфии в ходе проведения стимуляции были получены ответы возбудимых структур всех отделов пищеварительного тракта с достижением амплитуды вызванных сигналов до 48,3 мкВ с синхронизацией спектров всех отделов и сохранением активности в фоновых режимах стимуляции. На фоне лечения отмечена достоверная разность значений групп резонансной стимуляции и сравнения при регистрации колебательных спектров в фоновых режимах (табл. 3). Кратность резонансной терапии составила в среднем 3,9±1,2 сеанса с длительностью каждого сеанса от 48 до 170 минут (95±32 минуты). Важно отметить, что анализ кривых по данным селективного полиграфа ЖКТ позволил убедиться в адекватности проводимого лечения, ликвидации физиологического послеоперационного пареза, возможности активизации пациентов и проведения нутритивной пероральной поддержки в стандартных режимах, т.е. прекращения энтерального лаважа.

Во всех наблюдениях основной группы к исходу 72 часов лечения получено свободное отхождение газов, а также самостоятельный стул, в то время как в группе сравнения лишь 23 (71,8%) пациента удовлетворяли этому критерию (p≤0,05). Соответственно клинической картине энтеральный лаваж проводился на протяжении 3,1±1,2 и 5,3±0,7 суток в основной и в группе сравнения соответственно. В дальнейшем энтеральная поддержка проводилась введением питательных смесей и хирургических столов во всех группах.
Полное восстановление моторно-эвакуаторной функции пищеварительного тракта, а именно: отсутствие вздутия и метеоризма, ретроградного сброса по желудочному/назоеюнальному зонду, активная аускультативно и электрогастроэнтерографически регистрируемая перистальтика, отхождение газов и самостоятельный регулярный стул, в основной группе отмечено к 5-м суткам лечения у 33 (100%) пациентов, что достоверно отличалось от тождественных параметров группы сравнения (n=26; 81,25%; p≤0,05).
Одним из методов оценки эффективности проводимой терапии и, следовательно, резонансной стимуляции стало ВБД как исходно, так и в динамике лечения (табл. 3) на 1-е, 3, 5, и 7-е сутки (последний аспект не анализировался, т.к. основная масса пациентов основной группы была к тому моменту выписана из стационара в удовлетворительном состоянии с нормальными показателями ВБД). Расчет показателей АПД также проводился в вышеуказанные временные промежутки, при этом отмечалась статистически достоверная диссоциация показателей при сравнении изучаемых групп. Более быстрая ликвидация синдрома внутрибрюшной гипертензии закономерно улучшала спланхнический кровоток, интестинальную перфузию, что уменьшало риск как послеоперационных моторно-эвакуаторных нарушений, так и иных послеоперационных осложнений.
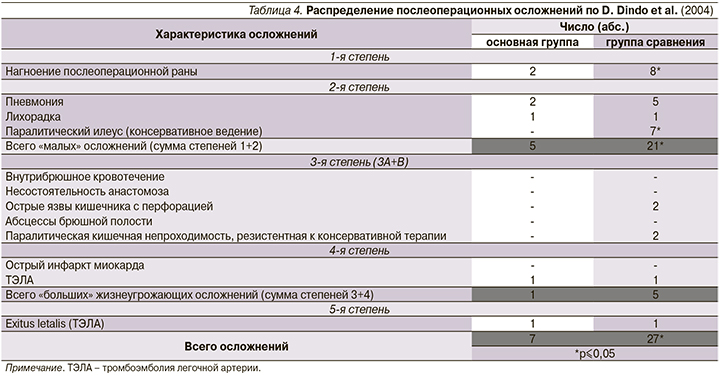
Послеоперационные осложнения в исследуемых группах анализировались согласно классификации осложнений по Clavien–Dindo [19] (табл. 4). При этом отмечено достоверно большее количество нагноительных раневых осложнений (р≤0,05), а также прирост доли вентиляционных нарушений в виде пневмоний в группе сравнения. Подобное распределение можно трактовать как нарушение перфузии тканей с микроциркуляторной недостаточностью, а также нарушение экскурсии диафрагмы ввиду более высоких параметров ВБД у данных пациентов в отличие от основной группы. Четверым пациентам группы сравнения (12,5%) потребовалось проведение релапаротомии: в двух случаях ввиду резистентной к лечению паралитической кишечной непроходимости; в двух наблюдениях по поводу перфораций острых язв тонкой кишки. В основной группе реопераций не проводилось. Явления паралитического илеуса, а также осложнения послеоперационного периода в виде формирования острых язв следует трактовать как проявление локальной спланхнической гипоперфузии, что коррелирует с параметрами АПД в группе сравнения в отличие от высоких параметров данного показателя в основной группе (р≤0,05).
Экспозиция нахождения назоинтестинальных зондов в основной группе составила 3,1±1,2 суток, в группе сравнения – 5,3±0,7 (p≤0,05). Дренажи из брюшной полости в основной группе удалены к 3-м, в группе сравнения – к 4–6-м суткам. Длительность послеоперационного стационарного лечения в группе сравнения была достоверно выше (9,3±1,3 суток), чем в основной группе (6,2±0,8; p≤0,05).
При анализе утилитарных показателей ВАШ в обеих группах отмечена более торпидная динамика в группе сравнения в отличие от основной, что позволяет указывать на субъективно лучшее самочувствие самих пациентов (рис. 2), хорошую переносимость ими методики резонансной стимуляции (отмечено отсутствие дискомфорта под электродами, субъективное улучшение самочувствия). Зарегистрирована достоверная диссоциация утилитарных показателей в пользу основной группы (p≤0,05). В обеих группах было зарегистрировано по одному летальному исходу: в обоих случаях явления массивной ТЭЛА в раннем послеоперационном периоде.
Обсуждение
Проблема лечения послеоперационных моторно-эвакуаторных нарушений представляется крайне актуальной и злободневной, особенно в свете увеличения абсолютных цифр количества оперативных пособий не только в плановой, но и ургентной абдоминальной хирургии [8–10]. При этом значительную долю составляют операции по ликвидации острой неопухолевой тонкокишечной непроходимости, где основную массу вмешательств сопровождает адгезиолизис, а значит, риск отека кишечной стенки с моторными нарушениями в раннем послеоперационном периоде или неоадгезиогенез с отдаленными осложнениями [1, 2, 4, 5].
На сегодняшний день следует признать многофакторность патогенеза послеоперационных моторно-эвакуаторных нарушений. Среди прочих причин именно лапаротомию, сопровождающуюся манипуляциями на тонкой и толстой кишке, в т.ч. с формированием межкишечных соустий, следует относить к операции высокого риска развития послеоперационного пареза кишечника [11]. Крайне важно указать на то, что именно выбор способа оперирования играет существенную роль в риске моторно-эвакуаторных послеоперационных нарушений, в то время как конституциональные особенности, длительный прием опиоидных анальгетиков, а также степень и объем интраоперационной кровопотери служат независимым фактором риска пареза [8, 11, 12], особенно при острой кишечной непроходимости.
В приведенной работе нами изучена роль электрофизиологических методов не только в мониторинге, но и в терапии послеоперационного пареза и синдрома внутрибрюшной гипертензии после ликвидации явлений неопухолевой тонкокишечной непроходимости открытым лапаротомным способом. Использование явления резонанса для создания безопасного способа воздействия на кишечную стенку объясняется его универсальностью. Резонанс как частное физическое явление может возникать при взаимодействии источника возмущений с практически любой сложной системой, а резонансный отклик можно обнаружить и в каждом внутреннем органе, включая пищеварительную трубку [16]. Так, в ходе проведенного исследования получено достоверное различие вольтажа осцилляций на 5-е сутки лечения между исследуемыми группами, при этом уже с первого сеанса применения электрофизиологического воздействия в основной группе имелся существенный прирост амплитуды колебательных волн (табл. 3). Прослеживаемая динамика прироста осцилляций графически доказывается и клиническими данными: аускультивные кишечные шумы, отхождение газов, сроки получения самостоятельного стула. По указанным параметрам имелась статичестически достоверная преференция основной группы над группой сравнения (р≤0,05).
Немаловажную роль в определенной объективизации вышеизложенного материала следует отводить шкалированию послеоперационных осложнений, что наглядно иллюстрируется шкалой по Clavien–Dindo (табл. 4) [19]. Большее количество нагноительных раневых осложнений (р≤0,05), а также дыхательных нарушений и явлений послеоперационного пареза (р≤0,05) в группе сравнения при исходно унифицированной технике оперирования и послеоперационного менеджмента позволяет выделять именно резонансную терапию как фактор минимизации рисков подобных осложнений в основной группе.
Безусловно, не само электрофизиологическое воздействие следует рассматривать как первопричину минимизации осложнений. В данном случае под действие более быстрого восстановления моторно-эвакуаторной функции достигалась редукция внутрибрюшного давления, уменьшалась компрессия диафрагмы и доля вентиляционных нарушений, быстрее восстанавливалась адекватная интестинальная перфузии, а также микроциркуляция в передней брюшной стенке. На быструю ликвидацию ишемии и адекватность спланхнического кровотока указывает также отсутствие таких осложнений, как перфорация острых язв кишечника в послеоперационном периоде в основной группе. Таким образом, восстановление моторики пищеварительной трубки под воздействием резонансной стимуляции позволяло компенсировать мультиорганные физиологические «дефекты» и «поломки», способствуя ускоренной реабилитации пациентов.
Важной оценочной единицей следует считать комплаенс самих пациентов к проводимому лечению и тем или иным лечебным процедурам и методам [18]. Так, в ходе исследования получена достоверная диссоциация утилитарных показателей визуально-аналогового шкалирования в сравниваемых группах в пользу основной, что указывает на целесообразность селективной резонансной стимуляции в комплексной послеоперационной терапии после ликвидации явлений кишечной непроходимости.
Заключение
Полученные данные указывают на высокое прогностическое значение динамического контроля за периодом восстановления пропульсивного пассажа химуса по пищеварительному тракту в раннем послеоперационном периоде после устранения явлений острой кишечной непроходимости. Применение резонансной электростимуляции в комплексном ведении послеоперационного периода способствует нормализации перистальтики, восстановлению пассажа кишечного содержимого по пищеварительному тракту, скорейшей нормализации внутрибрюшной гипертензии и профилактике полиорганной недостаточности.
Считаем возможным рекомендовать резонансную электростимуляцию пищеварительного тракта в качестве эффективной меры профилактики и терапии моторно-эвакуаторных нарушений в послеоперационном периоде.


