Введение
Ранняя диагностика и профилактика диффузных заболеваний печени (ДЗП) считаются приоритетным направлением современной гастроэнтерологии в связи с высоким потенциалом заболеваний печени хронизироваться и прогрессировать, а также приводить к печеночной недостаточности и служить основной причиной смертности среди заболеваний органов пищеварения. Так, по показателю смертности населения в Северо-Западном федеральном округе Российской Федерации (РФ) за 2017–2018 гг. патология органов пищеварения занимает третье место после болезней системы кровообращения и злокачественных новообразований, а при анализе смертности в группе «Заболевания органов пищеварения» болезни печени занимают 1-е место, являясь причиной летальных исходов в различных регионах СЗФО РФ в 45–55% случаев.
Современная тенденция заключается в том, что патология печени выходит на лидирующие позиции по распространенности среди лиц трудоспособного возраста. Структура ДЗП разнообразна и включает такие патологии, как вирусные гепатиты В и С, неалкогольная жировая болезнь печени (НАЖБП), аутоиммунные и лекарственные поражения печени. Большинство из них имеет прогрессивное течение, итогом которого становится развитие фиброза с дальнейшим формированием цирроза печени, высокими шансами гепатоцеллюлярной карциномы. Зачастую ДЗП протекают бессимптомно, ранняя диагностика, а как следствие – и своевременная адекватная терапия приведут пациентов данной группы к сокращению необратимых последствий. Частота заболеваний печени, как ожидается, будет продолжать расти в течение следующего десятилетия, в связи с чем прогнозируется увеличение когорты пациентов с циррозом печени [1, 2].
По данным литературы, около 2 млрд человек в мире страдают вирусными гепатитами, несмотря на развитие медицины, появление на рынке новых противовирусных препаратов, вакцинопрофилактики. Сотни миллионов людей страдают хроническим гепатитом В, более 200 тыс. человек в году умирают от цирроза печени в его исходе [3, 4]. В среднем около 3% населения мира (120–130 млн) инфицированы вирусным гепатитом С. Такие статистические данные формируются в основном за счет стран с высоким эпидемиологическим порогом – более 20% инфицированных. По данным Всемирной организации здравоохранения (ВОЗ), ежегодно регистрируется около 3–4 млн новых случаев HCV-инфекции [5, 6].
По распространенности НАЖБП доминирует среди ДЗП [7]. Чаще всего НАЖБП имеет доброкачественный характер, но с жировой дистрофией печени могут быть связаны и серьезные изменения: воспалительный процесс, затрагивающий гепатоциты, развитие неалкогольного стеатогепатита (НАСГ) у 20–30% пациентов [8]. Эти пациенты подвержены большему риску развития фиброза, 1/5 случаев подобных процессов в печени прогрессирует в цирроз [8]. Скорость наступления необратимых фиброзных трансформаций в печени меньше при сравнении с другими хроническими заболеваниями печени, такими как токсические (алкогольные) или вирусные поражения [9]. Однако по причине высокой распространенности НАЖБП декомпенсированные циррозы печени в исходе этой проблемы третьи среди причин для трансплантации печени в США [10].
Первичный билиарный холангит, первичный склерозирующий холангит и аутоиммунный гепатит составляют группу классических аутоиммунных заболеваний печени (АЗП). Каждое из АЗП связано с определенными эпидемиологическими и клиническими характеристиками. Однако перекрестные синдромы, сочетание более чем одного АЗП встречаются все чаще [11].
Одной из основополагающих задач современной гастроэнтерологии является выявление пациентов с ДЗП на ранних стадиях патологического процесса. «Золотым» стандартом диагностики ДЗП традиционно считается биопсия. Однако за последние 20 лет стало очевидным, что этот метод несовершенен; даже по мнению его сторонников, он остается только «лучшим» среди доступных методов.
Попытки найти неинвазивные диагностические средства дали множество оценок, формул, шкал и методов визуализации, безопасных, более приемлемых для пациента и могут повторяться так часто, как требуется, в т.ч. и для динамического контроля, в связи с чем в большинстве стран число выполняемых пункционных биопсий печени сократилось. Однако точность и диагностическая ценность большинства, если не всех этих методов, остаются спорными [12]. Бóльшая часть современных неинвазивных методов диагностики не дает информации о состоянии метаболизма и эффективности дезинтоксикационного процесса в печени.
В связи с вышеперечисленным актуальным становится использование методов, способных определять даже минимальные отклонения функциональной активности печени. Одним из них является 13С-метацетиновый дыхательный тест (13С-МДТ), обладающий высокой чувствительностью (до 92,6%) и специфичностью (до 85%), по данным Kibion-Wagner [13], способный оценить скорость и объем метаболизма в системе CYP450 в печени.
Высокая распространенность ДЗП, отсутствие в России методов неинвазивной оценки функционального резерва печени стали поводом для проведения данного исследования.
Цель исследования: оценить потенциал 13С-МДТ у пациентов с ДЗП различной этиологии и определить дополнительные возможности для проведения дифференциальной диагностики между ними.
Методы
Дизайн – исследование серии случаев. Оценка результатов 13С-МДТ проведена в отношении 88 пациентов (по 50% мужчин и женщин) с ДЗП различной этиологии. Средний возраст пациентов составил 49,4±13,4 года.
В исследовании приняли участие пациенты, последовательно обратившиеся за консультативной помощью с 2016 по 2018 г. Критерием включения в исследование стало наличие установленного ранее диагноза хронического заболевания печени на основании результатов комплексного обследования в соответствии с существующими международными и российскими стандартами; критерии исключения – возраст старше 80 лет, острый гепатит различной этиологии, наличие ВИЧ-инфекции, тяжелая коморбидная патология.
Обследование пациентов проведего амбулаторно, а также в условиях стационара на базе клиники кафедры пропедевтики внутренних болезней, гастроэнтерологии и диетологии Северо-Западного государственного медицинского университета им. И.И. Мечникова.
Всех пациентов подвергли физикальному обследованию с акцентом на состояние органов пищеварения. Выяснили жалобы, анамнез (длительность заболевания, наследственность, прием алкоголя, лекарственных препаратов, сопутствующую патологию), объективно оцениили состояние печени (размеры, однородность, плотность, край, болезненность и т.д.), наличие «внепеченочных» знаков.
Включенным пациентам выполнено стандартное обследование. Клинический анализ крови включил определение числа эритроцитов и тромбоцитов, гемоглобина. Биохимический анализ крови предполагал определение билирубина и его фракций, активность аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы, γ-глутамилтранспептидазы, уровня общего холестерина (ОХ), триглицеридов. С помощью неинвазивного метода ФиброМакс определена степень фиброза печени.
Для оценки микросомального окисления в печени и определения функционального резерва печени исследуемым был выполнен 13С-МДТ по стандартной методике. В процессе выполнения теста получено десять дыхательных проб: исходная, до приема тестового завтрака в виде 75 мг 13С-метацетина, растворенного в 200 мл воды; 6 проб в течение первого часа (каждые 10 минут) и 3 – в течение второго часа (каждые 20 минут). Анализ образцов проведен с использованием инфракрасной масс-спектрометрии, с помощью ИК-газоанализатора (IRIS, Германия), результаты представлены в графической форме, отражавшей прирост 13С в выдыхаемом воздухе.
При выполнении исследования получено по 10 образцов выдыхаемого воздуха от каждого пациента, включенного в исследование. Выводы об отсутствии или наличии нарушения функции печени осуществлены на основании сопоставления кривой суммарной концентрации 13СО2 к исходу 120-й минуты исследования с кривыми, полученными при обследовании здоровых добровольцев, показателей верхней и нижней границ нормы. При определении нарушения функционального резерва печени осуществлена оценка степени нарушений: легкая, умеренная, тяжелая и крайне тяжелая, в зависимости от уровня кумулятивной дозы к 60-й и 120-й минуте исследования (Cum. dose 60, Cum. dose 120), а также скорости метаболизма 13C-метацетина на 20-й минуте (DOB-20, delta over base).
Проведена оценка уровня тромбоцитов как проявление возможного гиперспленизма и снижения синтетической функции печени, определение корреляционных связей между отклонением от референсных значений биохимических показателей (АЛТ, АСТ, общий билирубин) с изменением основных показателей 13С-МДТ.
Для решения задачи поиска эффективного ресурса осуществления дифференциальной межэтиологической диагностики сформированы отдельные группы, сопоставимые по полу и возрасту: пациенты с вирусными гепатитами В и С, НАЖБП, АЗП, а также группа пациентов с поражениями печени смешанного генеза.
Для всех пациентов определена степень фиброза печени при помощи неинвазивного теста – ФиброМакса, разработанного BioPredictive (Франция) и защищенного международным патентом № 1311857, выданным European Patent Office 01.03.2006. Тестовая система ФиброМакс состоит из 5 расчетных алгоритмов и выполняется по результатам математической обработки 10 биохимических показателей крови: α2-макроглобулин, гаптоглобин, аполипопротеин А1, γ-глутамилтрансфераза, общий билирубин, АЛТ, АСТ, триглицериды, ОХ и глюкоза.
Основными показателями 13С-МДТ определены величины кумулятивной дозы 13СО2, которые отражают процент накопленного в выдыхаемом воздухе меченого 13СО2 за 60 и 120 минут; DOB-20, отражающий подъем величины 13СО2 выдыхаемого воздуха на 20-й минуте над базальным уровнем (до приема 13С-метацетина).
Все пациенты – участники исследования подписали информированное согласие, а также согласие на обработку персональных данных. Исследование одобрено на заседании № 10 Локального этического комитета ГБОУ ВО СЗГМУ им. И.И. Мечникова от 09.11.2016.
Статистическая обработка данных выполнена с использованием программы SPSS-ver.22. Характер распределения количественных признаков определен методом Колмогорова–Смирнова. В случае нормального распределения вычислены среднее значение (М) и стандартная ошибка среднего (m). Статистическую значимость различий показателей оценивали по критериям Стьюдента, Пирсона (при нормальном распределении), в случаях отклонения распределения от нормального использованы непараметрические критерии (U-критерий Манна–Уитни, критерий Колмогорова–Смирнова, χ2-критерий). Связи между признаками оценены путем вычисления коэффициента корреляции Спирмена (r). Во всех процедурах статистического анализа критический уровень значимости нулевой гипотезы (p) принят равным 0,05.
Результаты исследования
Структура обследуемой когорты пациентов в зависимости от этиологии ДЗП выглядела следующим образом: группа пациентов с вирусным поражением печени оказалась наибольшей (что соответствует структуре заболеваемости ДЗП, по данным литературы) – 53 (60%) всех обследованных больных; группа НАЖБП и заболеваний смешанной этиологии – по 13 (14,8%) в каждой группе; группа с аутоиммунными причинами поражения печени наименьшей – 9 (10,2%; рис. 1).

Среди 53 пациентов с верифицированным диагнозом вирусного гепатита (HBV или HCV) отмечено равномерное гендерное распределение (27 мужчин и 26 женщин), средний возраст составил 46,3±13,3 года. В группе с НАЖБП (n=13) средний возраст был выше 56,7±15 лет, гендерное распределение сохранялось симметричным (мужчин 7, женщин 6). В группе АЗП (n=9), включившей аутоиммунный гепатит, первичный билиарный холангит или их перекрест, преобладали женщины (n=8), средний возраст составил 55±7,4 года. В группе пациентов с патологией печени смешанного генеза (НАЖБП в сочетании с вирусным, токсическим гепатитом либо АЗП), напротив, преобладали мужчины (10 из 13), средний возраст – 50,8±12,2 года.
 У 88 (73,9%) обследованных пациентов констатирован фиброз разной степени выраженности (рис. 2). В 50 (77%) случаях выявленный фиброз соответствовал критериям умеренного (F1–2), в 15 (23%) – выраженного фиброза (F3–4).
У 88 (73,9%) обследованных пациентов констатирован фиброз разной степени выраженности (рис. 2). В 50 (77%) случаях выявленный фиброз соответствовал критериям умеренного (F1–2), в 15 (23%) – выраженного фиброза (F3–4).
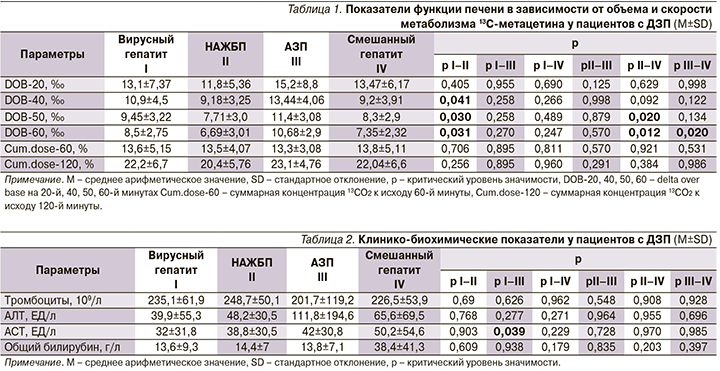
В анализируемых группах показатели функции печени в зависимости от объема и скорости метаболизма 13C-метацетина у пациентов с ДЗП были ниже у пациентов с НАЖБП по сравнению с другими (табл. 1).
В целом не установлено ассоциативной связи между уровнем снижения числа тромбоцитов и этиологией ДЗП, повышение уровня АСТ было статистически значимо бóльшим у пациентов с АЗП, чем с вирусными гепатитами (р=0,039). Клинико-биохимические показатели при различных ДЗП суммарно представлены в табл. 2.
Установлено, что число тромбоцитов в группе с вирусными гепатитами прямо коррелирует со скоростью метаболизма 13С-метацетина по значению DOB-20 (r=0,374, p=0,021). При этом у пациентов с ДЗП смешанного генеза отмечена обратная корреляционная связь уровня АСТ с объемом – кумулятивная доза на 60-й и 120-й минутах (r=-0,732; р=0,010 и r=-0,716; р=0,013 соответственно) и скоростью метаболизма 13С-метацетина к 20-й минуте (r=-0,759; p=0,010).
Вместе с тем оказалось, что значение DOB-20 в группе с вирусными гепатитами прямо связано с кумулятивной дозой к 60-й и 120-й минутам (r=0,875; р<0,0001 и r=0,692; р<0,0001 соответственно). Подобный характер связей выявлен и в отношении НАЖБП (r=0,947; р<0,0001 и r=0,815; р=0,001 соответственно).
За время проведения исследования побочных эффектов, связанных с выполнением 13С-МДТ, не зафиксировано.
Обсуждение
Необходимость в ранней диагностике ДЗП в условиях отсутствия таковых либо имевшихся существенных недостатков дает мощный толчок к развитию в этом направлении. В частности, внедрение в рутинный диагностический алгоритм 13С-МДТ, который отличается высокой эффективностью в оценке функциональных возможностей печеночной паренхимы [13].
Полученные данные о корреляции между уровнем тромбоцитов и скоростью метаболизма 13С-метацетина при вирусных гепатитах, вероятно, связаны с более выраженными нарушениями функции печени, быстрым прогрессированием фиброза, а также снижением выработки тромбопоэтина гепатоцитами в условиях гепатодепресии [14, 15].
Выявленные статистически значимые отличия по объему и скорости метаболизма 13C-метацетина между пациентами с НАЖБП и пациентами с вирусными гепатитами и заболеваниями печени смешанного генеза позволяют говорить о возможности использования метода для дифференциальной диагностики при ДЗП. Вероятно, полученные результаты указывают на специфические нарушения микросомального окисления при НАЖБП [16]. Таким образом, 13С-МДТ не только дает возможность получать информацию о функциональном резерве печени, но и расширяет возможности этиологической диагностики заболеваний печени.
В исследовании была впервые выявлена тесная прямая корреляционная связь между показателями DOB-20 и кумулятивной дозой 13С-МДТ уже на 60-й минуте у пациентов с вирусными гепатитами и НАЖБП. Ранее такая взаимосвязь отмечалась при исследованиях пациентов с вирусными гепатитами только на 120-й минуте [17], что, вероятнее всего, связано с увеличением выборки в нашем исследовании. Полученные данные дают возможность для обсуждения вопроса о сокращении времени проведения 13С-МДТ.
В целом полученные результаты указывают на возможность использования 13С-МДТ при ДЗП любой этиологии, различной стадии и степени тяжести, тогда как оценка по Чайлд–Пью применима только при циррозе печени, APRI (aspartate aminotransferase to platelet ratio index) предложен при вирусном гепатите С, другие неинвазивные методы также имеют свои ограничения [16]. К тому же важным преимуществом метацетина служит его быстрый метаболизм и высокий профиль безопасности, что продемонстрировано и в нашей работе, подтвердив литературные сведения об отсутствии осложнений при выполнении теста [18, 19].
Заключение
Неинвазивный и безопасный, легко воспроизводимый 13C-МДТ способен достоверно отражать уровень функционального резерва и наличие дисфункции печени при ДЗП различной этиологии.
Несмотря на то что 13С-МДТ по времени выполнения (2 часа) более продолжительный по сравнению с другими неинвазивными методиками, способными оценивать уровень фиброза (ФиброМакс, непрямая эластометрия печени), данный метода позволяет оценить степень снижения функционального резерва печени, а следовательно, прогнозировать дальнейшие сценарии течения заболевания.
Полученные при анализе данные указывают на то, что 13С-МДТ остается универсальным (возможно использовать независимо от этиологии и тяжести поражения) и надежным методом с количественной оценкой функции печени.
В нашем исследовании мы получили статистически значимые различия параметров теста между НАЖБП и заболеваниями печени различного генеза. Однако вопрос возможности межэтиологической дифференциальной диагностики ДЗП с помощью 13С-МДТ остается открытым, поскольку выборка пациентов в каждой группе была небольшой. Данная работа демонстрирует необходимость дальнейших комплексных исследований 13С-МДТ у пациентов с патологией печени различной этиологии.



