Введение
В последние годы применение схем лечения хронического вирусного гепатита C (ВГС), включающих пегилированный интерферон (P), значительно сократилось, хотя в некоторых регионах они по-прежнему остаются важным вариантом лечения (1). Пегилированный интерферон и рибавирин вызывают много нежелательных побочных эффектов, требуют длительного лечения и имеют множество противопоказаний (2). Успешное применение противовирусных препаратов прямого действия (ПППД/DAA), таких как симепревир (SMV), как в сочетании с пегинтерфероном и рибавирином (PR), так и без них позволило заменить или сократить использование терапии интерферонами (3–5).
Цель
Целью данного исследования было сравнение эффективности схем лечения инфекции ВГС на основе симепревира, содержащих и не содержащих интерфероны, а также анализ изменений в использовании сопутствующих лекарственных препаратов во время лечения симепревиром. Дополнительной целью была оценка осуществимости терапии на основе симепревира у пациентов – бывших потребителей инъекционных наркотиков, получавших опиоидную заместительную терапию (ОЗТ), поскольку эта категория пациентов составляет значительную долю ВГС-инфицированной популяции.
Проведен апостериорный анализ данных 11 проспективных исследований симепревира II и III фаз и одного обсервационного исследования из США (Приложение, табл. S1). В анализ отбирались спонсируемые Janssen клинические исследования, в которых оценивались схемы лечения инфекции ВГС на основе симепревира, содержащих и не содержащих интерфероны.
В анализ включены пациенты в возрасте от 18 до 70 лет, получавшие 150 мг симепревира 1 раз в день в течение запланированного курса лечения, но не менее 8 недель. Период наблюдения определен как первые 12 (или 8) недель лечения симепревиром. Другие критерии включения и исключения варьировались между исследованиями. Первичным исходом был устойчивый вирусологический ответ по окончании 12 недель лечения (УВО12).
Оценка безопасности включала неблагоприятные побочные эффекты, неблагоприятные побочные эффекты, представляющие особый интерес, и прекращение лечения.
Неблагоприятными побочными эффектами, представляющими особый интерес, были побочные явления со стороны желудочно-кишечного тракта (тошнота, диарея, боль в животе, рвота), нервной (бессонница, беспокойство, раздражительность) и сердечно-сосудистой систем (гипертония, тахикардия), реакции общего характера (озноб, чувство жара), кожные проявления (потоотделение), а также передозировка. Эти побочные явления были выбраны, т.к. они обычно связаны с чрезмерной или недостаточной дозировкой препаратов для ОЗТ.
Чтобы оценить возможность комбинирования терапии на основе симепревира с полипрагмазией, мы оценили изменения общего количества и классов сопутствующих лекарственных препаратов, принимаемых в начале лечения и в течение периода наблюдения.
Классы сопутствующих лекарственных препаратов, представляющих интерес, включали:
- Препараты, которые обычно назначают в комбинации с интерферонами (антидепрессанты, бензодиазепины);
- Препараты с потенциальной возможностью лекарственного взаимодействия с симепревиром, но не противопоказанные в соответствии с инструкцией производителя (6) или согласно данным веб-сайта Ливерпульского университета для проверки лекарственных взаимодействий (https://www.hep-druginteractions.org/ ) (например, антагонисты кальция, статины);
- Препараты, прием которых характерен для пациентов со сложной сопутствующей патологией и/или имеющие узкий терапевтический диапазон (бензодиазепины, опиоиды для ОЗТ, нейролептики, противоэпилептические средства, АРВ-препараты для лечения ВИЧ).
В сравнительный анализ были включены четыре группы пациентов:
- Пациенты, получающие SMV+PR и находящиеся на ОЗТ;
- Пациенты, получающие SMV+PR без ОЗТ;
- Пациенты, получающие SMV+ DAA±R и находящиеся на ОЗТ;
- Пациенты, получающие SMV+DAA±R без ОЗТ.
Пациенты считались находящимися на ОЗТ (ОЗТ+), если они получали либо бупренорфин с налоксоном или без него, либо метадон или морфин при наличии показаний к ОЗТ в начале лечения симепревиром. Также к ним относились пациенты, получавшие эти препараты по неопределенным показаниям или по поводу хронической боли при условии, что они были инфицированы при использовании инъекционных наркотиков или интраназального героина.
Результаты
Исходные данные
Анализ включал 2439 пациентов. Характеристики пациентов при включении в исследование описаны в табл. 1.

Почти треть изучаемой популяции составили женщины, большинство больных были белыми и более 20% пациентов страдали циррозом печени. Страны, участвовавшие в исследованиях, перечислены в табл. S1.
Приложения. Большинство пациентов ранее не получали лечения по поводу ВГС. Пациенты, получавшие SMV+DAA±R, были несколько старше таковых группы SMV+PR. Злоупотребление алкоголем было менее распространено среди пациентов, получавших SMV+PR.
При включении в исследование различия между группами в частоте сопутствовавших заболеваний, представлявших особый интерес, были незначительными (Приложение, табл. S2).
Различия наблюдались в частоте гипертонии, депрессии и тревожного расстройства. Гипертензия чаще регистрировалась среди пациентов, получавших SMV+DAA±R, и чаще встречалась у пациентов, не находившихся на ОЗТ (ОЗТ-). Депрессия чаще встречалась среди пациентов, получавших SMV+DAA±R, а также у пациентов, находившихся на ОЗТ. Меньше всего тревожных расстройств было среди пациентов, получавших SMV+PR, не находившихся на ОЗТ.
Эффективность
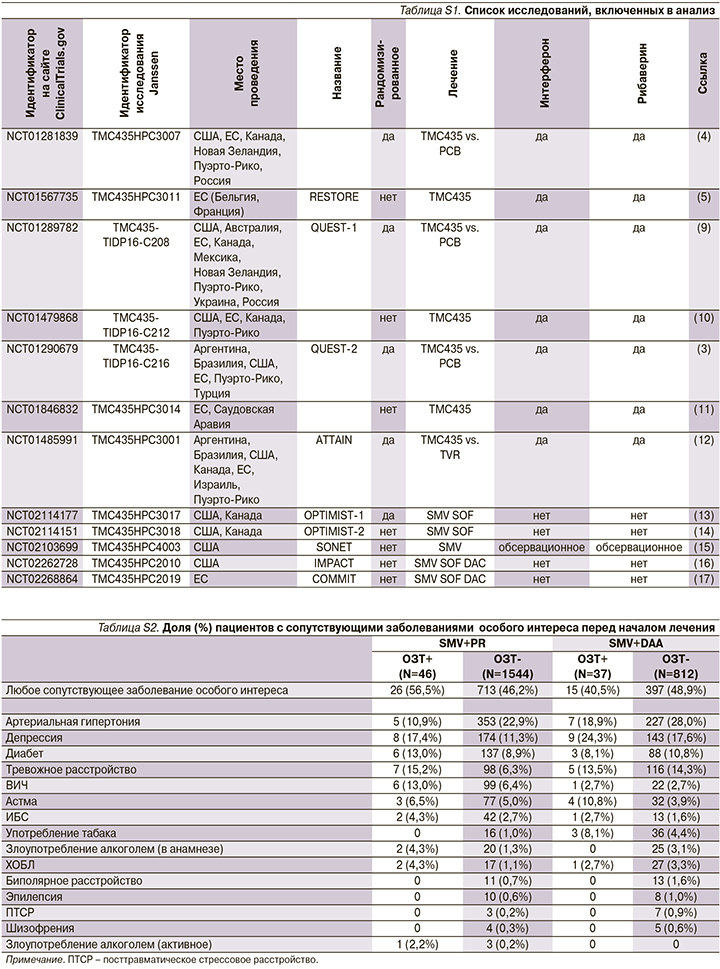
Анализ в зависимости от назначенного лечения (intent-to-treat) продемонстрировал более высокую эффективность лечения (УВО12) среди пациентов, получавших SMV+DAA±R, по сравнению с пациентами, принимавшими SMV+PR (рис. 1). Среди пациентов, находившихся и не находившихся на ОЗ, частота ответа была одинаковой.
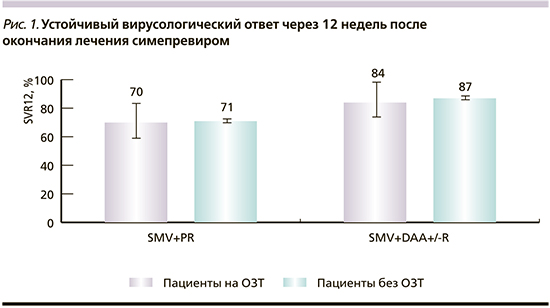
Частота прекращения приема симепревира были выше среди пациентов, получавших SMV+PR, чем в группе применения симепревира без интерферонов, главным образом из-за достижения вирусологической конечной точки или побочных эффектов (табл. 2). В группе SMV+PR частота прекращения лечения симепревиром была почти в 2 раза выше среди пациентов, находившихся на ОЗТ, по сравнению с больными, не получавшими ОЗТ. В то же время ни один пациент, получавший ОЗТ в группе SMV+DAA+/- R, не прекратил лечения симепревиром. Причины прекращения приема симепревира различались между пациентами, получавшими и не получавшими ОЗТ. Среди пациентов, находившихся на ОЗТ, таковыми были побочные эффекты и отказ пациентов, тогда как среди больных, не получавших ОЗТ, основной причиной прекращения лечения было отсутствие вирусологического ответа.
Безопасность
Неблагоприятные побочные эффекты отмечались у более 90% пациентов в группе SMV+PR и приблизительно у 60% больных, получавших SMV+DAA±R (табл. 3). Неблагоприятные побочные эффекты, представляющие особый интерес, в 2–3 раза чаще встречались в группе SMV+PR. Неблагоприятные побочные эффекты, которые могли быть вызваны симепревиром, чаще встречались в группе SMV+PR, чем в группе SMV+DAA-R. Серьезные побочные эффекты также были более распространены в группе SMV+PR. Побочных эффектов, приводивших к прекращению приема симепревира, было мало (менее 1% в группе SMV+DAA±R и менее 2% в группе SMV+PR).

Применение сопутствующих лекарственных препаратов
Частота использования сопутствующих лекарственных препаратов в начале лечения была высокой, достигнув 87% у пациентов, получавших SMV+DAA±R против 67–71% у пациентов группы SMV+PR (рис. 2). Только частота применения антиретровирусных препаратов для лечения ВИЧ была выше среди пациентов, получавших SMV+PR, чем среди пациентов группы SMV+DAA±R (рис. 3).
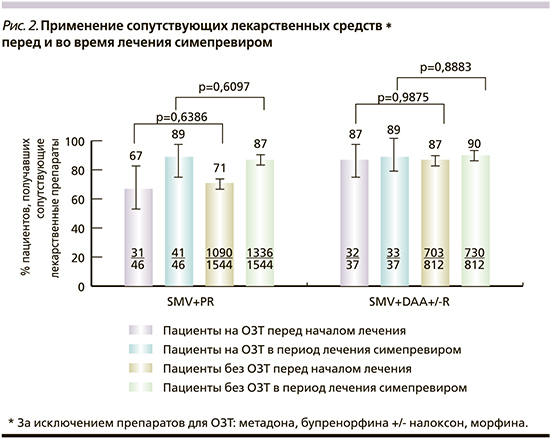
Среди пациентов, получавших SMV+PR, доля больных, принимавших сопутствующие препараты, увеличилась в период лечения с 71 до 87% (в подгруппе ОЗТ – с 67 до 89%), тогда как в группе в SMV+DAA+/- R частота приема сопутствовавших препаратов оставалась относительно стабильной.

Доля пациентов, принимавших препараты с потенциальной возможностью лекарственного взаимодействия с симепревиром (статины, антагонисты кальция) и лекарственные средства с узким терапевтическим диапазоном, оставалась стабильной во время наблюдения в обеих группах.
В период проведения лечения с применением симепревира в группе SMV+PR наблюдались более частое применение бензодиазепинов (увеличение на 2–4%) и опиатов (увеличение на 4–5%), а также увеличение использования антидепрессантов, в основном селективных ингибиторов обратного захвата серотонина (СИОЗС).
Обсуждение
В настоящем апостериорном анализе изучалась разнообразная популяция из 2439 пациентов с ВГС, которым проведено лечение с применением схем на основе симепревира, как содержащих, так и не содержащих интерфероны; часть пациентов – бывших потребителей инъекционных наркотиков получали опиоидную заместительную терапию.
Эффективность лечения была выше среди пациентов, получавших SMV+DAA±R (87%), по сравнению с SMV+PR (71%). В подгруппе пациентов, находившихся на ОЗТ, частота достижения ответа была одинаковой (SMV+DAA±R: 84%, SMV+PR: 70%), поэтому схемы лечения ВГС, содержащие симепревир, можно считать эффективными для бывших потребителей инъекционных наркотиков, получавщих ОЗТ.
Общая переносимость схем, содержащих интерферон и включенных в этот анализ, была ниже, у получавших их пациентов чаще возникали неблагоприятные побочные эффекты 3–4-й степеней и серьезные побочные эффекты, что скорее всего было связано с интерфероном (7). В группе SMV+PR частота прекращения лечения симепревиром была почти в 2 раза выше среди пациентов, находившихся на ОЗТ по сравнению с больными, не получавшими ОЗТ. Хотя комплаентность в группе пациентов, находившихся на ОЗП, была хорошей (0% прекращения из-за нарушения режима приема), а частота отсутствия вирусологического ответа была низкой, у этих пациентов чаще встречалась тяжелая патология печени (вдвое большая частота цирроза) и было больше сопутствовавших заболеваний, что могло повлиять на переносимость SMV+PR.
В целом только 39 пациентов прекратили прием симепревира из-за побочных явлений. Однако небольшое число пациентов в группах ОЗТ не позволяет провести сравнение с общей популяцией больных ВГС.
Полипрагмазия на исходном уровне была высокой. Пациенты, получавшие SMV+PR, реже принимали сопутствующие лекарственные препараты. Вероятно, это связано с тем, что при включении пациентов исследования учитывались противопоказания к интерферону и рибавирину.
Пациенты, получавшие схемы на основе симепревира без интерферона, как правило, были старше, имели более высокий риск цирроза и, как было отмечено, чаще употребляли алкоголь, который не рекомендуется при лечении интерфероном из-за повышенного риска психических расстройств (8). Использование сопутствующих лекарств, представляющих особый интерес, увеличивалось в период лечения симепревиром, особенно антидепрессантов среди пациентов, получавших SMV+PR. Депрессия – одна из неблагоприятных побочных эффектов лечения интерфероном (8), что объясняет наблюдаемое увеличение.
Доля пациентов, принимавших препараты с потенциальной возможностью лекарственного взаимодействия с симепревиром и лекарственные средства с узким терапевтическим диапазоном, оставалась стабильной во время наблюдения в обеих группах. Это может указывать на то, что в течение 8–12 недель лечения ВГС на основе симепревира пациенты продолжали принимать сопутствующие лекарственные препараты. Аналогичный апостериорный анализ лечения ВГС в общей популяции с применением схем, содержащих симепревир, показал, что назначение лекарственных препаратов с известной или потенциальной возможностью лекарственного взаимодействия с симепревиром редко приводило к прекращению, прерыванию или изменению дозы (Marra et al., в печати).
Настоящий анализ имеет несколько ограничений. Поскольку он представляет собой апостериорную оценку объединенных данных из 11 интервенционных и одного обсервационного исследований с различными протоколами и критериями включения, результаты сравнения между группами следует интерпретировать с осторожностью. Комбинация интерферона с рибавирином (за исключением когорты обсервационного исследования) использовалась всеми пациентами, включенными в рандомизированные или несравнительные исследования. Критерии включения и исключения обеспечивали соблюдение всех рекомендаций по применению этих препаратов.
При анализе применения сопутствующих лекарств, представляющих особый интерес, характерных для терапии интерфероном, некоторые изменения в использовании медикаментов могли быть упущены, поскольку наша оценка охватывала только первые 8–12 недель лечения симепревиром, а не полный расширенный период лечения интерфероном. С другой стороны, оценка применения сопутствующих лекарств, представляющих особый интерес, может быть несколько завышена. Это может быть связано с тем, что все сопутствующие лекарства, представляющие особый интерес, регистрировались при нескольких посещениях в течение периода лечения симепревиром и анализ не корректировался в отношении пациентов, которые переключались на другой препарат из аналогичного или другого класса, который после этого регистрировался как дополнительный препарат при лечении симепревиром.
Подгруппы пациентов, получавших ОЗТ, были слишком малы, чтобы провести детальное сравнение между схемами лечения или с большой группой пациентов, не получавших ОЗТ.
Заключение
Симепревир, применявшийся в схемах лечения ВГС, хорошо переносился и был эффективным для пациентов с хронической инфекцией ВГС; его использование было возможным для пациентов с высоким уровнем полипрагмазии. В период лечения симепревиром мы наблюдали увеличение применения сопутствовавших лекарственных препаратов, представлявших особый интерес, особенно антидепрессантов, когда в схему лечения входили интерферон с рибаверином. Доли пациентов, принимавших препараты с потенциальной возможностью лекарственного взаимодействия с симепревиром и лекарственные средства с узким терапевтическим диапазоном, оставались стабильными. Лечение пациентов – бывших потребителей инъекционных наркотиков, находившихся на ОЗТ, было успешным и приводило к такой же частоте достижения УВО, как и в общей популяции больных ВГС при аналогичном профиле безопасности.
В целом лечение симепревиром в сочетании с интерфероном и рибаверином или с софосбувиром в комбинации с рибаверином или без него является эффективным вариантом лечения больных ВГС с высоким уровнем полипрагмазии, в т.ч. бывших потребителей инъекционных наркотиков.
Вклад авторов
Значительный вклад в получение данных: CN, CB.
Анализ и интерпретация данных: JD, SM, CN, CB, MS, ILD.
Подготовка манускрипта: MS и CB с помощью в редактировании со стороны T.O.M. из Life Science Consulting.
Все авторы внесли вклад в концепцию и дизайн исследования, критически переработали и одобрили рукопись.
Информация о публикациях и выражение признательности
Ранее результаты этого исследования были представлены в виде постера на следующих конференциях: EASL 2017 (постер FRI-249), INHSU 2017 (постер 32).
Авторы благодарят T.O.M. из Life Science Consulting за помощь в редактировании.



