Введение
Термин «острая печеночная недостаточность» (ОПечН) часто применяется как общее выражение при описании любого острого эпизода ухудшения функциональных тестов печени, в т.ч. часто неправильно используется для описания острого ухудшения у пациентов с хроническим заболеванием печени (т.е. состоянием, которое следует называть обострением хронической печеночной недостаточности). Вместе с тем ОПечН – высокоспецифический и редкий синдром, характеризующийся острым ухудшением некоторых биохимических показателей функции печени у человека без хронического заболевания печени. Патологический процесс связан с развитием коагулопатии печеночной этиологии (в противоположность нарушениям коагуляции, наблюдаемым, например, при сепсисе) и клинически проявляется измененным уровнем сознания из-за печеночной энцефалопатии (ПЭ). Состояние пациентов, у которых развивается коагулопатия, но нет какого-либо изменения сознания, чаще рассматривается как острое поражение печени. Таким образом, термин ОПечН используется для описания пациентов, у которых развивается как коагулопатия, так и нарушения сознания. Диагностика, дифференциальная диагностика и выбор терапевтической тактики при ОПечН достаточно сложны, а прогноз часто неблагоприятен.
Эпидемиология ОПечН
ОПечН является весьма редким заболеванием, эпидемиологических данных очень мало. Как правило, подсчеты основываются на данных статистики центров трансплантации. Например, в Европе только 8% трансплантаций печени проводятся по причине ОПечН как основного показания, из них 19% случаев связаны с вирусной инфекцией, 18% – с лекарственно-индуцированным повреждением, 4% – с вторичным токсическим повреждением, 3% – с постоперационными или травматическими явлениями, 56% приходятся на неизвестные или другие причины [1]. Частота ОПечН, вызванной вирусом, во всем мире остается наиболее распространенной причиной (особенно в Азии и Африке), при этом «лидируют» вирусы гепатита А, Е и В. Существенный вклад высокой смертности населения вносит употребление крепких алкогольных напитков в отличие от большинства европейских средиземноморских стран. В Европе частой причиной ОПечН в настоящее время является лекарственно-индуцированное поражение печени (drug-induced liver injury, DILI); особое внимание уделялось парацетамолу (ацетаминофену) [2–5]. Однако на сегодня выявлены признаки гепатотоксичности и у других лекарственных средств; по данным сайта LiverTox®, более 50% зарегистрированных препаратов обладают гепатотоксичностью, к 2017 г. в эту базу было внесено более 1000 препаратов [6]. Среди препаратов, обладающих наибольшим потенциалом гепатотоксичности, по данным DILI (2015), выделяют антибиотики (амоксициллин клавуланат, нитрофурантоин, сульфаметоксазол, миноциклин), их роль составляет до 70%, противотуберкулезные препараты (изониазид); кроме того, отмечена роль гипотензивных препаратов, анальгетиков [7].
Группой зарубежных экспертов предложено разделение препаратов по количеству сообщений о цитолитическом синдроме на фоне их приема от Е (отсутствие данных о гепатотоксичности) до А (доказанная гепатотоксичность) [8].
С этой целью создана глобальная база данных «VigiBase». Безусловно необходимы дальнейшие эпидемиологические исследования и создание единого международного регистра пациентов с ОПечН.
Определение и классификация ОПечН
Клинически развитие ОПечН начинается с тяжелого острого повреждения печени (ОПП) у пациента без хронического заболевания печени. Это характеризуется двукратным повышением трансаминаз (как основного маркера повреждения печени), появлением желтухи и коагулопатии. Такое клиническое описание возникло из наблюдения за гепатотоксичностью, связанной с лекарственными средствами, но применимо ко всем причинам ОПечН [9].
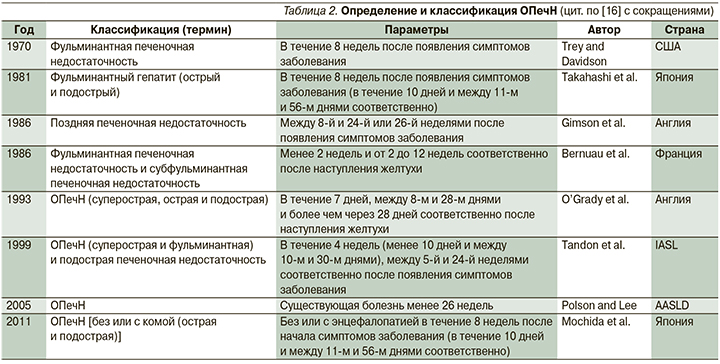
Первоначально ОПечН определена Трей и Дэвидсоном в 1970 г. как фульминантная печеночная недостаточность, которая была «потенциально обратимым состоянием», развивалась вследствие тяжелого поражения печени (прежде всего лекарственного; в частности, речь шла о галотане) в отсутствие ранее существовавших заболеваний печени, сопровождалась развитием ПЭ в течение 8 недель после появления первых симптомов [10]. В дальнейшем появилось несколько различных классификаций ОПечН. Так, в 1986 г. Bernuau et al. [11] предложили термин «молниеносная (фульминантная) ОпечН» при развитии ПЭ до 2 недель и «субмолниеносная (субфульминантная)» при развитии ПЭ от 2 до 12 недель; а Gimson et al. [12] предложили состояние пациентов, у которых есть ПЭ, а также другие данные о декомпенсации печени, развивающиеся более чем за 8 недель, но менее чем за 24 недели после появления первых симптомов, обозначать как позднюю печеночную недостаточность (late-onset hepatic failure, LOHF), клинический синдром, связанный с фульминантной печеночной недостаточностью. В 1993 г. определение данного синдрома конкретизировалось и дополнилось с учетом этиологии, частоты осложнений и прогноза (табл. 1).

При этом было предложено, рассматривая желтуху как первый симптом ОПечН, гиперострым повреждением считать развития ПЭ в течение 7 дней после появления желтухи, острым – если ПЭ развивается между 8-м и 28-м днями с появления желтухи, подострый вариант ОПечН был описан как ПЭ, возникающая в течение 5–12 недель после начала желтухи; продолжительность заболевания более 28 недель от желтухи до энцефалопатии классифицируется как хроническое заболевание печени [13]. Международная ассоциация по изучению печени (IASL, 1999) в случае появления ПЭ в первые 30 дней после появления желтухи классифицирует ОПечН как молниеносную (фульминантную с выделением сверхострой в первые 10 дней), в более позднем периоде (от 5 до 24 недель) – как подострую (субфульминантную) ОПечН [14]. В настоящее время это наиболее часто используемая классификация как в европейских, так и в американских научных публикациях [15]. В табл. 2 представлен сводный анализ основных классификаций ОПечН.
Основные клинические особенности ОПечН
Имеют место четкие различия между фенотипически и прогностически схожими острой и суперострой ОПечН и подострой ОПечН, представляющей собой отдельный клинический вариант. Сверхострая ОПечН проявляется тяжелой коагулопатией, существенным увеличением трансаминаз и умеренным увеличением билирубина (следует отметить, что данный показатель повышается не всегда) [17]. В противоположность при подострых (субфульминантных) проявлениях часто бывает незначительное увеличение сывороточных трансаминаз и умеренная коагулопатия в сочетании с выраженной желтухой [18], кроме того, при подострой ОПечН часто встречаются спленомегалия, асцит и уменьшение размера печени. Говоря о прогнозе, следует помнить, что развитие ПЭ у пациентов с подострым течением сочетается с очень низкой вероятностью спонтанного выживания в отличие от случаев сверхострых проявлений, когда, несмотря на значительные биохимические нарушения, шанс спонтанного выздоровления достаточно велик [2].
Диагностика ОПечН
Диагностика ОПечН основывается на клинико-лабораторных данных (наличие коагулопатии, энцефалопатии), анамнеза (отсутствие заболеваний печени). Клиническими признаками ОПечН являются желтуха и ПЭ. У очень маленьких детей и новорожденных ОПечН может возникать в отсутствие ПЭ, но верифицируется при более выраженной коагулопатии, Международное нормализованное отношение (МНО) >4 [19], в то время как обычно о нарушениях коагуляции при диагностике ОПечН говорят при увеличении МНО >1,5 и удлинении протромбинового времени (ПВ) [20], Проявления минимальной ПЭ должны активно отслеживаться, особенно при подостром течении, т.к. в данном случае это определяет прогноз и диктует даже в отсутствие клинически манифестированной ПЭ необходимость трансплантации, особенно при уменьшении объема печени.
Обязательным условием для диагностики ОПечН является отсутствие диагностированного ранее хронического заболевания печени, за исключением острой их презентации de novo (например, аутоиммунный гепатит, синдром Бадда–Киари, болезнь Вильсона–Коновалова при условии отсутствия клинических или гистологических признаков цирроза). Наиболее частым «провокатором» считается вирусная инфекция [21]. В тех случаях, когда у пациентов с метаболическим синдромом, неалкогольной жировой болезнью печени, гепатитом В или С имеют место ПЭ, тяжелая коагулопатия и повышение трансаминаз, а с помощью ультразвука и других визуализирующих методов не определяется выраженный фиброз и отсутствуют признаки портальной гипертензии, также правомочно говорить об ОПечН.
Диагностические процедуры при поступлении пациента в стационар, необходимые для установления диагноза ОПечН:
- клинический анализ крови;
- биохимический анализ крови (АЛТ, АСТ, билирубин, ГГТП);
- коагулограмма (МНО, ПВ);
- рентгенологическое исследование грудной клетки;
- ЭКГ;
- печеночная эхография, также может потребоваться осевая визуализация брюшной полости и грудной клетки.
В качестве дополнительного метода клинической оценки и прогнозирования исхода у пациентов с ОПечН исследовался 13С-метацетиновый дыхательный тест (13С-МДТ). Описана корреляция между «печеночными» пробами и показателями 13С-МДТ, наиболее выраженная связь наблюдалась со следующими показателями: билирубин, ГГТП, МНО, ПВ, протромбиновый индекс (%), факторы свертывания V и VII [21]. Определение прогноза является важным критерием при ведении пациентов с ОПечН, т.к. крайне важно выделить группу пациентов, нуждающихся в быстром проведении трансплантации и избежать выполнения трансплантации печени тем, кто мог бы выжить и без нее – с помощью регенераторных возможностей собственной печени. Есть исследования [22], показавшие, что у выздоровевших пациентов с ОПечН улучшение функции печени, по данным 13С-МДТ, отмечено на 3 дня раньше используемой в настоящее время стандартной лабораторной диагностики, а в случае летальных исходов параметры 13С-МДТ оставались низкими, несмотря на колебания лабораторных показателей. Таким образом, 13С-МДТ может предоставить дополнительную информацию для повышения чувствительности и специфичности используемых в настоящее время прогностических скрининговых систем при ОПечН [2].
Дифференциальная диагностика
Прогноз и терапевтическая тактика, особенно необходимость экстренной трансплантации, во многом зависят от этиологии ОПечН. Решающей для дифференциального диагноза является оценка анамнеза, т.к. клиническая картина и данные визуализирующих исследований, особенно при подостром варианте ОПечН, могут имитировать цирроз печени. Для исключения цирроза, злокачественного новообразования или алкогольного поражения печени может быть рекомендована биопсия печени, предпочтительно трансъюгулярная. Клинические особенности, характерные для ОПечН той или иной этиологии, представлены в табл. 3.

Терапия
У большинства пациентов с ОПечН развивается системная вазодилатация с уменьшением объема циркулирующей крови. Выбор терапии определяется биохимическими показателями и клиническим статусом. Изначально физиологический раствор может быть эффективным при ОПечН, однако следует избегать гиперхлоремии, т.к. она связана с повышенным риском почечной недостаточности [23]. После адекватной объемной нагрузки требуется постоянная поддержка вазопрессорами, в частности, рекомендуется назначение норэпинефрина в начальной дозе 0,05 мкг/кг/мин при необходимости увеличивая до 0,2–0,3 мкг/кг/мин [24]. Кроме того, при легочной артериальной гипертензии необходимо контролировать уровень СО2, подключая к терапии простагландины, инотропные препараты с тщательным титрованием дозы. В случае острой сердечной недостаточности целесообразна веноартериальная экстракорпоральная мембранная оксигенация, проведение которой возможно только в специализированных кардиологических центрах [20].
Части пациентов с ОПечН с гипоксией и дыхательной недостаточностью может потребоваться ИВЛ.
Прогрессирование ПЭ или анорексии приводит к снижению поступления калорий, поэтому раннее проведение энтерального питания позволит свести к минимуму потери мышечной массы и снизить риск желудочно-кишечных кровотечений. Для облегчения энтерального питания используют введение назогастрального зонда. Наиболее безопасными считаются липидные эмульсии. Чрезмерная инфузия аминокислот может усугубить гипераммонемию, характерную для ОПечН, может вызвать отек мозга и внутричерепную гипертензию. Этого можно избежать путем регулярного мониторинга сывороточного аммиака во время энтерального и парентерального питания. Необходима коррекция эндотоксемии, т.к. с ее наличием связаны риски развития пареза кишечника и неокклюзивной ишемии [25, 26]. ОПечН часто ассоциируется с электролитными и метаболическими нарушениями, особенно когда она связана с острой почечной недостаточностью (ОПН) [2]. Так, частота гипогликемии, требующей лечения, увеличивается у пациентов с ОПечН и ОПН, индуцированным парацетамолом (55%), по сравнению с пациентами без ОПН (22%) [3]. Постоянный контроль гликемии с инфузией инсулина может снизить смертность тяжелых больных ОПечН [27]. У трети пациентов ОПечН, индуцированной парацетамолом, уровень сывороточного натрия был существенно снижен (менее 130 ммоль/л) [28]. Для поддержания нормального уровня натрия и снижения внутричерепной гипертензии (ВЧД) рекомендуется вводить гипертонический солевой раствор, однако следует избегать резкой коррекции (не более 10 ммоль/л за сутки) [29]. Для коррекции гипонатриемии, контроля баланса жидкости и ацидоза также используют заместительную почечную терапию [30], при повышенном содержании аммиака и/или прогрессирующей ПЭ целесообразно раннее начало заместительной почечной терапии [31]. Следует отметить, что ацидоз и повышение уровня молочной кислоты служат прогностическим маркером при ОПечН, индуцированной парацетамолом. Также для коррекции метаболических нарушений можно применять аппаратную поддержку по технологии Prometheus®, основанной на принципе фракционирования плазмы с использованием мембраны, высокопроницаемой для молекул альбумина, с последующей перфузией фильтрата через обменные смолы [32].
Использование антикоагулянтов при диализе служит предметом дискуссии и не прописано в современных стандартах [33]. Существуют показания, требующие активной коррекции нарушений коагуляции, например массивное кровотечение [34]. При уровне фибриногена 1,5–2 г/л вводят концентрат фибриногена в начальной дозе 25–50 мг/кг массы тела [2].
Пациентам с признаками синдрома избыточного бактериального роста, рефрактерной гипотензией, прогрессированием ПЭ, а также пациентам, ожидающим экстренной трансплантации, назначают эмпирически антибиотики широкого спектра действия [35].
Пациентам с легкой степенью ПЭ необходима регулярная клиническая и неврологическая оценка для выявления ранних признаков прогрессирования ПЭ. При необходимости пациента переводят на интубацию и ИВЛ с применением пропофола в качестве седативного препарата, что может предотвратить повышение внутричерепного давления и снизить риск развития судорог [36], в случае появления которых проводится ЭЭГ-мониторинг и назначение противоэпилептических препаратов [29]. При устойчивом повышении внутричерепного давления (>25 мм рт.ст.) применяют болюсное введение гипертонического солевого раствора (200 мл, 2,7%; или 20 мл, 30%) [37] или внутривенного маннита (150 мл, 20%) [38], при сохранении признаков внутричерепного давления и наличии церебральную гиперемии рекомендовано болюсное внутривенное введение индометацина (0,5 мг/кг) [39]. При развитии тяжелой ПЭ препаратом выбора считается L-орнитин-L-аспартат (LOLA). Есть сведения о снижении уровня аммиака в крови и уменьшении проявлений печеночной энцефалопатии при приеме LOLA. Основной точкой приложения данного препарата является воздействие на один из патогенетических факторов развития энцефалопатии – увеличение аммиака сыворотки [40, 41]. Применение системных глюкокортикостероидов не повышает выживаемости у пациентов с ОПН [42].
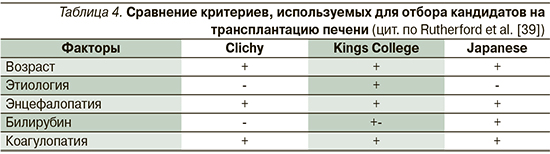
Во всем мире используются различные системы оценки прогноза ОПечН и критериев отбора кандидатов на трансплантацию, но они имеют общие черты (табл. 4). Наиболее часто используемыми системами в Европе являются критерии Королевского колледжа и критерии Клиши. Наличие ПЭ – опорный момент с последующим учетом возраста пациента, этиологии и тяжести поражения печени, показателей биохимии и коагулограммы. Кроме того, для уточнения показаний к трансплантации используется прогностическая шкала MELD [22].
В настоящее время предложен ряд альтернативных прогностических систем и маркеров для замены или дополнения к существующим критериям, которые помимо обычных лабораторных методов и клинических данных используют новые показатели иммунной активации или повреждения клеток печени [43]. В частности, для более раннего выявления (по сравнению с традиционными биохимическими тестами) функционального нарушения печени перспективным представляется использование 13С-МДТ [21, 22].
Заключение
ОПечН – достаточно редкий диагноз, для получения более точного представления об эпидемиологии которого целесообразно создание многоцентрового регистра. Оценка ПЭ имеет ключевое прогностическое значение, острые варианты ОПечН обычно легко диагностируются, в то время как при подостром варианте существуют диагностические сложности и даже легкая степень ПЭ может указывать на крайне неблагоприятный прогноз. Принятие решения об экстренной трансплантации печени пациенту с ОПечН требует участия мультидисциплинарной команды. Существующие прогностические критерии требуют совершенствования, имеется потребность в ранних маркерах повреждения клеток печени.


