Введение
Первичная циторедуктивная операция с последующим проведением системной лекарственной терапии на основе препаратов платины считается предпочтительной стратегией лечения больных распространенным раком яичников (РЯ) [1, 2]. Однако даже обширная хирургическая операция не может приводить к оптимальному удалению опухоли при распространенном париетальном и висцеральном канцероматозе [3]. В этих условиях неоадъювантная химиотерапия (НАХТ) служит разумным методом выбора, поскольку способна критически уменьшить объем опухоли и обеспечить эффективное и безопасное хирургическое вмешательство [4]. НАХТ, по-видимому, имеет некоторые недостатки, т.к. может скрыть потенциально опасные очаги опухоли от хирургического лечения и привести к развитию платинорезистентных опухолевых клонов. Однако в практике НАХТ часто используется как единственный возможный вариант лечения. Важно отметить, что НАХТ особенно информативна для изучения новых цитостатиков и их комбинаций, т.к. такая терапия позволяет оценивать изменения в опухолевой ткани, в т.ч. и на молекулярном уровне [5].
BRCA1-ассоциированные опухоли демонстрирую уникальную чувствительность к препаратам платины, однако общая эффективность лечения остается ограниченной. В частности, продолжительность ответа опухоли на лечение обычно ограничена несколькими месяцами [6]. Кроме того, несмотря на выраженный регресс опухоли, стандартная терапия на основе препаратов платины редко приводит к патоморфологическим полным ответам (pCR – pathologic complete response) [5]. В частности, при BRCA1-ассоциированном РЯ часть клеток даже в хемонаивных опухолях быстро приобретает резистентность во время НАХТ [7]. Неудивительно, что большинство больных распространенным РЯ неизбежно рецидивируют, если НАХТ не приводит к pCR [5]. Несмотря на то что pCR является единственной допустимой конечной точкой для исследований НАХТ, было признано, что полная циторедукция во время интервальной операции по удалению опухолей является значительным предиктором для продолжительной выживаемости без рецидива [4, 8].
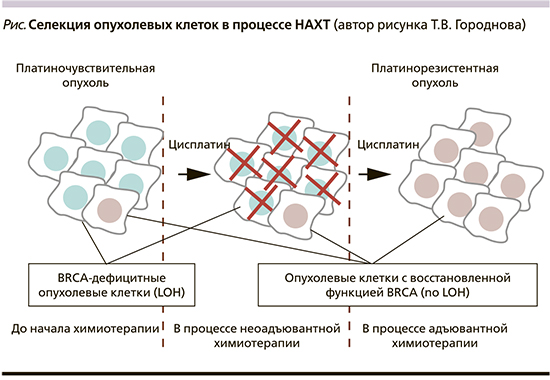
По всей видимости, важно уделять внимание биологическим свойствам остаточных элементов опухоли после НАХТ у больных РЯ. BRCA1-ассоциированная опухоль содержит биологически различные популяции опухолевых клеток. Большая часть опухоли представлена BRCA1-дефицитными клетками (LOH), которые сразу же погибают в ответ на платиновую терапию. Но небольшая часть клеток в этих опухолях сохранила копию гена BRCA1 дикого типа (no LOH) [7, 9] (см. рисунок).
Платиносодержащие схемы НАХТ имеют высокую активность по отношению к клеткам с дефицитом BRCA1 (LOH), но не могут эффективно уничтожить остальные опухолевые клетки с неповрежденной функцией BRCA1 (no LOH) [7].
Методы
В исследование вошли 217 больных РЯ, которые проходили лечение в течение 2015–2017 гг. и по предиктивной оценке имели низкую вероятность выполнения оптимальной циторедукции [10].
В исследовании участвовали 3 онкологических центра: НМИЦ онкологии им. Н.Н. Петрова (Санкт-Петербург); Городской клинический онкологический диспансер, (Санкт-Петербург), Ленинградский областной онкологический диспансер (Санкт-Петербург).
Все больные РЯ были подвергнуты тестированию на предмет наличия мутаций BRCA1 c.5266dupC [5382insC], c.4034delA [4153delA], c.181T> G [C61G], c.68_69delAG [185delAG] [11] до начала лечения. Поскольку этот анализ основан на нескольких простых тестах методом полимеразной цепной реакции, время обработки не превышало 3 рабочих дней. Из 217 больных была идентифицирована 21 (10%) носительница мутаций. Восемнадцать (86%) из них были хемонаивными к моменту генетического тестирования; 3 (14%) начали получать химиотерапию (ХТ) в другой клинике, но искали дополнительные варианты лечения из-за прогрессирования заболевания, 15 (71%) пациенток согласились принять участие в клиническом исследовании и получали комбинацию митомицина С 10 мг/м2 и цисплатина 100 мг/м2 каждые 4 недели.
Все участницы исследования подписали информированное согласие на участие в исследовании и публикацию его результатов. Протокол был одобрен комитетом по этике ФГБУ НМИЦ онкологии им. Н.Н. Петрова (протокол № 15 от 17.06.2015).
Результаты проспективного исследования НАХТ лечения больных BRCA1-ассоциированным РЯ комбинацией митомицина С и цисплатина были сопоставлены с ретроспективными данными (n=62) НАХТ больных BRCA1-ассоциированным РЯ, подвергнутых стандартной неоадъювантной терапии. Все 62 пациентки в период с 2000 по 2017 г. проходили лечение в вышеуказанных онкологических центрах. В архиве патоморфологических лабораторий подобрали гистологические блоки операционного материала каждой пациентки. Из всех отобранных парафиновых гистологических блоков выделили ткань вне опухоли под контролем световой микроскопии. Методом тканевого лизиса выделили молекулу ДНК. Все полученные образцы ДНК тестированы на наличие мутаций BRCA1 c.5266dupC [5382insC], c.4034delA [4153delA], c.181T> G [C61G], c.68_69delAG [185delAG] [11].
Статистический анализ проведен с использованием пакета SSPC 13.0 Для оценки эффективности схемы митомицин С+цисплатин (схема МР) по сравнению с другими схемами НАХТ использованы двусторонний критерий Фишера, значения p после применения поправки Бенджамини–Хохберга.
Результаты исследования
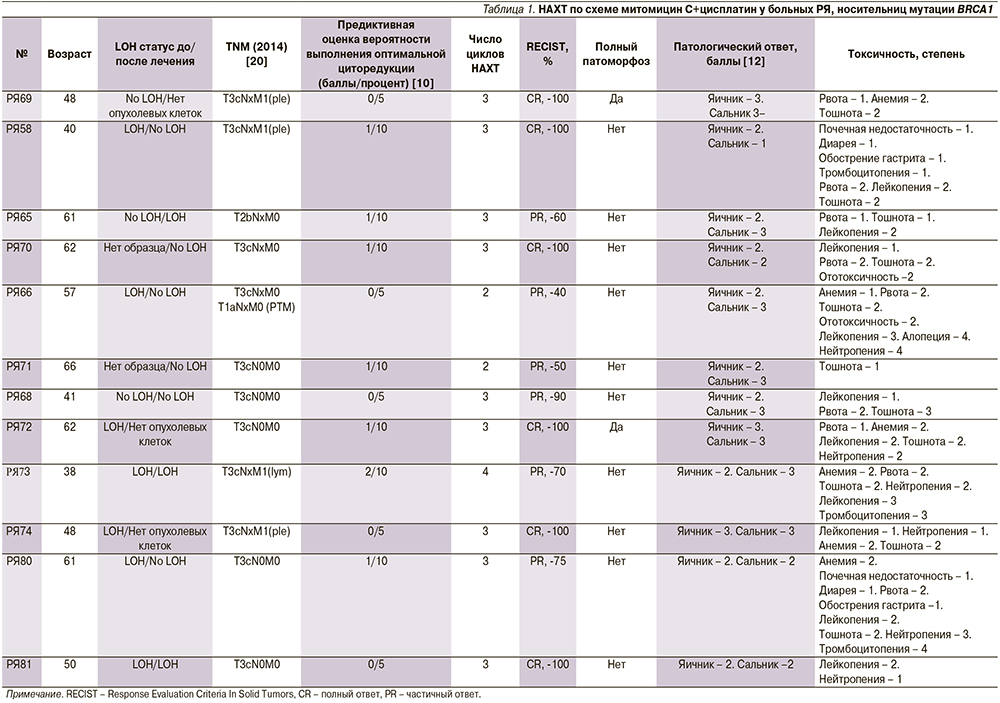
В проспективном исследовании 12 пациенток получали НАХТ по схеме митомицин С+цисплатин. Все пациентки были носителями мутации BRCA1 5382insC, 9 (75%) получили 3 цикла НАХТ, 2 (17%) были подвергнуты 2 циклам, у 1 (8%) пациентки было 4 цикла терапии (табл. 1). Изменчивость в числе циклов НAХT была основана на предиктивных маркерах о вероятности достижения полной циторедукции. Токсичность НАХТ была ограничена осложнениями 1–2-й степеней у 8 (67%) из 12 пациенток (см. табл. 1). Все 12 больных РЯ продемонстрировали объективный клинический ответ на лечение. Полная циторедуктивная операция была достигнута всеми пациентками, включенными в исследование. Патологическая оценка тканей, удаленных во время операции, установила pСR в 2 (17%) из 12 случаев (РЯ 69 и РЯ 72, табл. 1). Кроме того, у одной больной (РЯ 74) был зафиксирован полный патологический ответ в яичниках и почти полный ответ в сальнике. В целом у 5 (42%) больных был выраженный патоморфологический ответ (оценка 3, согласно [12]).
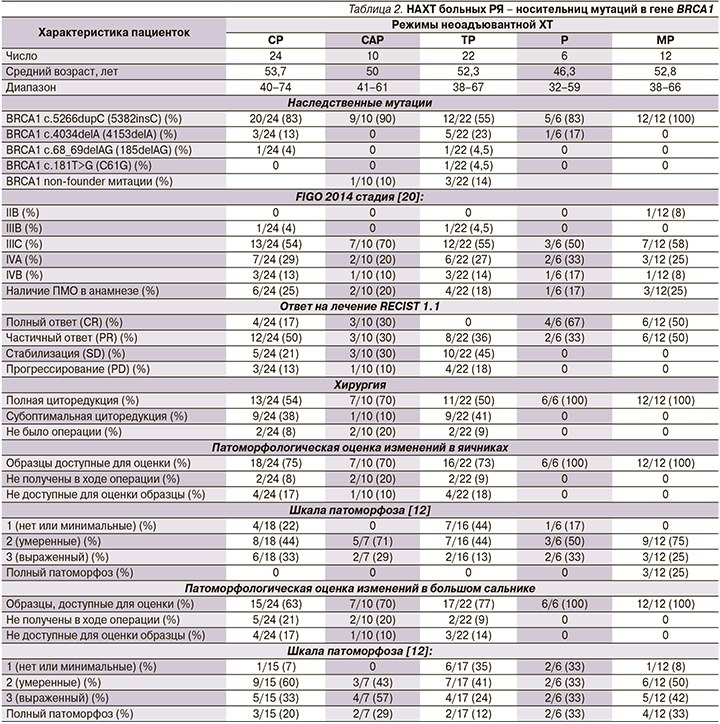
Дополнительно были проанализированы ретроспективные данные о результатах лечения различными схемами НАХТ, применяемыми в отношении носителей мутации в гене BRCA1 в НМИЦ им. Н.Н. Петрова. Схемы НАХТ включили CP (n=24), CAP (n=10), TP (n=22) и монохимиотерапию препаратом цисплатин (n=6; табл. 2). Примечательно, что комбинация паклитаксел+карбоплатин, которая считается предпочтительным вариантом системного лечения РЯ, была единственной схемой НАХТ, не приведшая к полному клиническому ответу. Частота выполнения полной циторедукции была численно выше для схемы митомицин С+цисплатин (12/12, 100%) и только цисплатина (6/6, 100%) и умеренной для остальных схем (CP: 13/24, 54%; CAP: 7/10, 70%; ТП: 11/22, 50%).
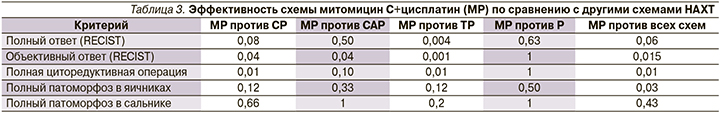
Важно отметить, что ни один из традиционных режимов не приводил к pCR, определяемому как отсутствие опухолевых клеток в любой из хирургически удаленных тканей. Это сопоставимо со схемой митомицин С+цисплатин, где наблюдалось 3/12 (25%) случаев pCR. Статистический анализ подтвердил, что комбинация митомицина С с цисплатином продемонстрировал значительно лучшие показатели объективных ответов по сравнению с режимами CP, CAP и TP. Кроме того, наблюдалась значимая разница по сравнению со схемами CP или TP в отношении доли пациентов, которым выполнена полная циторедуктивная операция (табл. 3).
Соматическая потеря оставшегося аллеля BRCA1 (LOH) служит основным механизмом нарушения функции гена BRCA1 в опухолях [13]. Десяти (83%) из 12 пациенток, включенных в исследование, оценили статус BRCA1 LOH в первичной опухоли. В 7 (70%) из 10 опухолей продемонстрировали LOH в хемонаивных опухолевых клетках, тогда как 3 (30%) образца сохраняли аллель BRCA1 дикого типа. В 9 (75%) из 12 образцов тканей после НАХТ содержалось достаточное количество опухолевых клеток для анализа LOH. LOH наблюдался только в 3 (33%) из 9 опухолей после НАХТ. Кроме того,
3 (60%) из 5 информативных пар опухолей, присутствовавших с BRCA1 LOH в начале лечения, показали сохранение дикого типа BRCA1 в остаточной опухоли после НАХТ.
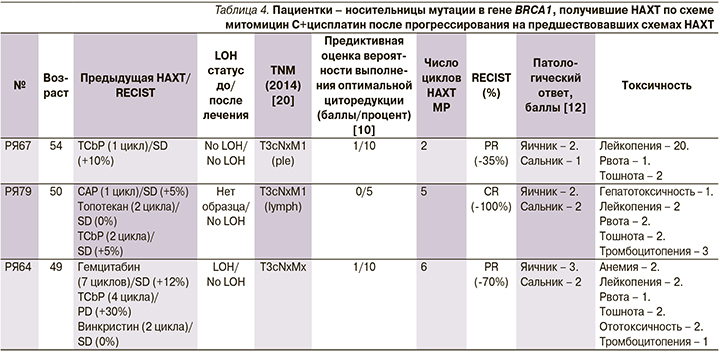
Анализ данных пациенток, получивших предшествовавшую ХТ до начала комбинации митомицин С+цисплатин, не был основной целью этого исследования. Интересно отметить, что все пациентки, которые прогрессировали на предшествовавшей терапии, продемонстрировали достоверно значимый ответ на комбинацию митомицин С+цисплатин и подверглись полной циторедуктивной операции после НАХТ (табл. 4).
НАХТ на основе препаратов платины приводит к выраженному регрессу большинство больных РЯ, однако хирургически удаленные опухолевые массы почти всегда содержат остаточные опухолевые клетки [5, 14]. Редкость pCR может объяснять тот факт, что практически все больные распространенным РЯ, получающие НАХТ, неизбежно рецидивируют даже после полной хирургической циторедукции [14–16]. BRCA1-ассоциированный РЯ более химиочувствительный, чем спорадические опухоли [17]. Тем не менее скорость pCR в BRCA-ассоциированных опухолях в процессе НАХТ никогда не изучалась ранее. В настоящем исследовании 52 пациентки с мутацией в гене BRCA1, которые прошли стандартные схемы НАХТ, были оценены для pCR; ни одна из них не получила патологического полного ответа.
Комбинация митомицина С с цисплатином дала несколько более обнадеживающие результаты по сравнению с ретроспективными случаями BRCA-ассоциированным РЯ. Действительно, у 2 (17%) из 12 больных, включенных в это исследование, зафиксирован pCR. Кроме того, всем 12 пациенткам удалось достичь полной циторедуктивной операции по сравнению с 37 (60%) из 62 больных, получавших стандартную НАХТ. Этого исследования, по-видимому, достаточно, чтобы предположить, что комбинация митомицина С и цисплатина превосходит «золотой» стандарт НАХТ, поэтому заслуживает оценки в контролируемом рандомизированном исследовании. Тем не менее эта комбинация препаратов не достигла высокой скорости pCR, следовательно, долгосрочный прогноз для большинства пациентов, подвергающихся этому экспериментальному лечению, вряд ли будет значительно улучшен.
Заключение
Существует два подхода, которые могут иметь некоторый потенциал для дальнейшего улучшения долгосрочных результатов в продвинутых раковых заболеваниях, связанных с BRCA1, проходящих НАХТ. Во-первых, можно искать некоторые новые терапевтические схемы, способные улучшить скорость pCR. Во-вторых, можно рассмотреть некоторые модификации адъювантной терапии, которые применяются после операции.
Сочетание платиновых дуплетов с другими препаратами, активность которых не ограничивается клетками с дефицитом BRCA1, может стать перспективным химиотерапевтическим подходом. Использование платино-таксановых схем, которые являются текущим «золотым» стандартом, по-видимому, по эффективности не превосходит другие режимы для носительниц мутаций в гене BRCA1. Антрациклины могут заслуживать особого внимания, поскольку схемы на основе антрациклина демонстрируют активность пациентов как с мутациями зародышевой линии BRCA1, так и без них [18, 19]. Может быть обсуждена некоторая разумная интенсификация предоперационных схем ХТ, включая новый состав триплетов лекарственных средств или некоторое увеличение доз лечения.


