Введение
Острые нарушения мозгового кровообращения в детском возрасте остаются в настоящее время недостаточно изученной проблемой, несмотря на формирование выраженного неврологического дефицита, высокий риск летальности и повторного инсульта. Частота перинатальных нарушений мозгового кровообращения по ишемическому типу достигает 1:3000–1:4000 случаев среди новорожденных [1–4], при этом одним из ведущих факторов развития инсульта служит наличие врожденных прокоагулянтных нарушений [2, 4]. В то же время тромбофильная предрасположенность не только провоцирует развитие тромбозов любой локализации в нетипичном возрасте, но и может стать существенным фактором риска для других мультифакторных состояний. В описанной ниже клинической ситуации наличие тромбофилии способствовало развитию ишемического инсульта у молодой женщины, а также стало предрасполагающим фактором для развития тяжелого ишемического поражения головного мозга у ее сыновей.
Клинический случай
Пациентка Н. 34 лет была госпитализирована в отделение для лечения больных острыми нарушениями мозгового кровообращения ГБУЗ СК «Ставропольская краевая клиническая больница» (Ставрополь) 07.11.2017 бригадой скорой медицинской помощи. Жалоб при поступлении не предъявляла вследствие наличия афатических нарушений. Из анамнеза болезни известно, что заболела остро 07.11.2017 около 01.00, когда на фоне полного благополучия перестала говорить, понимать обращенную речь.
Анамнез жизни: сосудистых факторов риска не выявлено. Беременностей 3, родов 2 (8 лет и 3,5 месяца назад). Не курит. Травм, операций ранее не было. Аллергологический анамнез не отягощен.
Объективно при поступлении: общее состояние при поступлении средней тяжести. Телосложение нормостеническое, повышенного питания. Кожные покровы, видимые слизистые оболочки обычной окраски. Тоны сердца приглушены, ритмичные. Артериальное давление на правой руке – 130/80 мм рт.ст.; на левой руке – 130/80 мм рт.ст. Пульс – 68 ударов в минуту удовлетворительного наполнения. Дыхание везикулярное, хрипов нет. Живот мягкий, при пальпации безболезненный. Физиологические отправления без особенностей. Температура тела при поступлении – 36,6°С.
Неврологический статус при поступ-лении: сознание ясное. Менингеальных симптомов нет. Грубая сенсомоторная афазия. Зрачки D=S, фотореакции зрачков живые. Слабость конвергенции с двух сторон. Бульбарных нарушений нет. Парез мимических мышц по центральному типу справа. Язык по средней линии. Сухожильные рефлексы с рук, ног D>S. Правосторонний гемипарез со снижением мышечной силы до 4 баллов по шкале Комитета медицинских исследований. Мышечный тонус не изменен. Симптом Бабинского справа. Чувствительные и координаторные нарушения достоверно оценить невозможно вследствие речевых нарушений. Тазовые функции контролирует.
Результаты оценки по шкалам: по шкале комы Глазго – 15 баллов, по шкале инсульта NIH – 8, по модифицированной шкале Рэнкина – 4, индекс мобильности Ривермид – 11 баллов.
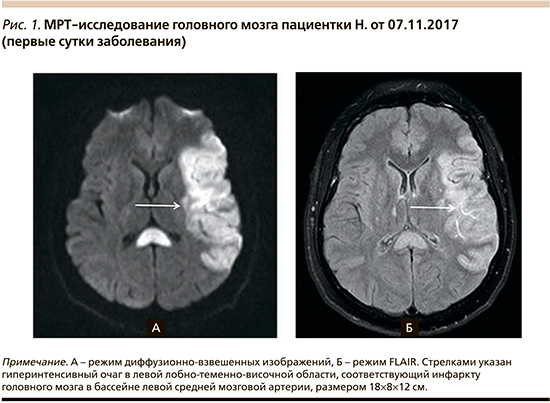
При выполнении магнитно-резонансной томографии (МРТ) головного мозга 07.11.2017 выявлен инфаркт в бассейне васкуляризации средней мозговой артерии (рис. 1). Ультразвуковое дуплексное сканирование брахиоцефальных артерий, выполненное 07.11.2017: правая позвоночная артерия малого диаметра – 2,6 мм (норма не менее 3,0 мм). Умеренная деформация хода трех сегментов обеих позвоночных артерий с мультифокальным субкомпенсированным стенозом (до 45% справа), на уровне С1–С2.
ЭхоКГ от 09.11.2017: размеры лоцируемых структур сердца, магистральных сосудов и их взаимоотношения в пределах возрастной нормы. Нарушений локальной и глобальной сократимости левого желудочка не выявлено. Умеренная регургитация на митральном клапане. Уплотнение створок митрального клапана. Дисфункция трикуспидального клапана.
ЭКГ от 07.11.2017 и от 17.11.2017: синусовый ритм, нормальное положение электрической оси сердца.
КТ-ангиография от 13.11.2017: признаков артериальных аневризм не выявлено. Интракраниальные артерии без патологических изменений.
Компьютерная томография (КТ) головного мозга от 22.11.2017: КТ-картина инфаркта головного мозга в бассейне левой средней мозговой артерии.
Нейроокулист от 08.11.2017: начальный застой зрительных нервов обоих глаз.
Нейроокулист от 16.11.2017: обратное развитие начального застоя зрительных нервов обоих глаз.
Логопед: сенсомоторная афазия.
Результаты лабораторных исследований (08.11.2017): глюкоза – 4,35 ммоль/л, белок общий – 69,5 г/л, мочевина – 5,6 ммоль/л, креатинин – 44 мкмоль/л, гомоцистеин – 13,95 мкмоль/л. Липидограмма (08.11.2017): триглицериды – 2,54 ммоль/л, холестерин – 3,38 ммоль/л, липопротеиды низкой плотности – 1,23 ммоль/л, липопротеиды высокой плотности – 1,47 ммоль/л, коэффициент атерогенности – 1,32.
Коагулограмма (07.11.2017): ПТИ – 101%, АЧТВ – 37,0 с, МНО – 0,98. Коагулограмма (17.11.2017): ПТИ – 106%, Протромбин по Квику – 12%. ПТВ – 12 с, МНО – 0,94, АЧТВ – 34,4 с, фибриноген – 3,62 г/л.
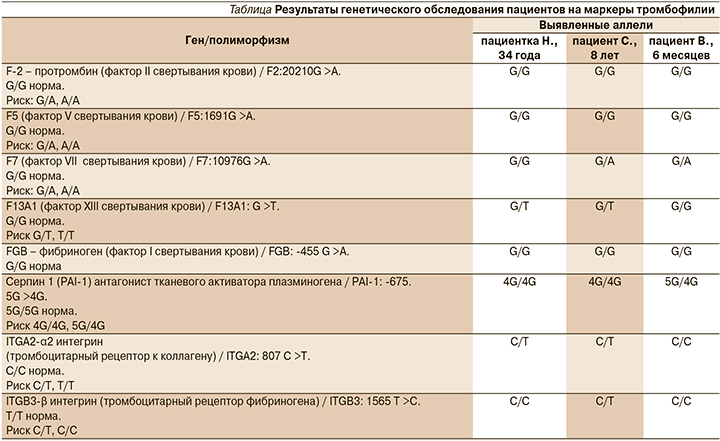
Больной и двух ее сыновей выполнено ПЦР-исследование крови (09.11.2017) с определением генетических полиморфизмов, ассоциированных с риском тромбозов (см. таблицу).
Таким образом, результаты проведенного инструментального и лабораторного обследования пациентки Н. позволили исключить наиболее распространенные патогенетические варианты ишемического инсульта в соответствии с критериями TOAST (атеротромботический, кардиоэмболический и лакунарный) и выявить в качестве ведущей причины развития инсульта, тромбофилию.
Основной диагноз при выписке: ишемический инсульт в бассейне кровоснабжения левой средней мозговой артерии от 07.11.2017. Патогенетический вариант по критериям TOAST: редкие причины, инсульт на фоне тромбофилии. Сопутствующий диагноз: наследственная тромбофилия: носительство генов среднего риска тромбообразования F13:103 G >T, ITGA2:807C >T, ITGB3:1565 СC, PAI-1:-675 4G4G.
За период пребывания в стационар на фоне проводимой терапии отмечена положительная динамика заболевания в виде частичного регресса очаговой неврологической симптоматики. При выписке сохранялась умеренная сенсомоторная афазия, правосторонняя пирамидная недостаточность. В удовлетворительном состоянии выписана под наблюдение невролога, терапевта по месту жительства с рекомендациями в соответствии с выявленными факторами риска (диета с ограничением жиров животного происхождения поваренной соли, контроль липидограммы, занятия с логопедом, контроль артериального давления, занятия ЛФК, клопидогрел 75 мг постоянно). Балл по модифицированной шкале Рэнкина – 2, балл по индексу мобильности Ривермид – 14. При динамическом наблюдении у невролога через 4 месяца после инсульта сохранялась моторная афазия с элементами правосторонней пирамидной недостаточности.
Старший сын пациентки Н., пациент С. 16.11.2009 г.р., родился от 2-й беременности на фоне угрозы прерывания (проводилось стационарное лечение, обострение гестационного пиелонефрита), 1-х срочных родов в 39 недель, осложненных ранним излитием околоплодных вод (воды зеленые, зловонные, с примесью крови), дискоординацией родовой деятельности. Беременность этим ребенком протекала с отягощенным акушерским анамнезом: первая беременность закончилась медицинским абортом, далее перед второй беременностью было диагностировано бесплодие в течение 4 лет. Вес ребенка при рождении составил 2300 г, рост – 49 см, окружность головы – 31,5 см, оценка по шкале Апгар – 4–7 баллов, состояние при рождении тяжелое, проводились реанимационные мероприятия. Состояние в периоде первичной адаптации было тяжелым за счет дыхательной недостаточности, неврологической симптоматики с преобладанием синдрома угнетения ЦНС, внутричерепной гипертензии, вегето-висцеральных нарушений (парез кишечника), на 2-е сутки желтушный синдром, кожный геморрагический синдром, тромбоцитопения. Из роддома на 7-е сутки был переведен в отделение патологии новорожденных, где находился на лечении до месячного возраста.
Ребенку была проведена МРТ головного мозга в возрасте 25 дней жизни 11.12.2009: участок кистозной трансформации в области левой височной доли размером 3 4×2 см, с кровоизлиянием в сосудистое сплетение. Мелкие кровоизлияния в теменной доле слева.
Диагноз при выписке: перинатальное поражение ЦНС смешанного генеза (гипоксически-ишемического и геморрагического), тяжелой степени, острый период. Кистозная трансформация левой височной доли. Мелкие кровоизлияния в теменную долю слева. Синдром угнетения ЦНС. Синдром внутричерепной гипертензии. Сопутствующий – 37 недель.
Ежегодно проходил повторные курсы лечения в психоневрологическом отделении ГБУЗ «Краевая детская клиническая больница» (Ставрополь) с диагнозом «детский церебральный паралич, спастическая диплегия, конечная резидуальная стадия, GMFCS, уровень 2. КТ-признаки большой ликворной кисты в левой височной области. Снижение когнитивных функций до пограничного уровня. Эквинусная установка стоп. Частичная атрофия зрительных нервов обоих глаз, миопия средней степени, нистагм обоих глаз». При госпитализации с 13.06.2017 по 23.06.2017 в неврологическом статусе: окружность головы – 48 см. Черепно-мозговые нервы: взгляд фиксирует, прослеживает. Двустороннее альтернирующее косоглазие. Врожденный 2-сторонний нистагм. Зрачки d=s, фотореакции живые. Лицо симметрично. Язык по средней линии. Пятая пара без патологии. Мышечный тонус в конечностях повышен по спастическому типу, больше в ногах. Мышечная сила снижена в ногах. Снижена моторика пальцев рук. Сухожильные рефлексы с рук и ног симметричные, D=S, высокие. Симптом Бабинского с обеих сторон. Походка спастико-паретическая. Гипертонус аддукторов бедер. Плосковальгусные стопы, больше справа. Координаторные пробы выполняет с учетом парезов конечностей. Дермографизм розовый. Тазовых нарушений нет. Память, внимание снижены, интеллект снижен до пограничного уровня.
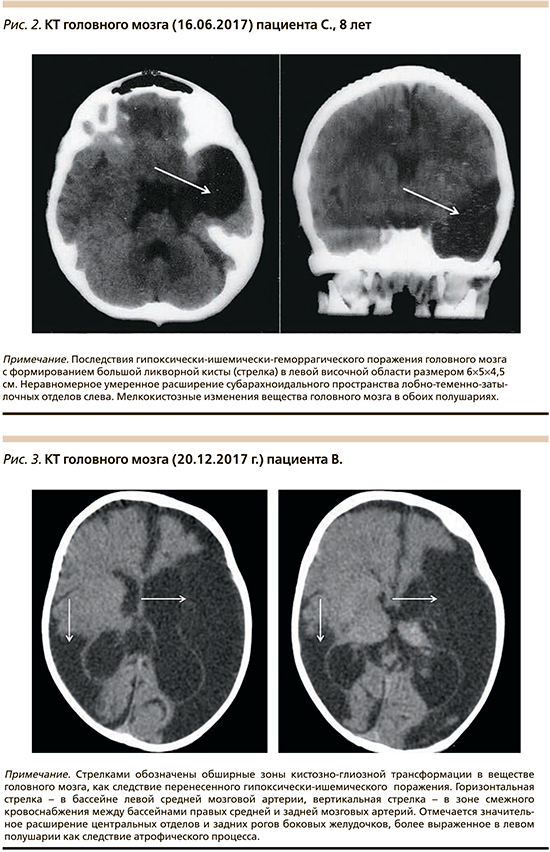
Во время текущей госпитализации, а также в 2014 и 2016 гг. пациенту С. выполнено КТ-исследование головного мозга в динамике.
КТ-головного мозга от 16.06.2017 (рис. 2): КТ-признаки большой ликворной кисты в левой височной области размером 6×5×4,5 см. Неравномерное умеренное расширение субрахноидального пространства лобно-теменно-затылочных отделов слева. Мелкокистозные изменения вещества головного мозга в обоих полушариях.
ЭЭГ: умеренно-выраженные общемозговые изменения биоэлектрической активности головного мозга. Эпилептиформные изменения в виде комплексов «острая–медленная волна» по левой височной области (эпилептических приступов в анамнезе не отмечено).
Прогноз для восстановления двигательных и интеллектуальных функций неблагоприятный.
Младший сын пациентки Н., пациент В. 21.08.2017 г.р., поступил в психоневрологическое отделение ГБУЗ «Краевая детская клиническая больница» (Ставрополь) 01.03.2018 с диагнозом «гипоксически-ишемическое поражение ЦНС, КТ-признаки атрофической смешанной гидроцефалии, 2-сторонних порэнцефалических ликворных кист обеих гемисфер, гипертензионно-гидроцефальный синдром, грубый спастический тетрапарез, синдром внутричерепной гипертензии, подкорковый синдром, синдром повышенной нервно-рефлекторной возбудимости, судорожный синдром, поздний восстановительный период. Корковая слепота? Нейросенсорная тугоухость?»
Жалобы при поступлении на приступы с тоническим напряжением в теле и конечностях, вздрагивания, повышенную возбудимость, беспокойный сон, скованность в конечностях, срыгивания, голову тянет назад, выгибается дугой, голову не держит, гуление неактивное.
Анамнез жизни: ребенок от 3-й беременности в возрасте матери 34 года, с токсикозом в 1-й половине беременности, с 28 недель – лечение по поводу плацентарной недостаточности, анемия 1-й степени. Роды по счету 2-е срочные, в 38 недель, плацентарная недостаточность в стадии компенсации, разрыв задней стенки влагалища. Закричал сразу. Вес при рождении – 2900 г. Рост – 50 см. Окружность головы – 35 см. Оценка по шкале Апгар – 8–9 баллов. В возрасте 1 суток отрицательная динамика – нарастание дыхательной недостаточности, тонико-клонические судороги, кислородозависимость, угнетение сухожильных рефлексов, дистония мышечного тонуса, внутричерепная гипертензия, переведен в отделение реанимации и интенсивной терапии.
Ультрасонография головного мозга (через большой родничок): незначительно выраженные гипоксически-ишемические изменения теменных отделов перивентрикулярных зон.
Уровень глюкозы на 2–4-е сутки от рождения норма. Ультразвуковое исследование внутренних органов – патологии не выявлено. Неонатальный скрининг от 25.08.2017 без патологии. Аудиологический скрининг на 4-е сутки от рождения: сомнительный.
Диагноз при переводе из роддома в отделение патологии новорожденных (переведен на 5-е сутки): церебральная ишемия средней тяжести в сочетании с натальным спинальным поражением шейного отдела позвоночника, острый период, гипертензионный синдром, судорожный синдром, пневмопатия, дыхательная недостаточность 1-й ст. Открытое овальное окно 2,7 мм.
Ультрасонография головного мозга (через большой родничок, на 8-е сутки): начальная дилатация затылочных рогов боковых желудочков. Диффузные отеки в затылочной области и по ходу сильвиевых борозд.
Ультрасонография головного мозга (в возрасте 2,5 месяцев): признаки смешанной гидроцефалии с преобладанием внутренней.
Нейрохирург от 13.02.2018: в нейрохирургическом лечении не нуждается.
КТ головного мозга от 20.12.2017 (в возрасте 4 месяцев; рис. 3): обширные зоны кистозно-глиозной трансформации в веществе головного мозга как следствие перенесенного гипоксически-ишемического поражения, в левом полушарии область кистозной трансформации соответствует бассейну левой средней мозговой артерии, в правом полушарии – находится в зоне смежного кровоснабжения между бассейнами правых средней и задней мозговых артерий. Отмечается значительное расширение центральных отделов и задних рогов боковых желудочков, более выраженное в левом полушарии как следствие атрофического процесса.
Сурдолог от 30.08.2017: сенсоневральная тугоухость справа?
Объективный статус при поступлении: общее состояние средней степени тяжести. Сознание ясное. Кожные покровы бледно-розовые, чистые. Форма головы округлая. Окружность головы – 40 см (прирост за 6 месяцев – 5 см). Кости черепа сомкнуты. Большой родничок – 0,5×0,5 см. Черепно-мозговые нервы: взгляд не фиксирует, не прослеживает. Зрачки D=S. Реакция зрачков на свет живая. Лицо симметрично. Язык по средней линии. Бульбарных нарушений нет. Гуление малоактивное. Мышечный тонус в конечностях повышен по спастическому типу. Сухожильные рефлексы с рук и с ног D=S, высокие. Голову не держит, не присаживается, не переворачивается, выгибается дугой, дистонические проявления, тремор конечностей. Грубая задержка психомоторного и речевого развития. Гипервозбудим, при плаче «закатывается» с напряжением в туловище и конечностях, с цианозом лица.
ЭЭГ (02.03.2018): эпилептиформная активность из левой гемисферы. Общемозговые изменения средней степени выраженности.
Консультации специалистов:
Психолог (01.03.2018): признаки органического поражения ЦНС, грубая задержка психомоторного развития.
Окулист (02.03.2018): не исключена корковая слепота. Наблюдение окулиста.
Логопед (05.03.2018): грубая задержка речевого развития.
С учетом обширности поражения вещества головного мозга и наличием выраженного неврологического дефицита с эпилептическими приступами имеется неблагоприятный прогноз для жизни.
После перенесенного пациенткой Н. ишемического инсульта и выявления у нее ряда генетических маркеров тромбофилии оба сына больной были консультированы гематологом и генетиком, а также был выполнен скрининг на поиск факторов риска тромбофилии (F2: 20210G >A, F5: 1691G >A, F7: 10976G >A, F13: 103G >T, FGB: -455G >A, PAI-1: -6755G >4G ITGA2: 807C >T, ITGB3: 1565 T >C; см. таблицу).
Результаты анализа однонуклеотидных замен в генах системы гемостаза выявили, что у матери наблюдалось совпадение следующих полиморфизмов со старшим сыном (пациент С.)
для трех генов: F13 (аллель G/T), ITGA2 (аллель С/T) и PAI-1 (аллель 4G/4G), а также совпадение аллеля С/С для гена ITGB3 с младшим сыном (пациент В.).
В то же время у обоих братьев выявлено совпадение по полиморфизму гена F7 (фактор VII свертывания крови, аллель G/A), также обнаружено совпадение аллелей G/T фактора XIII свертывания у матери и старшего сына.
Таким образом, при проведении генетического обследования выявлено наличие маркеров тромбофилии у матери и обоих ее сыновей с развитием ишемического инсульта в возрасте 34 лет у пациентки Н. и перинатального ишемического поражения головного мозга у ее детей.
Обсуждение
Анализ данных литературы показал достоверную ассоциацию только между наличием мутации фактора V свертывания крови (F5:1691G>A, мутация Лейдена) и протромбина (F2:20210G >A) и развитием перинатального ишемического инсульта [5–7]. В ряде исследований показано, что у детей, перенесших перинатальный инсульт, тромбофилия выявлена более чем в 50% случаев, причем более чем в 55% случаев тромбофилия была выявлена и у их матерей [5, 8]. В одной из публикаций [5] приводится описание перинатальных инсультов у двух детей от одной матери с диагностированной тромбофилией.
Однако в описываемых нами клинических случаях проведение генетического анализа не выявило каких-либо аномалий факторов свертывания F5 и F2 у матери и ее сыновей, что может свидетельствовать о вовлечении иных генетических факторов системы гемостаза в патогенез ишемического поражения головного мозга.
Связь между другими генетическими факторами риска развития тромбофилии и перинатального инсульта у детей остается спорной, однако комплексные исследования с оценкой количественных и качественных сочетаний полиморфизмов тромбофильного спектра мало представлены в литературе и остаются предметом изучения и поиска [7, 9].
Выявленные в описываемом нами семейном случае полиморфизмы гена серпина 1 (PAI-1) (4G/4G у матери и старшего ребенка и 5G/4G у младшего ребенка) свидетельствуют о недостаточности системы фибринолиза и, соответственно, о повышенном риске тромбообразования. Связь полиморфизмов гена серпина 1 (PAI-1) с развитием перинатального инсульта была также продемонстрирована в исследовании M. Golomb et al. [10].
Диагностированные нами полиморфизмы генов системы тромбоцитарного гемостаза (IТGА2-α2 интегрин, ITGB3-β интегрин), а именно совпадения у матери и ее детей по аллелям среднего риска, свидетельствуют о нарушениях тромбоцитарного звена гемостаза и склонности к повышенной адгезии и гиперагрегации тромбоцитов [11]. Следует отметить, что в литературе имеются единичные описания подобных изменений [7, 11–13].
В то же время в анализируемых нами клинических случаях выявленные полиморфизмы факторов F7 (G/A у обоих братьев) и F 13 (G/T у матери и старшего сына) свидетельствуют, напротив, о тенденции к гипокоагуляции. Данным фактом, возможно, объясняются геморрагические проявления в неонатальном периоде старшего ребенка.
Наличие факторов риска развития тромбофилии у пациентки Н., вероятно, способствовало отягощенному протеканию беременности и родов в обоих случаях рождения ее детей.
С другой стороны, по данным мета-анализа L. Luo et al., гипоксия плода во время родов служит дополнительным отягощающим фактором развития ишемического поражения головного мозга новорожденного [14], что в сочетании с факторами риска развития тромбофилии могло в большей степени способствовать развитию подобных изменений у описываемых нами детей. Это согласуется с теорией «двух ударов», когда на первый предрасполагающий тромбофилический фактор («первый удар») налагаются другие патогенетические факторы («второй удар»), что способствует развитию тромбозов. Более того, врожденная тромбофилия способствует увеличению размеров ишемического очага, повышает риск развития повторных и клинически немых инсультов [15].
Заключение
В описанном нами случае наличие факторов риска тромбофилии стало причиной развития ишемического инсульта в бассейне левой средней мозговой артерии у молодой женщины 34 лет. При обследовании ее двоих сыновей, у которых было диагностировано тяжелое перинатальное гипоксически-ишемическое поражение головного мозга, были также выявлены полиморфизмы генов среднего риска развития тромботических состояний, что могло послужить предрасполагающим фактором к развитию подобных патологических изменений.


