Артериит Такаясу (ранее – неспецифический аортоартериит) представляет собой системный васкулит, характеризующийся развитием гранулематозного воспаления аорты и ее ветвей, как правило, дебютирующий в молодом возрасте. Терапия первой линии данного заболевания включает применение глюкортикостероидов (ГКС), тем не менее около 20–30% больных остаются резистентными к монотерапии ГКС, у многих из них при попытке снижения дозы наблюдают рецидив, кроме того, лечение зачастую сопровождается развитием серьезных побочных эффектов. В связи с этим оправданна комбинированная терапия c присоединением базисных противоревматических препаратов (например, метотрексата, азатиоприна, микофенолата мофетила). При неэффективности данных схем лечения в настоящее время успешно применяют ГИБП – генно-инженерные биологические препараты (ингибиторы фактора некроза опухоли α – ФНО-α, ингибитор рецептора интерлейкина-6). Тем не менее применение современных ГИБП может быть связано с существенным риском развития оппортунистических инфекций.
Представляем вашему вниманию клинический случай артериита Такаясу, осложнившегося присоединением пневмоцистной инфекции, с развитием непереносимости к стандартным схемам лечения с применением триметоприма–сульфаметоксазола.
Клинический случай
Пациентка 25 лет. Из анамнеза известно, что заболевание дебютировало в январе 2011 г. после перенесенной инфекции верхних дыхательных путей, когда впервые стала отмечать общую слабость, сонливость, снижение работоспособности, эпизодическое повышение температуры тела до фебрильных значений, болей по передней поверхности шеи слева. При обследовании выявлено повышение уровня СОЭ, пролонгированный стеноз левой общей сонной артерии (90%). В апреле 2011 г. консультирована в клинике им. Е.М. Тареева: установлен диагноз «артериит Такаясу», начата терапия метилпреднизолоном в дозе 40 мг/сут. При обследовании в клинике им. Е.М. Тареева в 2012 г. выявлены признаки активности заболевания, в связи с чем к терапии рекомендовано добавить метотрексат (10 мг/сут с попыткой повышения), который впоследствии был заменен на микофенолата мофетил ввиду развития афтозного стоматита. При попытке снижения дозы метилпреднизолона менее 20 мг/сут наблюдали усиление воспалительной активности. По данным ультразвуковой допплерографии сосудов не было отмечено существенного нарастания стенозов. С сентября 2012 г. были отменены цитостатики в связи с их неэффективностью и побочными эффектами (повторные острые респираторные, мочевые инфекции, диспептические явления). При госпитализации в клинику в январе 2013 г. отмечены сохраняющаяся высокая активность заболевания, прогрессирующие стенотические изменения в сосудах. Ввиду недостаточной эффективности проводимой иммуносупрессивной терапии и плохой переносимости базисных противоревматических препаратов рекомендовано применение инфликсимаба в сочетании с повышенной до 40 мг/сут дозой метилпреднизолона. В дальнейшем регулярно проводились инфузии инфликсимаба по 300 мг (каждые 4–8 недель), что позволило добиться ремиссии системного васкулита, доза метилпреднизолона снижена до поддерживающей (4 мг/сут).
В октябре 2016 г. после переохлаждения отметила ухудшение состояния: фебрильная лихорадка, появление болей давящего характера в левой каротидной области, левой половине грудной клетки, непродуктивного приступообразного кашля. По данным лабораторного исследования, признаки острофазового воспаления: СОЭ – 100 мм/ч, С-реактивный белок – 138 мг/л, лейкоцитоз – 20×109/л. Ухудшение состояния было расценено как присоединение инфекции дыхательных путей, проведены амбулаторно два курса антибактериальной терапии (цефиксим, азитромицин) без положительного эффекта. Очередная инфузия инфликсимаба была отложена.
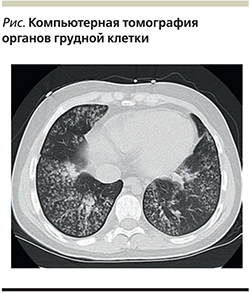 Госпитализирована в клинику им. Е.М. Тареева, выявленные при обследовании изменения, по данным компьютерной томографии (КТ) органов грудной клетки (двусторонние изменения, соответствующие специфическому инфекционному процессу, внутригрудная лимфаденопатия) (см. рисунок), повышение титра антител к Pneumocystis carinii (jirovecii), положительный результат полимеразной цепной реакции (ПЦР) исследования бронхоальвеолярной жидкости (БАЛЖ) на Pneumocystis carinii (jirovecii) позволили констатировать наличие пневмоцистной пневмонии у больной, получавшей лечение ГИБП.
Госпитализирована в клинику им. Е.М. Тареева, выявленные при обследовании изменения, по данным компьютерной томографии (КТ) органов грудной клетки (двусторонние изменения, соответствующие специфическому инфекционному процессу, внутригрудная лимфаденопатия) (см. рисунок), повышение титра антител к Pneumocystis carinii (jirovecii), положительный результат полимеразной цепной реакции (ПЦР) исследования бронхоальвеолярной жидкости (БАЛЖ) на Pneumocystis carinii (jirovecii) позволили констатировать наличие пневмоцистной пневмонии у больной, получавшей лечение ГИБП.
Была начата парентеральная внутривенная антибактериальная терапия триметопримом–сульфаметоксазолом с быстрым эффектом в виде нормализации температуры на вторые сутки. Однако ввиду непереносимости антибиотика (развитие приступа удушья при третьей и последующих инфузиях, несмотря на усиленную премедикацию) от его использования были вынуждены отказаться. Была проведена его замена на альтернативную схему, включившую клиндамицин в дозе 900 мг/сут в сочетании с гидроксихлорохином в дозе 600 мг/сут в течение 14 дней. В результате была отмечена положительная динамика в виде стойкой нормализации температуры тела, купирования кашля и болевого синдрома, регресса интерстициальных изменений и внутригрудной лимфаденопатии по данным повторной КТ органов грудной клетки, улучшения лабораторных показателей (нормализация СОЭ, уровня С-реактивного белка). Вместе с тем было подтверждено обострение основного заболевания: отмечено нарастание стенозов артерий головы и шеи. На фоне купирования инфекции было принято решение об усилении иммуносупрессивной терапии в виде увеличения дозы метилпреднизолона. В дальнейшем после разрешения инфекционного процесса был проведен очередной курс лечения инфликсимабом в сочетании с одновременным профилактическим приемом гидроксихлорохина с удовлетворительной переносимостью. Для контроля активности системного васкулита было рекомендовано продолжение терапии инфликсимабом в прежнем режиме, постепенное снижение дозы пероральных ГКС, также продолжен прием гидроксихлорохина в дозе 400 мг/сут.
Обсуждение
Pneumocystis carinii (jirovecii) – вид грибов, относящийся к роду бластомицетов, возбудитель оппортунистической инфекции, проявляющейся преимушественно атипичным поражением легочной ткани. Механизм передачи – аспирационный, а основным путем передачи являются воздушно-капельный, воздушно-пылевой, ингаляционный. Несмотря на принадлежность микроорганизма к царству грибов, пневмоцистные инфекции устойчивы к стандартным противогрибковым средствам.
К факторам риска возникновения пневмоцистной инфекции относят:
- Наличие ВИЧ-инфекции со снижением числа CD4+-клеток менее 200/мкл и не получающих профилактического лечения в отношении пневмоцистной инфекции. При этом наличие другой оппортунистической инфекции (например, кандидоза) повышает риск присоединения пневмоцистной инфекции.
- Наличие первичного иммунодефицита, включая некоторые формы гипогаммаглобулинемии, а также тяжелый комбинированный иммунодефицит.
- Длительная иммуносупрессивная терапия при лечении аутоиммунных заболеваний, после трансплантации солидных органов, гемопоэтических стволовых клеток.
- Наличие злокачественного заболевания.
- Тяжелая недостаточность питания.
Диагностика заболевания основана на выявлении микроорганизма одним из следующих методов:
- Гистологическое/цитологическое исследование ткани легкого, БАЛЖ, индуцированной мокроты.
- Количественное определение ДНК микроорганизма методом ПЦР в образцах мокроты, индуцированной мокроты, БАЛЖ, биоптатах легочной ткани – данный метод предпочтителен для больных без ВИЧ-инфекции.
Препаратом первого ряда при лечении пневмоцистной инфекции является триметоприм (15–20 мг/кг/сут)+сульфаметоксазол (75–100 мг/кг/сут) обычно внутрь, а при тяжелом течении внутривенно с продолжительностью лечения 14 дней; для больных ВИЧ она составляет 21 день. В отсутствие ВИЧ-инфекции положительную динамику наблюдают в течение 4–5 дней с момента начала антибактериальной терапии, у больных ВИЧ этот период может удлиняться до 8 дней. В отсутствие положительного эффекта следует перейти к альтернативной схеме лечения, т.к. присоединение дополнительного препарата к текущему лечению увеличивает риск побочных эффектов без улучшения прогноза.
Альтернативные схемы лечения включают использование пентамидина или атовакуона (препараты не зарегистрированы в РФ), а также сочетание триметоприма (15 мг/кг/сут) и дапсона (100 мг/сут), триметоприма и лейковорина, клиндамицина (450 мг 4 раза в сутки или 600 мг 3 раза в сутки) и препаратов хинолинового ряда (в первую очередь примахина, также можно обсуждать эффективность структурно близких ему хлорохина и гидроксихлорохина) [1, 2]. Также, согласно некоторым клиническим наблюдениям, эффективностью в отношении пневмоцистной инфекции обладает противогрибковый препарат каспофунгин [3], тем не менее его применение оправданно только при резистентности к стандартным схемам лечения, кроме того, необходимы дальнейшие исследования его эффективности и безопасности. В отдельных случаях при тяжелом течении с выраженной дыхательной недостаточностью прибегают к применению ГКС: преднизолон 40 мг 2 раза в сутки в течение 5 дней с последующим снижением дозы по схеме.
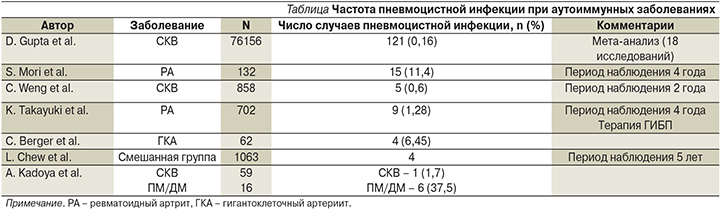
Ввиду того, что, как правило, пациенты с системными васкулитами получают длительное иммуносупрессивное лечение, возникает вопрос о необходимости проведения профилактики в отношении пневмоцистной инфекции. В отличие от ВИЧ-инфекции для пациентов с аутоиммунными заболеваниями, получающих иммуносупрессивное лечение, к сожалению, на данный момент не существует точных рекомендаций по превентивному лечению. Согласно данным исследований [4], частота возникновения пневмоцистной пневмонии у больных аутоиммунными заболеваниями достаточно низка, а всеобщее применение противомикробных средств представляет существенный риск развития серьезных побочных эффектов, а также устойчивости микроорганизма. По данным литературы, как правило, пневмоцистная инфекция развивается у 1–2% больных аутоиммунными заболеваниями, также встречают описания отдельных вспышек заболевания. Результаты исследований его частоты при различных аутоиммунных заболеваниях представлены в таблице. До настоящего момента остается неясным, существует ли предрасположенность к развитию пневмоцистной пневмонии при определенных аутоиммунных заболеваниях. Некоторые исследователи полагают, что риск может быть выше при полимиозите/дерматомиозите (ПМ/ДМ) и ниже при системной красной волчанке (СКВ) при равной интенсивности иммуносупрессивного лечения.
К факторам риска развития инфекции у данной группы больных относят высокую дозу ГКС (0,5 мг/кг/сут и более), наличие сопутствующих заболеваний легких или сердечно-сосудистой системы (например, хроническая обструктивная болезнь легких, ишемическая болезнь сердца), комбинированную терапию ГКС и цитостатиками, продолжительность терапии ингибиторами ФНО-α (инфликсимаб), наличие лимфопении и лейкопении, снижение числа CD4+-Т-лимфоцитов менее 200 в микролитре, активность основного заболевания [5, 6]. В настоящий момент остается актуальным поиск биомаркеров, ассоциированных с риском развития инфекционного осложнения. В ходе исследования [7] было показано, что фенотипирование лимфоцитов может иметь значение при решении вопроса о необходимости профилактики инфекции. Так, снижение числа CD3+- и CD8+-лимфоцитов связано с большим риском развития пневмоцистной пневмонии, а также более высокой смертностью больных аутоиммунными заболеваниями. Также рядом авторов [8] было предложено исследование наличия микроорганизма в мазках из зева методом ПЦР до начала лечения ГИБП для выявления групп, наиболее подверженных риску развития инфекции.
Четкие показания для профилактики инфекционных осложнений у пациентов с ревматическими заболеваниями не определены, считается, что она наиболее оправданна в следующих клинических ситуациях:
- комбинация циклофосфамида и ГКС;
- комбинация ритуксимаба и ГКС;
- длительный прием ГКС более 20 мг/сут в сочетании с другим иммуносупрессивным препаратом;
- комбинация ингибитора ФНО-α и ГКС в дозе 7,5 мг/сут и более.
Препаратом выбора для профилактики является триметоприм-сульфаметоксазол (80 мг/400 мг/сут или 160 мг/800 мг 3 раза в неделю) в отсутствие противопоказаний к нему. При его непереносимости возможны альтернативные схемы с применением дапсона (100 мг/сут), пентамидина 300 мг в форме аэрозоля 1 раз в месяц или атовакуона (препараты не зарегистрированы в РФ), препаратов хинолинового ряда отдельно или в сочетании с клиндамицином.
Заключение
Таким образом, при лечении ГИБП важно всегда помнить о риске развития оппортунистических инфекций. Для предупреждения тяжелых осложнений крайне необходимы ранняя диагностика заболевания (микроскопическое исследование образцов мокроты/БАЛЖ/биоптатов) и своевременное лечение соответствующими антибактериальными препаратами. Кроме того, необходимы дальнейшие проспективные многоцентровые исследования для установления более точных показаний к профилактике инфекции, а также ее продолжительности у пациентов данной группы.


