Введение
За последнее десятилетие ежегодная заболеваемость сахарным диабетом 1 типа (СД1) у детей демонстрирует драматический рост как в России, так и во всем мире. По данным Международной диабетической федерации (IDF), ее увеличение происходит на 3% в год [1]. Кроме этого во всех европейских странах отмечается «феномен омоложения диабета» – увеличение доли детей, впервые заболевших СД1 в более юном возрасте: до 80% – от 6 месяцев до 9 лет, 25–30% – до 4-летнего возраста.
В связи с этим закономерно увеличивается и распространенность СД1 среди детского населения.
По показателю заболеваемости СД1 у детей (0–14 лет) Свердловская область занимает одно из ведущих мест в РФ. На 1.01.2017 в Свердловской области на учете состоит 1221 ребенок с СД1. В год выявляется около 200 новых случаев СД1, из них около 75% впервые заболевших детей находятся в возрасте до 9 лет. За последнее десятилетие (2006–2016) ежегодная заболеваемость СД1 среди детей (0–14 лет) в Свердловской области увеличилась более чем в 2 раза (с 12,2 случая на 100 тыс. детей в 2006 г. до 26,2 – на 100 тыс. в 2016 г.).
Вместе с тем, несмотря на оптимальное лекарственное обеспечение детей в Свердловской области современными инсулинами (100% получают аналоги человеческого инсулина), средствами самоконтроля и инсулиновыми помпами (25% детей), а также на наличие качественного беспрерывного обучения в школе СД и наблюдения высококвалифицированными специалистами – детскими эндокринологами, сохраняется проблема достижения и поддержания компенсации углеводного обмена у детей. Так, при анализе базы данных эндокринологического отделения доля компенсированных детей (гликированный гемоглобин – HbA1c<7,5%) с длительностью СД1 более 1 года составляет в среднем 11,5% и существенно не отличается у пациентов на помповой терапии и использующих режим многократных инъекций инсулина (16,5 и 9,3% соответственно).
Результаты крупнейшего в диабетологии международного многоцентрового многолетнего исследования DCCT (The Diabetes Control and Complications Trial – Исследование по контролю диабета и его осложнений) доказали, что единственным управляемым фактором, влияющим на риск развития хронических осложнений диабета, является уровень HbA1c, и что только эффективный гликемический контроль может предупреждать возникновение осложнений [2]. Известно, что достижение оптимальной компенсации диабета в детской возрастной группе – достаточно сложная задача в связи с множеством причин: непредсказуемость аппетита, вариации уровня контринсулярных гормонов в различные периоды жизни ребенка, психосоциальные факторы и др. Кроме того, для детей критическое значение имеет как сам факт гипогликемии, так и ее восприятие родителями, являющееся существенным препятствием на пути достижения и поддержания оптимального уровня гликемии [3]. Особую тревогу вызывают эпизоды ночных гипогликемий, которые ведут к нарушению режима сна не только детей, но и родителей (опекунов), могут привести к развитию феномена Сомоджи (развитию постгипогликемической гипергликемии в утренние часы) и сложностям коррекции дозы базального инсулина.
Инсулин деглудек (Deg) – инновационный базальный инсулин нового поколения, обладающий сверхдлительным действием и самой низкой вариабельностью действия среди других традиционно применяемых базальных аналогов инсулина. В настоящее время это единственный базальный аналог инсулина, зарегистрированный к применению для лечения СД1 у детей старше 1 года. Доклинические исследования продемонстрировали сверхдлинное действие (не менее 42 часов) инсулина Deg, ровный беспиковый фармакологический профиль в течение 24 часов, низкую вариабельность гликемии [4]. Все перечисленные особенности фармакокинетического профиля инсулина Deg были подтверждены у детей и подростков [5]. Клинические исследования у взрослых пациентов с СД1 и СД2 показали, что инсулин Deg эффективно снижает уровень HbА1c и имеет преимущества в снижении глюкозы плазмы натощак (ГПН) в сочетании с низким риском развития ночных гипогликемий [6]. При последующем исследовании у детей инсулин Deg также продемонстрировал низкую вариабельность гликемии, сопоставимый контроль гликемии с инсулином детемир при высоком уровне безопасности, обеспечивая снижение частоты как гипогликемий, так и гипергликемий с кетозом [7].
Целью представленного анализа было изучение эффективности и безопасности применения инсулина Deg у детей с СД1 в реальной клинической практике.
Методы
С 1.03.2016 по 1.05.2017 на базе эндокринологического отделения ОДКБ № 1 и Городского эндокринологического диспансера г. Екатеринбурга были переведены на инсулин деглудек 60 пациентов с СД1 в возрасте от 9 до 17 лет (средний возраст – 14 лет).
В настоящий анализ включены данные наблюдения 12 детей, переведенных на Deg в качестве базального компонента базис-болюсной терапии с 1.03.2016 по 1.06.2016, и соответствовали критериям включения:
- длительность СД1 не менее 1 года независимо от наличия поздних осложнений;
- возраст ≥9 лет при стадии пубертата по Таннер >1;
- уровень HbA1c>7,5% и/или высокая вариабельность гликемии (суточная амплитуда колебаний гликемии >7 ммоль/л) и/или гипогликемии (уровень гликемии <3,1 ммоль/л) не реже 1 раза в неделю;
- частота проведения самоконтроля не менее 4 раз в сутки.
Исходные клинические характеристики анализируемой выборки представлены в табл. 1.
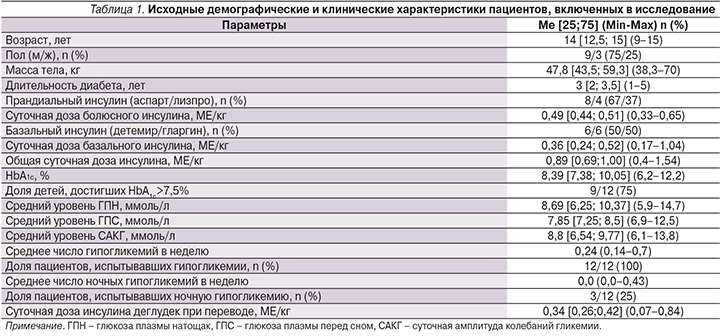
Основные оцениваемые конечные точки включили изменение уровня HbA1c (%) и долю детей, достигших компенсации СД1 (HbA1c<7,5%) через 12 и 52 недели после перевода на Deg.
Вторичные конечные точки включили изменение уровней ГПН, ГПС (с 22.00 до 24.00); суточной амплитуды колебаний гликемии (САКГ) – разница между максимальным и минимальным уровнями гликемии в течение 24 часов); среднее число гипогликемий <3,1 ммоль/л (СГ); среднее число ночных гипогликемий (СНГ) – случаи гипогликемии <3,1 ммоль/л, развившиеся с 00.00 до 8.00. Все показатели гликемии регистрировали на основании данных глюкометра и/или дневника самоконтроля, затем рассчитывали среднее значение за 7 дней, предшествовавших очередному визиту. Кроме этого анализировали динамику массы тела, дозы базального и болюсного инсулина (МЕ/сут и МЕ/кг/сут), а также частоту и выраженность нежелательных явлений (НЯ). Контрольные визиты проводили исходно (0-я неделя), через 1, 2, 4, 8, 12 и 52 недели.
Статистический анализ. Статисти-ческий анализ данных выполнен с использованием пакета прикладных программ Statistica 6.0 (StatSoft Inc., США) и Microsoft Excel. Проверку на нормальность распределения количественных показателей в группе проводили по критерию Колмогорова–Смирнова. Описание количественных данных выполнено с использованием медианы (Me), квартильного интервала [25-й; 75-й процентили], а также диапазона значений (Min-Max). Для сравнения двух или более связанных количественных признаков в выборке применяли критерии Уилкоксона (W) и дисперсионный анализ Фридмана (F). Для анализа различия двух качественных признаков в выборке использовали χ²-критерий Пирсона. Различия считались достоверными при p<0,05.
Результаты
Завершили все запланированные контрольные визиты 11 (92%) из 12 пациентов. Один пациент через 40 недель был переведен на инсулиновую помпу по желанию родителей.
Уже через 2 недели после перевода на Deg отмечено достоверное снижение уровня ГПН (с 8,69 [6,25; 10,37] до 7,75 [5,85; 9,0] ммоль/л; p=0,025) и САКГ (с 8,8 [6,54; 9,77] до 6,97 [5,8; 7,8] ммоль/л; p=0,049). Кроме этого существенно снизилось число эпизодов гипогликемий (с 0,24 [0,14–0,71] до 0,05 [0,0–0,14]; p=0,038), а у половины детей гипогликемии в течение суток вообще исчезли (12/12 против 6/12; p=0,0047). Необходимо отметить, что на протяжении этого периода наблюдения не было зафиксировано ни одного эпизода тяжелой гипогликемии, требующего посторонней помощи для ее купирования. Динамика лабораторных показателей через 2 недели после перевода на Deg представлена в табл. 2.
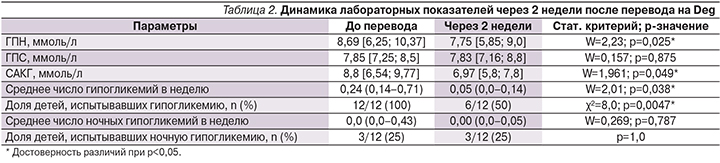
Через 4, 8, 12 недель и до окончания всего периода наблюдения не было выявлено достоверных различий в динамике лабораторных показателей по сравнению со 2-й неделей (критерий Фридмана и χ²-критерий, p>0,1). Через 12 недель после перевода на Deg (табл. 3) отмечено достоверное снижение уровня HbA1c на 1,43% (с 8,4 до 6,97%; p=0,007) и увеличение доли детей, достигших компенсации углеводного обмена (HbA1c<7,5%), с 25 до 67% (p=0,040). Кроме этого зарегистрировано дальнейшее достоверное снижение среднего уровня гликемии натощак (с 8,69 до 7,25 ммоль/л; p=0,018) и уменьшение суточной амплитуды колебаний гликемии (с 8,8 до 6,45 ммоль/л; p=0,015).
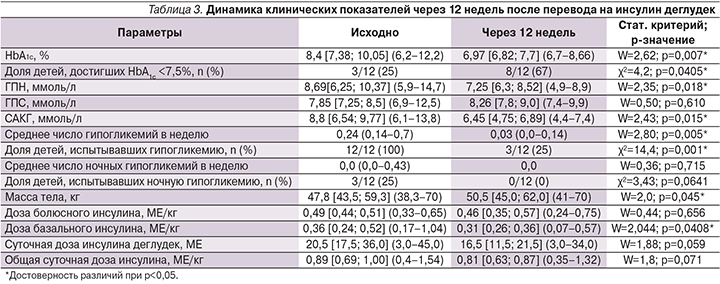
К концу периода наблюдения только у 3 детей было зарегистрировано по 1 эпизоду легкой дневной гипогликемии за неделю, предшествовавшую последнему визиту, а ночных гипогликемий не было выявлено ни у одного из пациентов. Вместе с тем имело место снижение на 20% средней дозы инсулина Deg (с 20,5 до 16,5 МЕ; p=0,059), а также достоверное уменьшение суточной дозы базального инсулина (с 0,36 до 0,31 МЕ/кг; p=0,0408), без значимых изменений общей суточной дозы – 0,89 против 0,81 МЕ/кг (p=0,07) и дозы болюсного инсулина – 0,49 против 0,46 МЕ/кг (p=0,656). В процессе всего периода наблюдения также не было зафиксировано ни одного эпизода НЯ.
С 12-й по 52-ю неделю наблюдения после перевода на Deg (табл. 4) продолжилось достоверное снижение уровня HbA1c – c 6,97 до 6,81% (на 0,16%; p=0,0076) и увеличение доли детей, достигших компенсации углеводного обмена (HbA1c<7,5% с 67 до 91%; p=0,159). Вместе с тем также отмечено дополнительное улучшение других параметров гликемического контроля: снижение ГПН на 0,75 ммоль/л (с 7,25 до 6,5 ммоль/л; p=0,006) и уменьшение среднего уровня САКГ на 1,75 ммоль/л (с 6,45 до 4,8 ммоль/л; p=0,007).
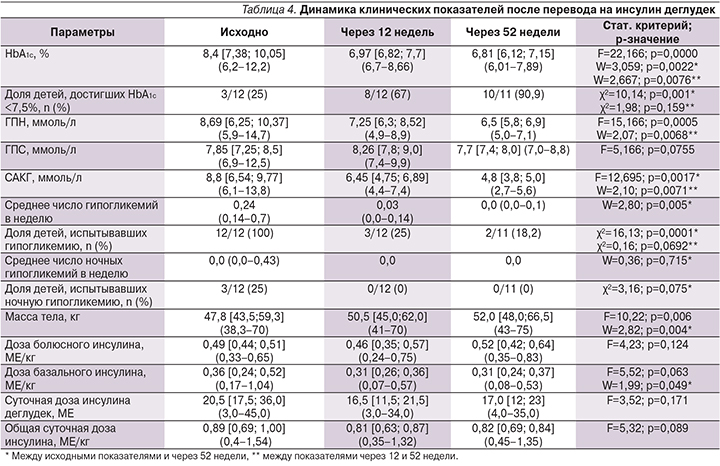
К концу периода наблюдения только у 2 детей было зафиксировано по 1 эпизоду легкой дневной гипогликемии за неделю, предшествовавшую последнему визиту, а ночных гипогликемий не было выявлено ни у одного из пациентов. Доза базального инсулина за указанный период существенно не изменилась и осталась прежней – 0,31 МЕ/кг/с.
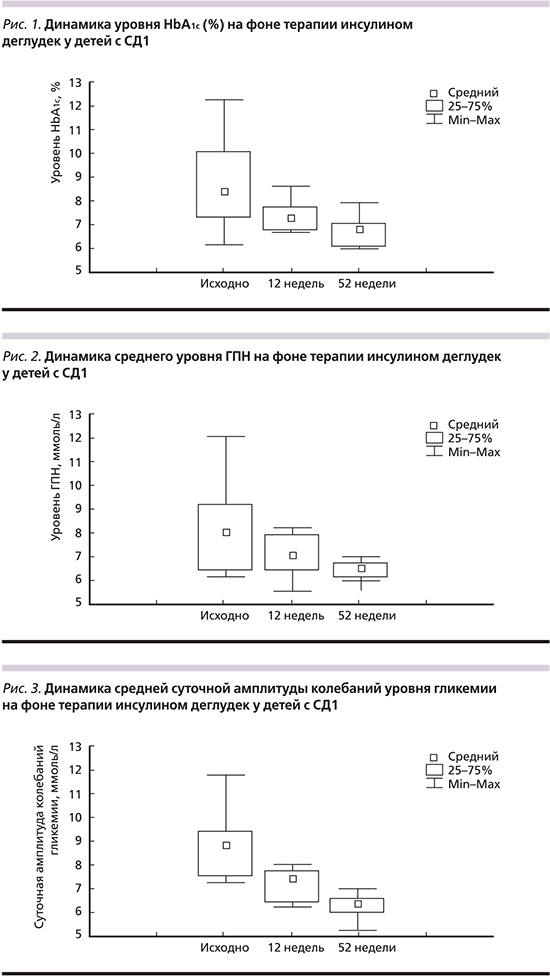
Таким образом, к концу периода наблюдения после перевода на Deg установлено достоверное снижение уровня HbA1c на 1,59% (рис. 1), а также значительное увеличение (на 66%) доли детей, достигших целевых значений HbA1c. В процессе наблюдения инсулин Deg продемонстрировал значимое снижение уровня гликемии в утренние часы с 8,7 до 6,5 ммоль/л (-2,2 ммоль/л; рис. 2) при полном отсутствии эпизодов ночной гипогликемии уже через 12 недель после перевода. Необходимо отметить выраженное уменьшение вариабельности гликемии на фоне применения инсулина Deg. Учитывая необходимость длительного поддержания целевого контроля гликемии у детей и отсутствие технических возможностей в осуществлении постоянного непрерывного мониторирования глюкозы в рутинной практике, для оценки вариабельности гликемии решено было использовать хорошо известный критерий компенсации диабета у детей – САКГ [8]. На рис. 3 продемонстрирована динамика среднего уровня САКГ на фоне применения Deg. Установлено достоверное снижение этого показателя на 4 ммоль/л, что на фоне существенного сокращения частоты суточных гипогликемий на 82%, подтверждает уникальные фармакокинетические свойства этого базального аналога инсулина. Кроме этого в процессе лечения зафиксировано статистически значимое снижение дозы Deg при переводе с других базальных аналогов инсулина на 14% (0,36 против 0,31 МЕ/кг; р=0,049). В процессе наблюдения не было зафиксировано ни одного эпизода тяжелой гипогликемии, развития кетоза и НЯ.
Обсуждение
У пациентов с СД1 интенсифицированная инсулинотерапия ассоциируется со снижением риска развития поздних осложнений [9], поэтому считается «золотым» стандартом медицинской помощи в детском возрасте. Вместе с тем достижение жесткого гликемического контроля повышает риск тяжелой гипогликемии [3]. С другой стороны, неадекватная сахароснижающая терапия может способствовать плохому гликемическому контролю и приводить к стойкой гипергликемии, а в некоторых случаях – к кетонемии и развитию диабетического кетоацидоза (ДКА), что связано с дополнительным риском летального исхода либо инвалидизации детей [9]. Профилактика ДКА имеет особое значение у детей и подростков с СД, составляющих группу особого риска.
Основной задачей лечения СД1 является поддержание состояния, близкого к нормогликемии, с целью предупреждения развития поздних микро- и макрососудистых осложнений, а также ДКА и гипогликемии, обеспечивая нормальный рост, половое созревание, физическое и психическое развитие, а также адекватное качество жизни. Достижение и стойкое поддержание целевых параметров гликемии могут быть трудновыполнимой задачей для детей и подростков с СД1, поскольку во время интенсивного роста и развития, а также в условиях постоянно меняющейся физической активности их потребность в инсулине постоянно меняется. Базис-болюсный режим с использованием традиционно назначаемых базальных аналогов инсулина (гларгин, детемир), обладающих улучшенными фармакологическими характеристиками, позволяет многим пациентам достигать оптимального гликемического контроля. Однако проблемы, связанные с особенностями фармакологического профиля препаратов инсулина, в т.ч. их вариабельность действия, требуют придерживаться введения препаратов, что может влиять на достижение оптимального гликемического контроля, особенно у детей и подростков, чей распорядок дня может существенно варьироваться.
Инсулин Deg – инновационный аналоговый инсулин сверхдлительного действия (продолжительность действия более 42 часов), обладающий плоским, стабильным профилем действия и минимальной среди доступных базальных инсулинов интраиндивидуальной вариабельностью сахароснижающего эффекта [4]. Сверхдлинное действие и ровный беспиковый профиль действия инсулина Deg обеспечивают лучший контроль гликемии натощак без повышения риска ночных гипогликемий как ключевого показателя безопасности базального инсулина [10–12], а также тяжелых гипогликемий [11, 12], что служит существенным преимуществом для детей, особенно в младшем возрасте. Кроме того, сверхдлительное действие обеспечивает поддержание необходимого базального уровня инсулина в крови в течение суток при однократном введении у всех больных СД, что позволяет сокращать число инъекций и снижать потребность в инсулине. Это также актуально при лечении детей и подростков с диабетом.
В данном исследовании детей с СД1 перевод на инсулин Deg, назначаемый и титруемый в соответствии с инструкцией по медицинскому применению 1 раз в сутки (в комбинации с продолжением применения ранее используемого прандиального аналогового инсулина), способствовал быстрому и стойкому улучшению гликемического контроля (снижение за 12 месяцев уровня HbA1c в среднем на 1,59%, ГПН – в среднем на 2,2 ммоль/л) при использовании меньшей дозы базального инсулина (в среднем на 14%). Также отмечено снижение САКГ в среднем на 4 ммоль/л. Как и в ранее опубликованном исследовании N. Thalange et al. [7], в настоящем исследовании на фоне терапии инсулином Deg в течение всего периода наблюдения ни у одного из детей не было зарегистрировано ни одного эпизода кетоза/кетоацидоза.
Улучшение гликемического контроля на фоне снижения потребности в базальном инсулине и уменьшение вариабельности гликемии сопровождались значимым уменьшением частоты гипогликемий, а также полным отсутствием эпизодов ночной и тяжелой гипогликемии у всех детей. Ночные гипогликемии представляют собой ключевой параметр при оценке безопасности базальных инсулинов, поскольку обычно они не зависят от применения прандиального инсулина, физической активности или приема пищи.
В многочисленных исследованиях у взрослых с СД было продемонстрировано, что увеличенная длительность действия и улучшенный фармакологический профиль позволяют вводить Deg в более гибком режиме без негативных последствий в отношении поддержания гликемического контроля и безопасности проводимой терапии [13, 14]. И хотя подобный подход и не исследовался в рамках настоящего исследования, отсутствие различий фармакокнетических профилей у детей и взрослых [15] позволяет при необходимости использовать возможность гибкого изменения времени между очередными инъекциями базального инсулина и у детей, что предоставляет дополнительные возможности в отношении поддержания оптимального гликемического контроля, делая лечение более удобным и способствуя повышению приверженности назначенной терапии.
Ограничением данного исследования служат небольшое число детей (n=12), возраст старше 9 лет и ограниченная (12 месяцев) продолжительность наблюдения. Кроме того, можно предположить, что более частый контроль изменения состояния пациентов после перевода на новый препарат и дополнительное информирование пациентов и их родителей/опекунов в отношении признаков гипогликемии могли повлиять на основные оцениваемые параметры (изменение гликемического контроля, дозирование и частота гипогликемических эпизодов), особенно в начале исследования.
Заключение
В условиях реальной клинической практики у детей с СД1 при переводе на инсулин Deg с традиционно назначаемых базальных аналогов инсулина уже через 2 недели отмечено значимое снижение гликемии натощак, уменьшение суточной вариабельности гликемии и уменьшение числа эпизодов гипогликемии, а к концу 12-месячного периода наблюдения продемонстрировано достижение максимально эффективного гликемического контроля (снижение HbA1c на 1,59% и увеличение доли детей, достигших компенсации углеводного обмена, на 66%) при оптимальной безопасности (сокращение числа гипогликемий на 88%) на фоне снижения дозы базального инсулина на 14%, что позволяет со всей уверенностью рекомендовать этот новый базальный инсулин к применению в клинической практике у детей.
Дополнительная информация
А.В. Кияев выступает с лекциями от компаний «Ново Нордиск», «Джонсон и Джонсон», «Мерк», а также является членом консультационных советов, поддерживаемых компанией «Ново Нордиск». Остальные авторы заявляют об отсутствии потенциальных и явных конфликтов интересов, связанных с подготовкой данной статьи.
Исследование выполнено по инициативе и при личном участии авторов при поддержке компании «Ново Нордиск». Компания не оказывала влияния на разработку протокола анализа, выбор пациентов, анализ и интерпретацию данных. Авторы несут полную ответственность за содержание и выводы, изложенные в этой рукописи.
Вклад авторов
Кияев А.В. – разработка концепции, дизайна, методологии исследования, координация и научное руководство исследования, анализ и интерпретация результатов исследования, написание черновика рукописи. Черных Л.Г. – сбор, обработка данных, анализ и интерпретация результатов исследования, подготовка черновика рукописи.
Кондрашова О.Е., Полляк О.Ю., Юсупова А.Р., Словак М.А., Зайкова И.О. – сбор, обработка данных, анализ и интерпретация результатов исследования. Все авторы имели неограниченный доступ к данным и участвовали в обсуждении результатов исследования, а также прочли и одобрили окончательный вариант рукописи.
Благодарности
Авторы выражают благодарность Алексеевой Яне Геннадиевне (Ново Нордиск, Россия) за помощь при подготовке статьи.


