Введение
Грипп и другие острые респираторные вирусные инфекции (ОРВИ) занимают ведущее место в структуре инфекционных болезней, оставаясь актуальной проблемой здравоохранения. Уникальная способность вирусов гриппа к генетической изменчивости обусловливает регулярное появление новых штаммов, по отношению к которым имеющийся популяционный иммунитет оказывается несостоятельным [1]. Вследствие антигенной изменчивости возбудителя заболеваемость периодически приобретает пандемический характер. Новый вирус А/H1N1/09 за короткий срок (с апреля 2009 г.) распространился по всему миру, укоренился в человеческой популяции, периодически доминируя в структуре заболеваемости гриппом, и обусловливает высокую летальность [2]. Ежегодно миллионы людей в мире заболевают гриппом, 3–5 млн – тяжелыми формами гриппа и 250–500 тыс. случаев заканчиваются смертью. В России каждый год регистрируют до 30 млн больных гриппом и ОРВИ, экономический ущерб составляет более 40 млрд руб. [1, 3]. В Республике Мордовия (РМ) заболеваемость гриппом в 2016 г. составила 318,5, в 2017 г. – 89,7 на 100 тыс. населения [Информационный бюллетень инфекционной заболеваемости в РМ, 2017].
Чаще и тяжелее всего болеют гриппом дети до года, лица старше 65 лет и лица с сопутствующей соматической патологией. Именно в этой группе летальность от гриппа особенно высока [4, 5]. Поэтому в некоторых странах учитывается и «отсроченная смерть от гриппа», обусловленная обострением хронических заболеваний (легочной и сердечно-сосудистой систем, болезней обмена) [6, 7]. В патогенезе гриппа ведущую роль имеет развитие двух синдромов: интоксикационного и респираторного. Вирус гриппа обладает выраженным иммунодепрессивным действием, способствуя развитию осложнений бактериальной этологии [1, 5].
Основным показателем степени тяжести заболевания служит выраженность интоксикационного синдрома [2]. Ведущее место в развитии синдрома интоксикации играет перекисное окисление липидов (ПОЛ) клеточных мембран, которое активируется свободными радикалами кислорода. Они образуются уже на ранних этапах инфекционного процесса. Генерирование активных форм кислорода (АФК) может стимулировать цитопатический эффект, деструкцию стенок капилляров, развитие отека легких и пневмоний. При гриппе активируются специфические процессы клеточного метаболизма – липопероксидации. Причиной резкого ухудшения состояния пациента с гриппозной инфекцией может явиться резкий «всплеск» активности процессов липопериокисления в клетках бронхолегочной системы, что является разрушительным фактором, ведущим к гибели клетки. Интенсивность процессов ПОЛ определяет тяжесть течения инфекционного процесса [8], является одним из патогенетических звеньев, формирующих синдром поствирусной астении [9, 10].
Препятствием активированной системы ПОЛ является противоокислительная система антиоксидантной защиты (АОЗ), снижающая скорость образования оксидантов. При высокой активности процессов липопериокисления развивается истощение АОЗ, изменяющее течение инфекционного процесса [11, 12].
В последние годы немаловажное значение придается оптимизации патогенетического лечения гриппа.
В связи с этим медикаментозная коррекция процессов ПОЛ приобретает особую значимость и актуальность, представляет значительные трудности. Лекарственные препараты, используемые в патогенетической терапии гриппа, не полностью соответствуют требованиям практического здравоохранения [10, 11]. Все это обосновывает поиск и применение новых препаратов, в частности с антиоксидантным типом действия.
Остаются малоизученными при гриппе процессы липопериокисления. Несмотря на многочисленность лечебных рекомендаций [11, 12], проблема коррекции процессов липопероксидации при гриппе остается актуальной. Мало сведений о влиянии препаратов с антиоксидантным действием, в частности 2-этил-6-метил-3-гидроксипиридина сукцината, на процессы ПОЛ при гриппе и целесообразность их использования при данной патологии. Известно, что антиоксиданты с успехом применяются при различной патологии [13], в т.ч. и для лечения постгриппозной астении [14].
Целью нашего исследования было изучить активность процессов перекисного гомеостаза при среднетяжелом и тяжелом течении гриппа на фоне базисной терапии и при дополнительном использовании препарата с антиоксидантными свойствами – 2-этил-6-метил-3-гидроксипиридина сукцината.
Материал и методы
Исследование проведено в ГБУЗ РМ «Республиканская инфекционная клиническая больница» на клинической базе кафедры инфекционных болезней МГУ им. Н.П. Огарева (Саранск).
Обследованы 2 группы пациентов: группа сравнения (35 человек с гриппом средней степени тяжести, 12 – тяжелой степени) и основная группа (33 человека с гриппом средней степени тяжести, 12 – тяжелой степени). Группа сравнения получала патогенетическую и симптоматическую терапию. Основная группа дополнительно к базисной терапии получала препарат с антиоксидантными свойствами – 2-этил-6-метил-3-гидроксипиридина сукцинат 5% – 4,0 на 200 мл 0,9%-ного раствора хлорида натрия, внутривенно капельно, 10 дней. Диагноз гриппа верифицирован на основании комплексной оценки клинических проявлений, эпидемиологического анамнеза, результатов лабораторных исследований методом иммуноферментного анализа и полимеразной цепной реакции. Грипп был вызван высокопатогенными вирусами A/H1N1/09, A/H1N1-сезонный, А/H3N2.
Активность процессов ПОЛ определена по уровню малонового диальдегида плазмы (МДАпл) и эритроцитов (МДАэр) в реакции с 2-тиобарбитуровой кислотой, диеновых кетонов (ДКе) и диеновых конъюгатов (ДКо), которые определяли спектрофотометрическим способом. АОЗ оценивали по активности каталазы плазмы (Кпл), каталазы эритроцитов (Кэр), которую исследовали спектрофотометрическим методом, и активности супероксиддисмутазы (СОД).
Обследование проведено в разгар болезни и в период ранней реконвалесценции. Сравнение лабораторных показателей проведено с группой практически здоровых добровольцев аналогичного возраста.
Полученные результаты обработаны статистически с помощью персонального компьютера и пакетов программ для статистической обработки «Microsoft Excel for Windows» и «Statistika 6,0» – определением t-критерия Стьюдента. Результаты считали статистически значимыми при p<0,05.
Результаты исследования
Клиническая картина гриппа характеризовалась развитием интоксикационного и катарального синдромов. Характерным симптомом гриппозной инфекции является гипертермия. При среднетяжелом течении продолжительность лихорадки составила 4,20±0,75, при тяжелом – 6,36±0,59 суток. Длительность интоксикационного синдрома зависела от степени тяжести гриппа. При средней степени тяжести общая слабость продолжалась 6,42±1,29, при тяжелом течении – 10,54±1,18 суток и сохранялась после клинического выздоровления у всех пациентов. Головная боль отмечалась 3,34±0,90 и 6,41±0,82 суток соответственно тяжести, мышечные боли беспокоили пациентов с гриппом средней степени тяжести до 2,12±0,55 суток и до 2,92±0,78 суток тяжелых больных. Сниженный аппетит наблюдался у пациентов с гриппом средней степени тяжести 4,26±0,65, при тяжелой – 6,66±0,78 суток.
Катаральный синдром появлялся к концу первых – началу вторых суток заболевания. Наиболее характерным симптомом был сухой мучительный кашель. Боль за грудиной беспокоила 91,43% пациентов с гриппом средней степени тяжести и 100% тяжелых больных. Ринит с незначительным отделяемым наблюдался у 85,71% среднетяжелых и у 90,9% тяжелых пациентов. Катаральные явления продолжались у больных средней степени тяжести 8,24±1,12, у тяжелых больных – 12,20±1,14 суток.
Вследствие интоксикационного воздействия на миокард в инфекционный процесс закономерно вовлекается сердечно-сосудистая система. В разгар болезни у 100% пациентов наблюдалась приглушенность тонов сердца, тахикардия, которая продолжалась 5,11±0,60 и 7,82±0,70 суток соответственно тяжести. При среднетяжелом течении гриппа у 92,65%, при тяжелой форме у всех пациентов выявлена гипотония длительностью 4,31±1,18 и 6,52±1,09 суток соответственно тяжести. У 44,1% пациентов со среднетяжелым и у 100% с тяжелым течением гриппа регистрировалась одышка с частотой дыхательных движений 22 и более вминуту.
При анализе показателей общего анализа крови при гриппозной инфекции мы не выявили существенных изменений. Значения лейкоцитарного индекса интоксикации (ЛИИ) при тяжелом течении болезни были более высокими, и не происходило их нормализации в период клинического выздоровления в отличие от среднетяжелой формы.
В период разгара гриппа как проявление интоксикационного синдрома выявлялся мочевой синдром (микрогематурия, альбуминурия). Он наблюдался в 22,1% случаев при среднетяжелой, в 41,7% – при тяжелой форме и исчезал в реконвалесцентный период. При тяжелом течении повышалось содержание мочевины и креатинина, сохранявшееся в период стихания клинических проявлений, составив 127,69±12,1 и 93,21±7,9 мкмоль/л соответственно.
Таким образом, ведущие клинические синдромы, интоксикационный (лихорадка, слабость, головная боль и др.) и катаральный, были наиболее выражены при тяжелой форме инфекционного процесса.
В формировании интоксикационного синдрома при гриппе большую роль играет повышение активности процессов липопероксидации клеточных мембран. Происходит чрезмерное накопление продуктов липопериокисления. При среднетяжелом течении гриппа в период разгара уровни ДКо превышали значения контроля в 1,47, в фазу ранней реконвалесценции – в 1,93 раза (р<0,001; табл. 1).
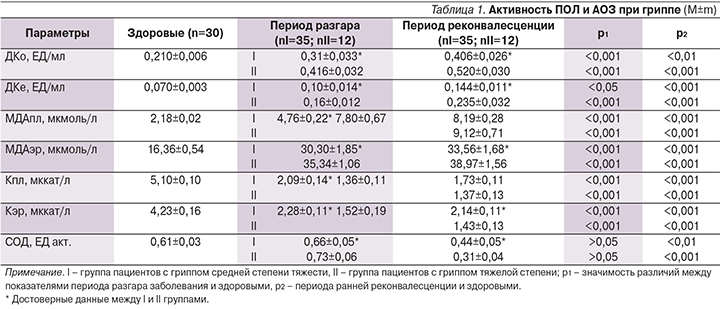
Уровень ДКе в разгар болезни был повышен в 1,43 раза (р<0,05), при клиническом выздоровлении он оставался высоким – 0,144±0,011 ЕД/мл. В разгар болезни значения МДАпл были повышены в 2,18 раза (р<0,001), в фазу стихания клинических проявлений – в 3,76 (р<0,001). Показатель МДАэр также был выше значений контроля: в разгар болезни – в 1,85, в реконвалесценцентный период – в 2,05 раза (р<0,001). Все это указывает на выраженную активность реакций липопериокисления в течение всего периода наблюдения, даже при клиническом выздоровлении.
При гриппе тяжелой формы уровень продуктов перекисного окисления был значительно выше, чем при среднетяжелой форме. В разгар заболевания показатель ДКо был выше контрольных показателей в 1,98 раза (р<0,001), ДКе – в 2,28 (р<0,001), МДАпл – в 3,58 (р<0,001), МДАэр – в 2,16 раза (р<0,001). Несмотря на клиническое выздоровление, уровень продуктов оксидативных реакций продолжал расти: ДКо превышал значения условно здоровых добровольцев в 2,48 раза (р<0,001), ДКе – в 3,36 (р<0,001), МДАпл – в 4,18 (р<0,001), МДАэр – в 2,38 раза (р<0,001). Другие исследователи также отметили наиболее выраженное повышение уровня промежуточного продукта липопероксидации – МДА, в сыворотке крови в острый период гриппа при тяжелой форме [15, 16].
Инфекционный процесс при гриппозной инфекции сопровождался снижением антиоксидантной ферментативной активности (табл. 1). У пациентов с гриппом средней степени тяжести в период разгара Кпл была снижена в 2,4 раза (р<0,001), Кэр – в 1,86 (р<0,001), СОД – не отличалась от активности аналогичного фермента группы контроля (р>0,05). В фазу ранней реконвалесценции сохранялась низкая активность ключевых ферментов АОЗ: Кпл по сравнению с группой здоровых лиц была ниже в 2,9 раза, Кэр – в 1,98, СОД в 1,4 раза (р<0,01).
При тяжелой форме гриппа нарушения в АОЗ организма были более существенными. Так, активность Кпл первые 2–3 дня болезни была снижена в 3,8 раза (р<0,001), при клиническом выздоровлении – в 3,7. Кэр в течение периода наблюдения была низкой (в 2,8 раза ниже показателя в контроле). Активность СОД в разгар болезни не отличалась от контроля (р>0,05), но в фазу ранней реконвалесценции она была ниже в 2,0 раза (р<0,001) показателей здоровых добровольцев.
Таким образом, при гриппе в фазу клинического выздоровления наблюдается дисбаланс в системе ПОЛ–АОЗ, наиболее выраженный при тяжелом течении, что может быть причиной развития осложнений и синдрома поствирусной астении. Полученные результаты при гриппе, свидетельствующие об активации процессов ПОЛ и дефиците АОЗ, позволяют обосновать медикаментозную коррекцию дисбаланса перекисного гомеостаза препаратами с антиоксидантным и мембраностабилизирующим действиями, свойственными 2-этил-6-метил-3-гидроксипиридина сукцинату.
При анализе динамики клинических симптомов гриппа установлено сокращение их длительности. При среднетяжелой форме болезни лихорадочный период укорачивался до 2,28±0,38 суток (р<0,05), при тяжелом течении – до 4,41±0,45 (р<0,05), продолжительность общей слабости снижалась у среднетяжелых пациентов с 6,42±1,29 до 3,28±0,78 суток, у тяжелых больных – с 10,54±1,18 до 7,18±0,88 суток (р<0,05). Длительность плохого аппетита уменьшалась с 4,26±0,65 до 2,48±0,56 суток при среднетяжелой форме и с 6,66±0,78 до 4,52±0,57 – при тяжелом течении (р<0,05). Продолжительность тахикардии сокращалась с 5,11±0,60 до 3,41±0,58 суток у среднетяжелых пациентов и с 7,82±0,70 до 5,67±0,69 – у тяжелых больных. При этом использование 2-этил-6-метил-3-гидроксипиридина сукцината в комплексной терапии гриппа не оказало влияния на длительность катарального синдрома, мышечной и головной боли и гипотонии. Дополнительное применение в лечении гриппа антиоксиданта приводило к нормализации ЛИИ (0,50±0,06; р<0,01).
Сочетанная терапия с 2-этил-6-метил-3-гидроксипиридина сукцинатом способствовала стабилизации процессов ПОЛ. Так, при среднетяжелом течении болезни включение его в комплексное лечение снижало ДКо в 1,42 раза, ДКе – в 1,76 (р<0,001), МДАпл – в 1,72 (р<0,01), МДАэр – в 1,24 раза (р<0,01) по сравнению со значениями группы, получавшей базисную терапию (табл. 2).

При тяжелой форме антиоксидантный препарат также содействовал уменьшению активности процессов липопероксидации. Активность ДКо снижалась в 1,27 раза, ДКе – в 1,62, МДАпл – в 1,26 (р<0,05), МДАэр – в 1,19 раза (р<0,05) по отношению к показателям группы сравнения. При этом все показатели (исключая ДКе при среднетяжелой форме) ПОЛ независимо от степени тяжести сохранялись выше контрольных значений, что обосновывает продолжение антиоксидантной терапии.
Таким образом, препарат с антиоксидантным эффектом, уменьшая активность реакций липопериокисления при гриппозной инфекции при обеих степенях тяжести, предотвращает прогрессирование синдрома эндогенной интоксикации, что доказывает его патогенетическое обоснование и эффективность.
Проведенная базисная терапия при гриппе не устраняла дисбаланс перекисного гомеостаза. В фазу ранней реконвалесценции у пациентов сохранялись высокие показатели первичных, вторичных продуктов ПОЛ и дефицит АОЗ. Использование 2-этил-6-метил-3-гидроксипиридина сукцината приводило к коррекции дисбаланса процессов липопероксидации (табл. 2). У больных средней степени тяжести гриппа активность Кпл повышалась в 2,2 (р<0,001), Кэр – в 1,95 (р<0,001), СОД – в 1,52 раза (р<0,01) по сравнению со значениями группы сравнения. При этом показатели активности СОД и Кэр нормализовались.
На пациентов с гриппом тяжелого течения применение в его комплексной терапии 2-этил-6-метил-3-гидроксипиридина сукцината также оказывало положительное действие, повышая активность ключевых ферментов АОЗ. Активность фермента Кпл увеличилась в 2,27, Кэр – в 1,71 и СОД – в 1,74 раза (р<0,001) по сравнению со значениями группы, получавшей только базисную терапию.
Обсуждение
В последние годы большое значение придается оценке интенсивности свободно-радикального окисления при различной патологии, в т.ч. и при инфекционных заболеваниях. В этих исследованиях показано, что излишнее накопление конечных и промежуточных продуктов реакций липопероксидации способствует деструкции и дестабилизации фосфолипидов мембран клеток и субклеточных органелл, приводя к развитию синдрома эндогенной интоксикации, иммуносупрессии и гибели клеток [17, 18].
В других работах показано, что антиоксиданты (антигипоксанты) связывают АФК и их назначают при гриппе: витамины Е, С, препараты эритроцитарной СОД – Эрисод, полидигидроксифенилентиосульфонат натрия [11, 15]. Кроме витаминов рекомендуются препараты селена, 2-этил-6-метил-3-гидроксипиридина сукцинат, метилэтилпиридинола гидрохлорид, глутамил-цистеинил-глицин динатрия [19, 20]. В терапию осложненного и тяжелого гриппа необходимо включать средства с антипротеазной и антиоксидантной активностью [21]: меглюмина натрия сукцинат, витамин Е [11].
Другие исследователи установили, что восстановлению функциональной полноценности системы ПОЛ-АОЗ при гриппе может способствовать применение курса витаминов, обладающих антиоксидантными свойствами (витамин С, Е) [19, 22, 23].
Заключение
Данные литературы свидетельствуют о развитии оксидативного стресса при гриппе и необходимости его коррекции антиоксидантными препаратами. Полученные нами результаты свидетельствуют о том, что 2-этил-6-метил-3-гидроксипиридина сукцинат способствует снижению содержания токсических продуктов реакций липопериокисления, предотвращению прогрессирования синдрома эндогенной интоксикации у больных гриппом среднетяжелого и тяжелого течения. При этом он содействует восстановлению антиоксидантного статуса организма, проявляющегося активацией ферментов – каталазы плазмы, эритроцитов и СОД, что свидетельствует об антиоксидантных свойствах препарата. Использование его в комплексной терапии пациентов с гриппозной инфекцией является эффективно и рекомендуется к применению в клинической практике врачей-инфекционистов с целью купирования оксидативного стресса и поствирусной астении.


