Введение
Хроническая обструктивная болезнь легких (ХОБЛ) и туберкулез (ТБ) до настоящего времени остаются распространенными заболеваниями среди инфекционных и неинфекционных поражений бронхолегочной системы, и заболеваемость ими, к сожалению, не имеющими тенденции к значимому снижению. Для них характерны сходные факторы риска, такие как курение, низкий социально-экономический статус и нарушение иммунной защиты организма. Сочетание этих двух нозологий у одного и того же пациента сопряжено неблагоприятным прогнозом и влечет за собой тяжелое социальное и экономическое бремя для индивидуума и для общества в целом [1, 2].
ХОБЛ остается той нозологией, смертность от которой продолжает расти, прогнозируется выход ХОБЛ на 3-е место как причины смерти среди хронических неинфекционных заболеваний. Ведущей же причиной смертности среди инфекционных заболеваний остается ТБ.
Сибирский федеральный округ и Омская область являются территориями с высоким уровнем заболеваемости ТБ (82,3 на 100 тыс. населения) [3–5], что определяет актуальность поиска новых подходов к ранней диагностике ТБ, особенно у лиц с сопутствующей бронхолегочной патологией [2-4]. Чаще всего ТБ локализуется в легких и при своевременном лечении имеет благоприятный прогноз. Но у лиц с отягощенным анамнезом, например если ТБ возникает на фоне ХОБЛ, возможно прогрессирование как основного, так и сопутствующего заболевания, снижение эффективности лечения, формирование больших остаточных изменений, угнетение иммунной системы и прогрессирование бронхообструктивного синдрома [6].
Естественная резистентность организма к ТБ обеспечивается совокупностью клеточных и гуморальных факторов [6, 7]. При проникновении микобактерий туберкулеза (МБТ) в организм главными фагоцитирующими клетками являются полиморфноядерные лейкоциты, моноциты и макрофаги. Нейтрофилы за счет бактериостатических, бактерицидных веществ и ферментов способны уничтожать МБТ [7]. Высокий уровень сопротивляемости к МБТ развивается лишь при кооперативном взаимодействии Т-лимфоцитов с макрофагами. Макрофаги способны уничтожать МБТ, продуцируя факторы некроза опухоли (ФНО) α и γ, NO-соединения или другие активные вещества [8, 9]. Известно, что туберкулезный процесс сопровождается в первую очередь синтезом иммуноглобулинов IgG1, IgG2, IgG3, IgM и IgA, Ig E [3]. Следовательно, изучение состояния иммунологической защиты как компонента местной защиты слизистой оболочки бронхов (СОБ) при ТБ может иметь важное значение для течения и прогноза заболевания [8, 9].
В патогенезе ХОБЛ важное значение имеет нарушение функционирования местной защитной системы легких с участием мукоциллиарного аппарата, реснитчатого эпителия с последующей активацией клеточного (альвеолярные макрофаги, нейтрофилы, лимфоциты и эозинофилы) и гуморального звеньев (иммуноглобулины, лизоцим, лактоферрин, антипротеазы, компоненты комплемента, интерферон) с участием С-реактивного белка, ФНО-α, интерлейкина-6 (ИЛ-6), ИЛ-8, миелопероксидазы, металлопротеиназы-8, интерферона-α, CD80 и CD86. Выраженность изменений клеточного и гуморального иммунитета может свидетельствовать о степени защиты бронхов при ХОБЛ [10].
Особенности же местного иммунитета СОБ при ТБ недостаточно изучены. Очевидно, что новые знания о клеточном составе СОБ могут быть использованы для оценки активности местного иммунитета у пациентов с ТБ, ТБ+ХОБЛ и прогноза заболевания [11].
Цитологическое исследование слизистой оболочки – неизвазивный диагностический метод, широко используемый в клинической практике. Он позволяет врачу не только определять состав и количество клеточных элементов в материале, но и имеет прогностическое значение. По мнению А.В. Кононова, «роль иммунной системы в регуляции регенерации установлена достаточно определенно, а сопряженность регенерации и воспаления является аксиоматичной [12]». Регенерация обеспечивает тканевой гомеостаз в физиологических условиях и восстановление нарушенных функций при их повреждении, а эффективность проводимой терапии определяется течением регенеративных процессов [13].
Несмотря на широкое использование цитологического метода, активного применения при изучении состояния местного иммунитета у больных, ТБ он пока не нашел.
Цель исследования. Изучение показателей клеточного состава СОЮ у пациентов с впервые выявленным ТБ и ТБ+ХОБЛ.
Материал и методы
Дизайн исследования: открытое проспективное клиническое исследование.
Под наблюдением находились 60 пациентов среднего возраста, мужчины с впервые выявленным ТБ, группа IА, находившиеся на лечении в противотуберкулезном диспансере № 4 Омска. В зависимости от наличия у них ХОБЛ как сопутствующего заболевания пациенты были разделены на 2 группы. Группу I составили 30 пациентов с изолированным ТБ легких, группу II – 30 пациентов с ТБ легких в сочетании с ХОБЛ (табл. 1).

Длительность заболевания ТБ до момента поступления в стационар составила от нескольких недель до нескольких месяцев (процесс диагностики и установления диагноза ТБ требует времени и не всегда возможен в первые сутки болезни). У пациентов группы II диагноз ХОБЛ либо был установлен ранее и они получали лечение у пульмонолога или терапевта, либо диагноз был поставлен нами в период госпитализации впервые вместе с ТБ.
Критерии включения в исследование:
- наличие ХОБЛ;
- отсутствие в анамнезе приступов удушья, характерных для бронхиальной астмы;
- наличие туберкулеза органов дыхания;
- добровольное согласие больных на участие в исследовании.
Критерии исключения:
- наличие тяжелых сопутствующих заболеваний сердечно-сосудистой системы, эндокринной системы, почек, печени;
- злокачественные новообразования легких;
- отказ пациента от участия в исследовании.
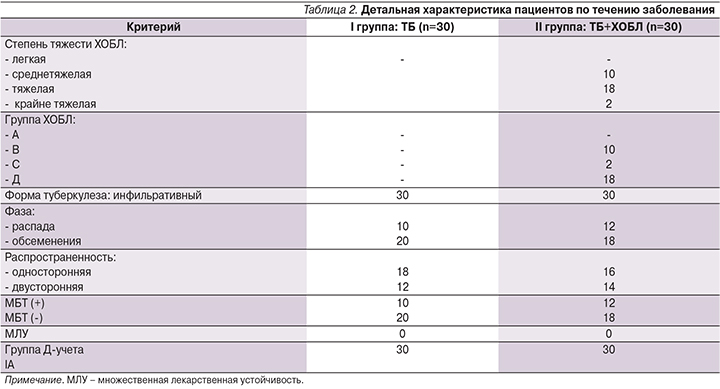
При поступлении в стационар диагноз ТБ был подтвержден результатами лучевого и лабораторного обследований – R-графия и мультиспиральная компьютерная томография (МСКТ) органов грудной клетки; исследование мокроты методами простой люминесцентной бактериоскопии, посевы на жидкие и плотные питательные среды.
В группе I у части пациентов наблюдался распад легочной ткани с выделением МБТ. Всем больным проведено лечение согласно стандартным режимам химиотерапии в соответствии с формой ТБ и стадией заболевания.
Диагноз ХОБЛ был поставлен на основании результатов спирографии с пробой с бронхолитиком, определения показателей постбронходилатациаонного объема форсированного выдоха в 1-ю секунду (ОФВ1) и его отношения к форсированной жизненной емкости легких (ОФВ1/ФЖЕЛ), для диагностики ХОБЛ соотношение ОФВ1/ФЖЕЛ составило ≤70%. По результатам спирометрии пациенты распределены по степеням тяжести по группам ХОБЛ. Большая часть пациентов имела среднетяжелую и тяжелую степени тяжести ХОБЛ (группы В и D) c выраженной симптоматикой и частыми обострениями.
Характеристика пациентов по течению заболевания представлена в табл. 2.
Всем пациентам проведена фибробронхоскопия (ФБС): пациентам с МБТ (-) независимо от сроков лечения, с МБТ (+) через 2 месяца после конверсии мазка на фоне химиотерапии по стандартным режимам.
ФБС проведена при помощи FB-3C «Olympus» (Япония) под местной анестезией 10%-ным раствором лидокаина. В конце манипуляции выполнен забор материала щеточкой для браш-биопсии. Вращательными движениями без надавливания материал наносился на предметное стекло. Мазки высушивали на воздухе, фиксировали в жидкости Никифорова, окрашивали гемотоксилином и эозином, микроскопировали при увеличении 7×90.
Оценивали цитологический состав материала от больных ТБ и ТБ+ХОБЛ. Определяли цилиндрический и плоский эпителий, проводился подсчет абсолютного количества лейкоцитов, нейтрофилов, лимфоцитов, оценивался удельный вес клеточного представительства различных видов лейкоцитов. Для нейтрофильных и эпителиальных клеток по критериям Л.А. Матвеевой (1986) [14] определены показатели клеточной деструкции: средний показатель деструкции (СПД), индекс цитолиза клеток, индекс деструкции клеток, индекс модуляции эпителия и процент метаплазии клеток. Номер класса деструкции (0–4) определен следующим образом: 0 – нормальная структура цитоплазмы и ядра клетки; 1 – деструкция не более половины цитоплазмы при нормальной структуре ядра; 2 – значительная, но неполная деструкция цитоплазмы, частичная деструкция ядра; 3 – полная деструкция цитоплазмы, значительная, но неполная деструкция ядра; 4 – полная деструкция с распадом цитоплазмы и ядра.
Статистическая обработка полученных результатов проведена методами вариационной статистики с применением параметрических и непараметрических критериев различия в программе Stаtistica 7 и с учетом требований к проведению анализа медико-биологических исследований. Средние величины приводятся в виде М±σ, где М – среднее арифметическое, σ – среднеквадратичное отклонение.
Публикация подготовлена в рамках поддержанного РФФИ научного проекта 17-16-55012.
Результаты
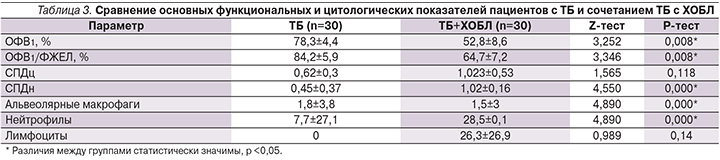
Результаты спирометрии и эндопульмональной цитограммы пациентов представлены в табл. 3.
Обсуждение результатов
Снижение ОФВ1 при спирометрии зафиксировано в обеих группах, но у пациентов с одним ТБ оно было незначительно и может быть обусловлено обратимым снижением проходимости бронхов в результате воспалительного отека. У пациентов с ТБ и ХОБЛ снижение значительно и связано с необратимой обструкцией в результате фиброза бронхов. Присоединение воспалительного отека при развитии ТБ у пациентов с ХОБЛ усугубляет обструкцию и ухудшает состояние пациентов. Снижение постбронходилатационного соотношения ОФВ1/ФЖЕЛ до 64,7% (<70%) подтверждает диагноз ХОБЛ во II группе больных.
Известно, что в бронхоальвеолярном лаваже здоровых людей 87–93% составляют альвеолярные макрофаги, 7–10% – лимфоциты и менее 1% – эозинофилы. Нейтрофильные лейкоциты в нормальной эндопульмональной цитограмме у здорового человека практически не встречаются (не более 1,5%). Их роль значительно повышается при любом воспалительном процессе в бронхолегочной системе. При выраженном воспалении в системе бронхи–легкие число нейтрофильных лейкоцитов резко возраста-ет до 60–70% [15, 16]. Для оценки клеточного состава был выбран СПД как наиболее информативный показатель, характеризующий изменения СОБ при различных патологических процессах.
В нашем исследовании в цитограмме больных увеличение содержания нейтрофилов в большей степени наблюдается в группе ТБ+ХОБЛ. Это является результатом присоединения неспецифического бактериального воспаления при наличии ХОБЛ. При существенном увеличении относительного числа нейтрофилов имеется значительное снижение содержания альвеолярных макрофагов у больных обеих групп, что свидетельствует об истощении макрофагального звена иммунитета. Это косвенно подтверждается данными литературы, согласно которым ТБ чаще развивается у иммунокомпрометированных пациентов [17–19].
При ТБ+ХОБЛ цитоморфологическое исследование СОБ выявило признаки выраженного воспалительного процесса с дистрофическими изменениями в нейтрофилах вплоть до цитолиза и одновременно высокую вероятность разрушения и деструкции цилиндрического эпителия. При изолированном течении ТБ выраженность деструктивных процессов в слизистой бронхов несколько меньше, что подтверждается меньшими показателями СПД.
Интересен тот факт, что индексы повреждения цилиндрического эпителия при изолированном ТБ в 1,5 раза выше, чем нейтрофилов. Мы объясняем это развитием при ТБ иного, не связанного напрямую с нейтрофилами типа воспаления, а более выраженные изменения цилиндрического эпителия бронхов рассматриваем как результат деструкции их слизистой оболочки. Полученные данные требуют дальнейшего изучения и интерпретации.
Заключение
При ТБ и ТБ+ХОБЛ наблюдаются значимые деструктивные изменения со стороны клеточного состава СОБ, что подтверждается результатами эндопульмональной цитограммы и СПД цилиндрического эпителия, а также нейтрофилов. Однако при сочетанной патологии (ТБ+ХОБЛ) показатели СПД превышают таковые при ТБ, что, возможно, связано с присоединением неспецифического воспалительного процесса, наличием необратимых склеротических изменения в бронхах. С другой стороны, при инфильтративном ТБ преимущественно поражается легочная ткань, а не бронхиальное дерево, как при ХОБЛ, следовательно, можно предполагать меньшую степень повреждения СОБ при ТБ, что и подтверждается низкими СПД.
Кроме того, использование эндоскопического исследования (ФБС) с применением щетки для браш-биопсии как способа забора материала для цитоморфологического анализа мазков-отпечатков является малоинвазивным по сравнению с биопсией СОБ, которая сама по себе сопряжена с высокой степенью травматизации поверхности бронхов. Но при этом информационная ценность метода достаточно высока для определения состояния клеточного иммунитета при бронхолегочной патологии. Особенности клеточного состава и показатели деструкции клеток позволят детализировать подходы к дифференциальной диагностике и оценке эффективности терапии пациентов с ТБ и ХОБЛ.


