Введение
Заболевания сосудов печени представляют важную проблему гепатологии и включают следующие состояния: синдром Бадд-Киари, нецирротический тромбоз воротной вены (ТВВ), идиопатическая портальная гипертензия (ПГ), синдром обструкции синусоидов, мальформация сосудов печени при наследственной геморрагической телеангиоэктазии и ТВВ при циррозе [1].
Впервые диагноз ТВВ, подтвержденный на аутопсии, был поставлен в 1862 г. С.П. Боткиным [2]. В зарубежной литературе тромбоз воротной вены впервые был описан G. Balfour и T. Stewart в 1868 г. [3].
При циррозе печени (ЦП) тромбозы ранее считались маловероятными, и антикоагулянты были противопоказаны, но клинические исследования последнего десятилетия показали, что ТВВ является при циррозе нередким состоянием: его частота среди кандидатов на трансплантацию печени без гепатоцеллюлярного рака колеблется от 2,1 до 23,3% [4–6], а по данным аутопсии, распространенность ТВВ среди пациентов с ЦП составляет 6–64% [7]. Отмечено, что частота ТВВ зависит от тяжести поражения печени и нарастает с классом ЦП по Чайлд-Пью.
Патогенез ТВВ при ЦП имеет многофакторный характер. Он обусловлен повышением уровня VIII фактора свертывания, снижением содержания протеина С, обладающего антикоагулянтным действием, и ослаблением портального кровотока [6]. Возможно и участие тромбофилических генетических дефектов, особенно модификации гена протромбина G20210A [8].
Чаще при ЦП формируется хронический ТВВ, обычно имеющий малосимптомное течение, но в ряде случаев возможно развитие острого тромбоза с внезапным ухудшением состояния, абдоминальной болью, лихорадкой, диспепсическим синдромом, декомпенсацией ЦП в виде нарастания симптомов ПГ и печеночной недостаточности.
Методом обследования первой линии при подозрении на ТВВ является допплерсонография сосудов печени, его чувствительность составляет 90% для полного тромбоза и 50% для частичного [4]. Компьютерная (КТ) и магнитно-резонансная томография (МРТ) позволяет более точно оценить протяженность тромба и распространение на другие вены, например мезентериальные.
Российских рекомендаций, а также четких алгоритмов по ведению пациентов с ТВВ при ЦП пока не разработано, но существуют европейские (EASL, 2015) и американские (AASLD, 2014) рекомендации по диагностике и лечению сосудистых заболеваний печени, включая ТВВ при ЦП [9].
В принципе возможна полная спонтанная реканализация воротной вены, особенно при ее частичном тромбозе [9]. Лечение включает назначение антикоагулянтов в течение нескольких месяцев: низкомолекулярный гепарин эноксапарин по 4000 МЕ/сут или селективный ингибитор Ха-фактора фондапаринукс по 2,5мг 1–2 раза в день, который в отличие от гепаринов не влияет на тромбоциты [1]. Риск кровотечений при антикоагулянтной терапии существует при содержании тромбоцитов менее 50×109/л и при наличии варикозно-расширенных вен пищевода. Параллельно назначению антикоагулянтов необходимо проводить мероприятия по снижению риска кровотечений (например, лигирование варикозно-расширенных вен пищевода, прием β-адреноблокаторов) [11]. Эффективность антикоагулянтов при ТВВ у больных ЦП продемонстрирована в ряде крупных когортных исследований. В недавнем рандомизированном контролируемом исследовании было показано, что лечение эноксапарином в дозе 4000 МЕ/сут в течение года способно полностью предотвратить развитие ТВВ без повышения риска кровотечений [12]. После курса лечения прямыми антикоагулянтами (гепарины) при ТВВ возможен переход на применение непрямых антикоагулянтов – антагонистов витамина К (АВК; варфарин). Основной проблемой при использовании АВК при ЦП служит тот факт, что исходное протромбиновое время у таких больных часто удлинено. Этот вопрос не изучался подробно в клинических исследованиях, и сегодня пациентам с ЦП АВК назначают с расчетом на достижение стандартного МНО 2,0–3,0, которое не вполне подходит для больных циррозом [1]. Альтернативные методы оценки эффективности АВК для пациентов с ЦП разрабатываются. При прекращении антикоагулянтной терапии после восстановления проходимости воротной вены у почти 38% больных в течение нескольких месяцев наблюдался рецидив ТВВ [13]. При прогрессировании тромбоза на фоне проводимой терапии показана консультация гепатохирурга для решения вопроса о хирургическом лечении. Длительность и характер применения антикоагулянтной терапии зависят от этиологии ТВВ (ЦП, гепатоцеллюлярный рак, тромбофилия, лейкоз и т.д.)
Клинический случай
Больная Б. 57 лет была госпитализирована в отделение терапии в декабре 2015 г. с жалобами на общую слабость, сонливость, тошноту, рвоту съеденной пищей (3 раза), кашицеобразный стул до 3 раз в сутки, увеличение живота, отечность голеней, потемнение цвета мочи и кожных покровов, на появление кожного зуда.
Из анамнеза заболевания известно, что периодически пациентка злоупотребляет алкоголем, 10 лет назад у нее были выявлены изменения в биохимических анализах крови (повышение уровней трансаминаз, билирубина), обследована в клинической инфекционной больнице им. С.П. Боткина, установлен диагноз «токсический гепатит». В 2009 г. проходило обследование и лечение в отделении гастроэнтерологии ГМПБ № 2, установлен диагноз ЦП (выписные эпикризы не представлены). После выписки длительное время получала рабепразол, панкреатин, урсодезоксихолевую кислоту, адеметионин. Осенью (октябрь–ноябрь) 2015 г. находилась на отдыхе на Средиземном море, чувствовала себя хорошо, употребляла алкогольсодержащие напитки (2 бокала вина в день). Ухудшение самочувствия наблюдает на протяжении последнего месяца, когда стала отмечать нарастание слабости, сонливости, за неделю до госпитализации отметила ухудшение состояния, проявившееся заторможенностью, тошнотой, периодически возникающей рвотной слизью и/или съеденной пищей, потемнением мочи, пожелтением склер и кожных покровов, появлением кожного зуда, увеличением живота.
Из анамнеза жизни известно, что в 25-летнем возрасте верифицированы диффузно-узловой зоб, тиреотоксикоз. Длительное время принимала тиамазол в дозе 5 мг, последние 6 месяцев препарат не принимала и уровень тиреоидных гормонов не контролировала. В марте 2015 г. произведено протезирование левого тазобедренного сустава (после травмы), в последующем на протяжении трех месяцев принимала антикоагулянт дабигатран. Вирусный гепатит отрицает. Не курит.
При поступлении: состояние тяжелое, заторможена, на вопросы отвечает замедленно. Конституция астеническая, пониженного питания. Рост 165 см, вес 58 кг. Кожные покровы и видимые слизистые оболочки желтушной окраски, иктеричность склер. Температура тела – 36,6°С. Пульс симметричный, 90 ударов в минуту, ритмичный. Артериальное давление – 120/70 мм рт.ст., границы сердца не изменены. Тоны сердца приглушены, систолический шум на верхушке.
Частота дыхательных движений – 20 в минуту, дыхание жесткое, хрипов нет. Язык обложен налетом желто-белого цвета, влажный. Расширение вен передней брюшной стенки. При пальпации живот мягкий, чувствительный в области правого подреберья, печень выступает из-под края реберной дуги на 6–8 см. Спленомегалия: нижний полюс селезенки плотный, выступает из-под края реберной дуги на 2 см. Умеренный асцит, пастозность голеней.
При обследовании в клиническом анализе крови выявлена тромбоцитопения до 66×109/л. В биохимическом анализе крови: АЛТ – 183 ЕД/л, АСТ – 311 ЕД/л, билирубин – 264,1 мкмоль/л (прямая фракция – 166,4 мкмоль/л), γ-глутаматтранспептидаза – 204 ЕД/л, калий – 3,1 ммоль/л, общий холестерин – 1,07 ммоль/л, общий белок – 60 г/л, альбумин – 29 г/л, протромбиновый индекс – 28%, МНО – 2,54, признаки метаболического алкалоза, тиреоидный статус в норме. В общем анализе мочи белок – 0,3 г/л. HBsAg, HCV Ab, HBcor Ab отрицательные.
Ультразвуковое исследование (УЗИ) органов брюшной полости: структура печени диффузно-неоднородная, эхогенность повышена, косой вертикальный размер правой доли – 150 мм, краниокаудальный размер левой доли – 124 мм, холедох – 5,4 мм, внутрипеченочные желчные протоки не расширены, воротная вена – 13,5 мм, селезеночная вена – 8,5 мм. Желчный пузырь – 83×31 мм, стенки уплотнены, не утолщены, без конкрементов. Селезенка – 160×62 мм, структура не изменена. Асцит: в брюшной полости над и под печенью свободная жидкость.
По данным фиброгастродуоденоскопии определялся кандидозный эзофагит 1-й ст., недостаточность кардии с пролапсом слизистой оболочки желудка в просвет пищевода, поверхностный гастрит с очаговой атрофией в антральном отделе желудка.
По данным многофазной (нативной, артериальной, портальной и отсроченной фаз) мультиспиралной КТ (МСКТ) c контрастированием per os и внутривенным контрастным усилением, в брюшной полости определяется масса свободной жидкости. Печень увеличена в размерах, преимущественно за счет левой доли, контуры ровные, бугристые. Плотность паренхимы диффузно снижена до 33–35 HU, структура ее неоднородна за счет неравномерного накопления контрастного вещества и мелких участков различной степени плотности. Ход сосудов в паренхиме значительно деформирован. Воротная вена – 16 мм. Отчетливо определяется вена в проекции круглой связки печени, множественные извитые коллатеральные вены в области ворот селезенки. Желчный пузырь заполнен, стенка его уплотнена, активно накапливает контрастное вещество. В полости рентгенконтрастные конкременты убе-дительно не определяются. Холедох не расширен. Селезенка увеличена. Паренхима неравномерно накапливает контрастное вещество. Поджелудочная железа дольчатой структуры, контуры ее четкие. Почки обычных размеров, формы, положения. Паренхима почек активно, симметрично накапливает контрастное вещество, кортикомедуллярная дифференцировка сохранена. Почечные чашечки и лоханки не расширены. Рентгеноконтрастные конкременты не определяются. Надпо-чечники не увеличены. Данных за увеличение абдоминальных лимфоузлов в зоне сканирования не получено.
В зоне сканирования визуализируются нижние отделы грудной клетки. Определяются извитые расширенные параэзофагеальные вены. Купола диафрагмы расположены выше обычного. Базальные отделы легких с явлениями компрессии. Заключение: КТ-картина соответствует поражению печени при циррозе. КТ-признаки портальной гипертензии. Асцит.
Консультирована гастроэнтерологом: состояние расценено как хронический гепатит токсического генеза, высокой активности с трансформацией в ЦП, класс «С» по Child–Turcotte–Pugh, с явлениями ПГ, печеночной-клеточной недостаточности (снижение белково-синтетической функции, печеночная энцефалопатия 1-й ст.). Были рекомендованы диета № 5, Нутрикомп Гепа, верошпирон, преднизолон 40 мг, рабепразол, лактулоза, инфузии адеметионина, L-орнитин-L-аспартата, Гепасола, альбумина.
На фоне рекомендованной терапии клинически состояние больной без положительной динамики: содержание общего белка снизилось с 60 до 54 г/л, сохраняются гипоальбуминемия (29 г/л) и гипохолестеринемия, повысился уровень трансаминаз (АЛТ со 183 до 188 ЕД/л, АСТ с 311 до 333 ЕД/л) и билирубина (общего с 378,3 до 469,3 мкмоль/л, прямого с 216,5 до 301,6 мкмоль/л). Улучшение наблюдалось только в виде нормализации уровня электролитов и уменьшения асцита.
23.12.2015 пациентка была осмотрена гепатологом, состояние расценено как тяжелое, обусловленное выраженностью холестаза и явлениями печеночно-клеточной недостаточности с неблагоприятным прогнозом. Диагноз: хронический токсический стеатогепатит высокой активности, цирротическая стадия (класс «С» по Child–Turcotte–Pugh, индекс MELD 25, инрдекс Maddrey 105) с синдромами ПГ (спленомегалия, гиперспленизм, отечно-асцитический синдром) и печеночно-клеточной недостаточности (печеночная энцефалопатия 1-й ст., снижение протромбинового индекса, альбумина, холестерина). Рекомендована ультразвуковая допплерография (УЗДГ) печеночных сосудов с целью исключения тромбоза. По результатам исследования выявлены признаки ПГ, окклюзионного ТВВ: воротная вена диаметром 11,5 мм, кровоток не картируется, нижняя полая вена проходима, кровоток затрудненный, диаметр – 17,5 мм, коллабирует до 50%. Печеночные вены сдавлены, кровоток монофазный, снижен. Селезеночная вена расширена до 13 мм, извита, кровоток инвертирован. Печеночная артерия расширена до 5 мм.
Пациентка консультирована сосудистым хирургом: риск оперативного лечения очень высокий, обусловлен тяжестью состояния больной, поэтому от оперативного лечения было решено воздержаться. Был отменен преднизолон.
Пациентка заочно проконсультирована с гепатохирургами Военно-медицинской академии, рекомендовано введение прямых антикоагулянтов (гепарин внутривенно инфузоматом) под контролем коагулограммы.
С 25.12.2015 начато введение фондапаринукса натрия (Арикстра) в дозе 2,5 мг 2 раза в сутки. На фоне терапии антикоагулянтами отмечена положительная динамика клинической картины и биохимических маркеров (рис. 1–4). При контрольной УЗДГ сосудов печени от 28.12.2015 положительная динамика: появление реканализованного, мозаичного кровотока в воротной вене. Но 28.12.2015 эпизод носового кровотечения, потребовавшего выполнения передней тампонады с быстрым положительным эффектом. В клиническом анализе крови регистрировалось снижение уровня гемоглобина до 113 г/л, уровень тромбоцитов не снизился – 89,2×109/л. Введение фондапаринукса было продолжено, но доза его уменьшена до 2,5 мг/сут. Клинически у пациентки отмечено улучшение общего самочувствия, уменьшение проявлений печеночной энцефалопатии, выраженности отечного синдрома, иктеричность не нарастала. При контрольном УЗИ положительная динамика: в брюшной полости и в малом тазу свободная жидкость не визуализировалась. По данным триплексного исследования печеночных и воротной вен (14.01.2016), признаки частичной реканализации воротной вены: диаметр – 10 мм, кровоток монофазный, пристеночный, линейный, лентовидный, вдоль верхней и нижней стенок. Просвет реканализован неравномерно до 45% по диаметру, линейная скорость кровотока – 8 см/с. Селезеночная вена: диаметр – 7 мм, кровоток антеградный. Нижняя полая вена не расширена, диаметр – 12 мм, кровоток фазный, синхронный с дыханием. Печеночные вены не расширены, диаметр до 5,5 мм, кровоток фазный. В биохимических анализах также отмечена положительная динамика: уменьшение цитолитического и холестатического синдромов, печеночно-клеточной недостаточности.
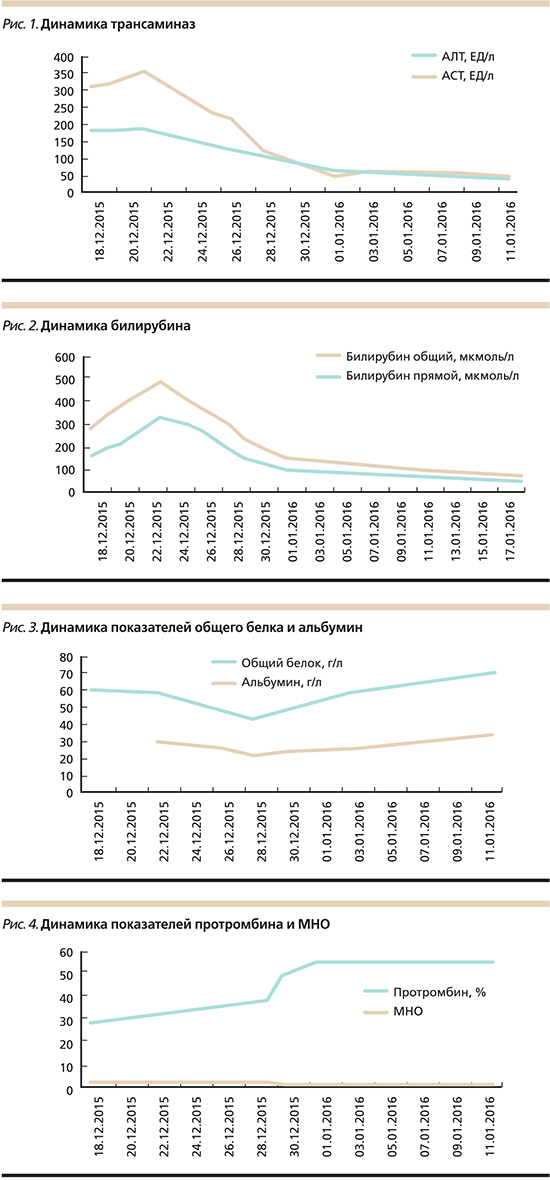
Пациентка выписана на амбулаторное лечение в удовлетворительном состоянии. Даны рекомендации по продолжению подкожного введения фондапаринукса в дозе 2,5 мг/сут до 6 недель под наблюдением врача и контролем клинического, биохимического анализов крови, коагулограммы, УЗДГ воротной вены, в дальнейшем решить вопрос о переводе на непрямые антикоагулянты. Рекомендовано продолжить прием рабепразола, ферментных препаратов, лактулозы, L-орнитина-L-аспартата (Гепа-Мерц), спиронолактона, β-адреноблокаторов.
Заключение
Нередким осложнением ЦП может быть ТВВ, скрининговым методом для его выявления является УЗДГ, затем показана МСКТ или МРТ для определения распространенности тромба. Данное обследование показано не только пациентам, ожидающим трансплантацию печени, но и остальным больным ЦП, особенно в случаях его быстрой декомпенсации. При выявлении тромбоза необходимо обследование на тромбофилию. Своевременная диагностика в случае ТВВ крайне важна, интервал времени между постановкой диагноза и началом антикоагулянтной терапии – наиболее важный прогностический фактор вероятности ответа на лечение [14]. При назначении антикоагулянтов необходимо параллельное снижении риска кровотечения (например, лигирование варикозно расширенных вен пищевода). При прогрессировании тромбоза на фоне проводимой терапии показана консультация гепатохирурга для решения вопроса о хирургическом лечении. Длительность и характер применения антитромботической терапии зависит от этиологии ТВВ (ЦП, гепатоцеллюлярный рак, тромбофилия, лейкоз и др.). Для оценки эффективности и безопасности антитромботической терапии, разработки российских рекомендаций по ведению и лечению пациентов с ТВВ, особенно при ЦП, требуются дальнейшие рандомизированные клинические исследования.


