Введение
Диарея, связанная с приемом антибиотиков, представляет собой одну из актуальных проблем современной медицины. Частота развития антибиотикассоциированных диарей (ААД) в зависимости от класса антимикробного препарата и наличия предрасполагающих факторов может варьироваться от 4 до 39% [1, 2]. В основе формирования ААД лежит нарушение состава кишечной микрофлоры в виде угнетения симбиотических микроорганизмов и роста патогенной флоры, в частности Clostridium difficile. Спектр клинических проявлений ААД может варьироваться от легкого течения в виде водянистой диареи до 3–7 раз в сутки, не сопровождающейся интоксикационным синдромом и системными проявлениями, до тяжелого течения, вариантом которого служит псевдомембранозный колит (ПМК). Отчетливой тенденцией последнего десятилетия является рост числа подобных тяжелых форм ААД и осложнений на фоне их течения (кишечная непроходимость, перфорация, фульминантный колит, токсический мегаколон). Объяснением этого феномена служат сохраняющееся широчайшее применение антибактериальных препаратов (АБП), рост числа хронических коморбидных заболеваний у пациентов, общее старение населения, а также появление новых вирулентных штаммов C. difficile [3, 4].
При этом не вызывает сомнений тот факт, что далеко не у всех лиц, получающих АБП, впоследствии развивается ААД. Было показано, что риск формирования ААД и ПМК повышается у пациентов старше 60 лет [5] на фоне приема химиопрепаратов, ингибиторов протонной помпы [6], при наличии фоновых заболевания желудочно-кишечного тракта, беременности [5]. Помимо этого были выявлены значительные различия по частоте развития ААД в зависимости от группы АБП, длительности курса и наличия повторных эпизодов назначения данной группы препаратов [7]. Высокий риск формирования ПМК отмечается у пациентов, перенесших в прошлом один или несколько эпизодов ААД [8]. Также широко обсуждается возможность рецидива инфекции C. difficile у данной группы пациентов на фоне других факторов, провоцирующих нарушения микробиоценоза кишечника.
В частности, в предшествовавших исследованиях было показано, что вирусные кишечные инфекции могут вызывать нарушения микробиоценоза кишечника, сопоставимые с действием АБП [9]. На сегодняшний день существует необходимость дальнейших исследований особенностей клинического течения ПМК, анализа параметров преморбидного фона и возможных пусковых факторов, а также оптимальных терапевтических подходов при данном заболевании.
Цель исследования – анализ современных аспектов клинико-лабораторного течения ПМК и определение оптимальных схем лечения данного заболевания.
Материал и методы
В исследование методом сплошной выборки были включены 122 пациента в возрасте от 18 до 96 лет (средний возраст – 48,8±7,6 года) c ПМК, проходивших лечение в 2016–2017 гг. в отделении кишечных инфекций Клинической инфекционной больницы им. С.П. Боткина (Санкт-Петербург), из них 35 (28,7%) мужчин и 87 (71,3%) женщин.
Всем пациентам проведена оценка клинических и лабораторных параметров, а также параметров эпидемиологического анамнеза и анамнеза жизни. Всем больным, вошедшим в исследуемые группы, осуществляли стандартное лабораторное обследование, включающее оценку показателей гемограммы, общего анализа мочи, копрограммы, биохимических параметров крови. Всем пациентам проведено инструментальное эндоскопическое исследование толстой кишки: 122 пациентам была выполнена ректороманоскопия, 24 (19,7%) из них дополнительно была выполнена фиброколоноскопия.
Диагноз устанавливался на основании характерных клинических и анамнестических данных, а также выявленных изменений при эндоскопическом исследовании сигмовидной кишки. Помимо этого всем пациентам проведено определение в кале токсинов А и В C. difficile-методом иммуноферментного анализа (ИФА), 80 (65,6%) больным – исследование генов токсигенности C. difficile-методом полимеразной цепной реакции (ПЦР).
Помимо этого осуществено обследование для выявления других патогенных кишечных микроорганизмов рода Shigella spp., Salmonella spp., Campylobacter spp., аденовирусов группы F, ротавирусов группы А, норовирусов 2-го генотипа и астровирусов в объектах окружающей среды и клиническом материале методом ПЦР с использованием гибридизационно-флуоресцентной детекции и культурального метода.
Клиническое наблюдение за больными осуществлялось ежедневно. Проводили оценку тяжести симптомов острой кишечной инфекции – диареи, рвоты, болей в животе, метеоризма, общих симптомов интоксикации (снижение активности, отсутствие аппетита, нарушение сна), выраженности лихорадочной реакции, наличия катаральных явлений со стороны верхних дыхательных путей и признаков эксикоза (снижение тургора, эластичности кожных покровов, появление сухости слизистых оболочек, наличия жажды и олигурии).
Все пациенты в условиях стационара получали комплексную терапию, включившую диетотерапию, регидратацию (инфузионное введение глюкозо-солевых растворов и пероральная регидратация), применение АБП, пробиотиков, пребиотиков и ферментных препаратов. Оценка тяжести течения ПМК и подходы к терапии соответствовали современным требованиям, изложенным в медицинских стандартах и клинических рекомендациях [8].
 Результаты
Результаты
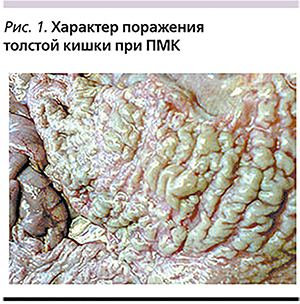
При проведении эндоскопического обследования всех пациентов была выявлена характерная макроскопическая картина: на протяжении дистальных отделов слизистой оболочки толстой кишки обнаружены беловато-желтые псевдомембранозные бляшки (рис. 1). В ряде случаев (n=26; 21,3%) отмечены фокальные язвенные дефекты. Наиболее часто при проведении фиброколоноскопии (n=24; 92,3%) протяженность поражения ограничивалась прямой, сигмовидной и реже (n=8) нисходящей толстой кишкой.
В единичных случаях (n=2; 7,7%) было выявлено тотальное поражение толстой кишки.
В лабораторных исследованиях выявить токсины клостридий методом ИФА удалось у 30 (24,6%) пациентов, методом ПЦР – только у 9 (11,3%). Стоит отметить, что только от 4 больных положительный результат был получен при анализе обоими методами.
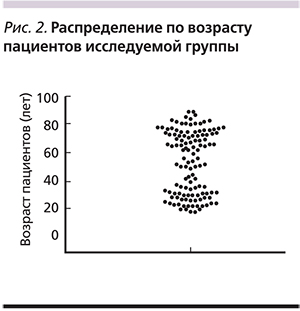 В исследуемой группе было выявлено две доминирующие по частоте возрастные группы пациентов (рис. 2): от 18 до 30 (n=32; 26,2%) и старше 60 лет (n=57; 46,7%).
В исследуемой группе было выявлено две доминирующие по частоте возрастные группы пациентов (рис. 2): от 18 до 30 (n=32; 26,2%) и старше 60 лет (n=57; 46,7%).
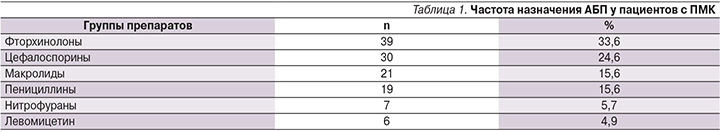
Частота назначения АБП убывала в ряду: фторхинолоны, цефалоспорины, макролиды, пенициллины, нитрофураны и левомицетин (табл. 1).
Средняя длительность предшествовавшей ПМК антибактериальной терапии составила 6,7±2,9 дня. Восьмидесяти двум (67,2%) пациентам прием АБП осуществлялся в течение ≥7 дней. АБП назначались в связи с соматическими (пневмонии, пиелонефриты, циститы, патология ЛОР органов), хирургическими (абсцессы, остеомиелит) и инфекционными (респираторные, кишечные инфекции, болезнь Лайма) заболеваниями. Следует отметить частое необоснованное назначение антибактериальной терапии в связи с острыми респираторными вирусными инфекциями, приведшее к формированию ПМК у 5 (4,1%) пациентов. У значимой доли больных (n=9; 7,4%) ААД предшествовало проведение эрадикационной терапии.
Особого внимания заслуживают пациенты с рецидивирующим течением ААД. В исследуемой группе у 12 (9,8%) пациентов в анамнезе имели место эпизоды диареи на фоне приема антибиотиков в течение предшествовавших 6 месяцев. В качестве факторов, провоцировавших рецидив ААД с тяжелым течением, можно выделить повторное назначение АБП широкого спектра (n=9; 75,0%) а также суперинфекцию другими возбудителями кишечных инфекций (n=6; 50,0%).
У большинства пациентов начало заболевания имело подострый характер. Появление симптомов ПМК отмечено в среднем через 9,2±3,6 суток после завершения курса применения АБП. Еще через 8–14 суток (в среднем – 10,2±5,7 суток) пациент госпитализирован, как правило, на фоне неэффективности симптоматической и патогенетической терапии. Тяжесть состояния в большинстве случаев была обусловлена выраженностью интоксикационного синдрома, дегидратации, а также декомпенсацией фоновой соматической патологии на фоне основного заболевания.
В клинической картине при ПМК отмечено сочетание диарейного, интоксикационного синдрома и выраженных абдоминальных болей.
Диарейный синдром характеризовался многократным (с частотой от 6 до 10 раз в сутки; среднее значение – 8,7±3,3) жидким стулом с примесью крови (n=38; 31,2%) и слизи (n=79; 64,8%). В копрограмме у большинства пациентов были выявлены воспалительные изменения, грубые нарушения переваривания пищи. Длительность сохранения диареи составила 8,5±1,8 суток. Длительность диарейного синдрома в группе пациентов пожилого возраста была больше по сравнению с остальными больными (10,3±2,7 и 7,2±1,9 суток соответственно; p=0,06).
У 119 (97,5%) пациентов отмечено сочетание диарейного синдрома с выраженными абдоминальными болями в области фланков живота и повышением температуры. Наиболее выраженное (высокая или пиретическая лихорадка) повышение температуры чаще отмечалось у пациентов молодого возраста по сравнению с более возрастными группами больных (p=0,03).
Показатели гемограмм пациентов при поступлении характеризовались значительным разнообразием. В большинстве случаев отмечено повышение общего уровня лейкоцитов (среднее значение – 14,3±2,9×109/л), более чем у половины пациентов были выявлены повышение СОЭ, нейтрофиллез, палочкоядерный сдвиг лейкоцитарной формулы. У части больных (n=42; 34,4%) преимущественно пожилого возраста повышения общего уровня лейкоцитов выявлено не было.
Обращало на себя внимание частое выявление гипопротеинемии (средний уровень общего белка – 57,3±6,3 г/л) в сыворотке крови при поступлении больных в стационар. Длительная диарея, нарушение нормального состава микробиоценоза кишечника и дисфункция со стороны пищеварительных ферментов, наблюдавшиеся при тяжелых формах ААД, закономерно приводили у пациентов к формированию вторичной белково-энергетической недостаточности у пациентов. Для коррекции данных состояний активно применялись белковые растворы для перорального приема.
В дополнение к этому в комплексной терапии при ПМК использовали средства оральной и парентеральной регидратационной терапии, патогенетические (сорбенты, ферментные препараты) и этиотропные средства. В качестве этиотропных препаратов применяли метронидазол и ванкомицин. В качестве стартового препарата использовался метронидазол в дозировке по 500 мг 4 раза в день (2 г в сутки). При неэффективности данной терапии в течение 3 суток осуществлялась замена препарата на ванкомицин в дозе 2 г в сутки). Замена препарата имела место в 86,9% случаев (n=106). У пациентов с рецидивом ААД (n=12; 9,8%) в качестве стартового препарата использовался ванкомицин.
Для восстановления микробиоценоза толстой кишки применялись пробиотические препараты, содержащие Lactobacillus acidophilus (species L. gasseri), Bifidobacterium infantis, Enterococcus faecium или Saccharomyces boulardii (табл. 2). Оба препарата хорошо переносились пациентами.
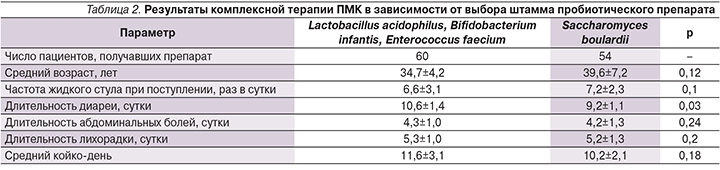
По результатам проведенного исследования оба препарата оказывали благоприятный эффект, способствуя восстановлению микробиоценоза кишечника при ПМК. При сопоставлении эффектов препаратов показано, что S. boulardii обладает более выраженным антидиарейным эффектом.
В среднем длительность сохранения интоксикационного синдрома составила 5,1±1,1, диареи – 8,5±1,7 суток. Был зарегистрирован один летальный исход у пациентки 86 лет с тяжелой сопутствовавшей патологией. Выписка из стационара осуществлялась в среднем на 10,9±2,7 сутки с момента поступления в связи с отчетливым клинико-лабораторным улучшением.
Обсуждение
Результаты нашего исследования подтверждают, что в настоящее время ПМК характеризуется сочетанием диарейного, интоксикационного и абдоминального болевого синдрома.
Обращало на себя внимание отчетливое доминирование (n=87; 71,3%) в исследуемой выборке пациентов женского пола. Сходные результаты были получены при проведении популяционного исследования в США, где доля женщин среди пациентов с ААД составила 63% [11].
Также среди больных ПМК было отмечено преобладание пациентов из возрастных групп от 18 до 30 лет и старше 60 лет. Общепринятой считается точка зрения, в соответствии с которой частота развития ААД и ПМК значительно возрастает у лиц пожилого возраста. Возрастающее выявление ПМК у лиц молодого возраста может объясняться как широким применением антибактериальных препаратов, так и ростом частоты фоновых соматических заболеваний в данной возрастной группе населения, приводящих к госпитализации в круглосуточные стационары. Было также показано, что наибольший риск формирования ПМК отмечен у пациентов, находившихся в предшествовавший период в хирургических (n=19; 15,6%) и реанимационных (n=8; 6,6%) отделениях многопрофильных больниц. Еще 6 пациентов (4,9%) проходили лечение в связи с онкологическими заболеваниями в профильных стационарах.
Формированию ПМК наиболее часто предшествовали курсы АБП групп фторхинолонов и цефалоспоринов. В качестве других факторов, способствующих развитию псевдомембранозного колита, следует отметить проведение эрадикационной терапии при хеликобактерной инфекции, а также кишечную суперинфекцию у пациентов с предшествовавшими эпизодами ААД. В частности, ранее было показано, что сочетанное применение АБП и ингибиторов протонной помпы повышает частоту формирования ААД в 1,7 раза по сравнению с монотерапией препаратами каждой из указанных групп [6].
Проводившаяся нами комплексная терапия больных ПМК включала пероральные белковые растворы, средства регидратационной терапии, этиотропные препараты (метронидазол и ванкомицин). Кроме того, использовались два пробиотических препарата, содержащие Lactobacillus acidophilus, Bifidobacterium infantis, Enterococcus faecium или Saccharomyces boulardii. Установлено, что S. boulardii обладает более выраженным антидиарейным эффектом. Это согласуется с данными других исследователей, показавших, что данный микроорганизм тормозит экскрецию токсинов A и B путем освобождения протеазы, одновременно усиливая их связывание с рецепторами мембраны щеточной каймы [12].
Заключение
Таким образом, ПМК является вариантом тяжелого течения ААД. Для эффективного лечения ПМК необходимо проведение комплексной терапии, включающей назначение этиотропных средств, пробиотических препаратов с правильно подобранными штаммами, а также патогенетических средств, таких как оральные белковые препараты для коррекции белково-энергетической недостаточности, ферментных препаратов и сорбентов. Проведение колоноскопического исследования пациентов с ААД может позволить значительно повысить частоту выявления тяжелых форм данного состояния и своевременно скорректировать лекарственную терапию.


