Тотальная эпидемия ожирения привела к быстрому росту частоты неалкогольной жировой болезни печени (НАЖБП) [1]. Сложность курирования пациентов с этой патологией обусловлена наличием нескольких фенотипов заболевания, которые включают стеатоз, стеатогепатит, фиброз, цирроз и возможную ассоциацию с сахарным диабетом 2 типа, гиперлипидемиями и сердечно-сосудистой патологией [2]. Течение НАЖБП может быть неблагоприятным. В США неалкогольный стеатогепатит (НАСГ) вышел на второе место среди причин трансплантации печени [3]. В связи с этим методы лечения НАЖБП привлекают всеобщее внимание и быстро развиваются [4, 5].
Авторы систематического обзора, посвященного диагностике НАЖБП, обратили внимание на целесообразность анализа всех возможных причин, обусловливающих гепатит, и заключили, что НАЖБП – это диагноз исключения [6]. В настоящее время установлено, что диагностическая ценность ультразвукового исследования и компьютерной томографии отчетливо уступает магнито-резонансной спектроскопии. У всех пациентов необходимо уточнять выраженность фиброза печени, для чего чаще используют эластометрию и серологические маркеры, а при необходимости сложной дифференциальной диагностики – биопсию печени с последующим морфологическим исследованием [7]. Диагностический алгоритм НАЖБП адекватно представлен в европейском гайдлайне по этой патологии (см. рисунок) [8].
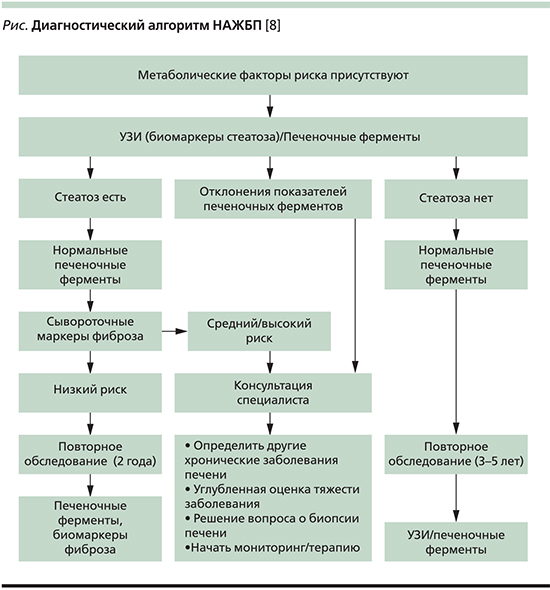
Лечение НАСГ заключается в применении дозированных физических нагрузок, модификации диеты, снижении массы тела, использовании инсулиновых сенситайзеров, назначении препаратов с цитопротективной активностью и антиоксидантов [9]. Рекомендации Российского общества по изучению печени и Российской гастроэнтерологической ассоциации считают возможным из препаратов с цитопротективной активностью использовать для лечения НАЖБП эссенциальные фосфолипиды, уродезоксихолевую кислоту, адеметионин, глицеризиновую кислоту и препараты, содержащие уровень силибинина [10]. Важное положение состоит в необходимости достаточно длительной, по крайней мере в течение года, непрерывной терапии патологии.
Z.M. Younossi и соавт. объясняют такой подход тесной ассоциацией НАЖБП с метаболическим синдромом, который в большинстве случаев требует многолетнего лечения [2].
В настоящее время накоплен большой материал, который позволяет констатировать, что применение препаратов полиненасыщенных жирных кислот (ПНЖК) считается важной стратегией терапии НАЖБП [11]. Патофизиологическое обоснование этого подхода носит фундаментальный характер. Современные работы демонстрируют, что в печени больных НАЖБП увеличено содержание всех основных классов липидов, включая нейтральные и мембранные липиды [12]. Качественный анализ композиции липидов демонстрирует повышенное содержание насыщенных жирных кислот и снижение количества ω-3 и ω-6 жирных кислот [13]. Низкое содержание ω-3 жирных кислот приводит к дисрегуляции функции печени, проявляющейся в нарушении синтеза и обмена липидов, что в свою очередь ведет к развитию воспаления и фиброза [14]. В эксперименте на мышах было показано, что фосфатидилхолин действует как агонист ядерного рецептора LRH-1, который регулирует биосинтез желчных кислот. Применение фосфатидилхолина повышает содержание желчных кислот, снижает уровень печеночных триглицеридов и сывороточной глюкозы, уменьшает стеатоз печени и улучшает гомеостаз глюкозы [15].
В последние годы выполнена целая серия клинических исследований эффективности препаратов ПНЖК у пациентов с НАЖБП. Y.H. Li и соавт. рандомизировали 78 пациентов с НАСГ в две подгруппы, одна из которых получала препарат ПНЖК, вторая не принимала медикаментозной терапии. Через 6 месяцев лечения в группе ПНЖК было достоверно снижено содержание в крови аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), триглицеридов, общего холестерина, маркеров системного воспаления, оксидативного стресса и фиброза [16]. C.K. Argo и соавт. выполнили плацебо-контролируемое исследование, во время которого 17 больных НАСГ получали препарат ПНЖК, другие 17 больных принимали плацебо в течение 1 года. В конце лечения у пациентов лечебной группы было отчетливо снижено количество жира в печени (p=0,003) по сравнению с контрольной группой [17]. Y. Qin и соавт. применяли препарат ПНЖК для лечения НАЖБП, ассоциированной с гиперлипидемией. Другие 40 пациентов получали препарат кукурузного масла. В конце лечения в группе, получавшей ПНЖК, было снижено содержание в крови АЛТ, γ-глютамилтранспептидаза (ГГТП), триглицеридов, общего холестерина, маркеров фиброза по сравнению с контрольной группой [18]. E. Scorletti и соавт. осуществили плацебо-контролируемое исследование, в котором 51 пациент с НАЖБП принимал препарат с ПНЖК и 52 больных НАЖБП – плацебо. В конце лечения была обнаружена тенденция уменьшения количества жира в печени в группе, получавшей ПНЖК, по сравнению с группой плацебо (р=0,1) [19].
В систематическом обзоре, посвященном анализу гайдлайнов различных стран по ведению пациентов с НАЖБП, был сделан вывод, согласно которому только препараты ПНЖК применяются для лечения этой патологии во всех регионах мира, тогда как использование других средств носит дискуссионный характер (см. таблицу) [20].

В мета-анализе, опубликованном в Journal of Hepatology в 2012 г., было проанализировано 9 исследований, включивших 355 пациентов с НАЖБП, получавших препараты ПНЖК. Наилучшие результаты были достигнуты для снижения жира в печени в группе лечения (p<0,001) [21]. X.X. He и соавт. в мета-анализе, опубликованном в 2016 г., отобрали 7 рандоминизированных плацебо-контролируемых исследований, включивших 442 пациента с НАЖБП. Авторы пришли к следующему выводу: препараты ПНЖК позволяют достигать улучшения содержания в крови АЛТ (р=0,004), триглицеридов (p<0,001), общего холестерина (p=0,001) по сравнению с лицами, получавшими плацебо [22]. В другом современном мета-анализе авторы проанализировали 10 рандоминизированных контролируемых исследований, включивших 577 пациентов с НАЖБП. Согласно выводу авторов, препараты ПНЖК дают достоверное улучшение в содержании жира в печени и снижении ГГТП в крови [23]. В официальном положении гайдлайна Европейской ассоциации по изучению печени (EASL – European Association for the Study of the Liver), опубликованном в Journal of Hepatology в 2016 г., указывается, что препараты ПНЖК снижают содержание уровня липидов в крови и печени и могут использоваться для лечения НАЖБП [8]. В положении 33 нового гайдлайна Американской ассоциации по изучению печени (AASLD – American Association for the Study of Liver Diseases) постулируется, что препараты ПНЖК могут применяться для лечения гипертриглицеридемии у пациентов с НАЖБП [24].
В положении 7.11 Азиатско-тихоокеанских рекомендаций, опубликованных в 2018 г., утверждается: препараты ПНЖК уменьшают содержание жира в печени и улучшают концентрацию липидов в крови у пациентов с НАЖБП [25].
Необходимо повторить, что в Российских рекомендациях по НАЖБП указывается, что эссенциальные фосфолипиды обладают антиоксидантными и противовоспалительными действиями, способны восстанавливать целостность клеточных мембран [10]. Препарат Эссенциале форте Н, являющийся препаратом ПНЖК, имеет огромную доказательную базу для лечения хронических заболеваний печени различной этиологии [26]. E. Sas и соавт. выполнили 7-летнее исследование эффективности эссенциальных фосфолипидов у пациентов с НАСГ и диабетом 2 типа. Терапию диетой и метформином (1000 мг/сут) получали 215 больных, 178 пациентов помимо этого принимали Эссенциале форте Н (1368 мг/сут). В группе, получавшей метформин и эссенциальные фосфолипиды, к окончанию лечения была достигнута достоверная динамика содержания АЛТ, АСТ и ГГТП. В группе монотерапии метформином отчетливых изменений печеночных ферментов в результате лечения не отмечалось. Морфологическое исследование печени и определение серологических маркеров фиброза при помощи тест-системы Fibromax показало отчетливое увеличение стеатоза и фиброза печени в группе монотерапии метформином, которые не регистрировались у пациентов на комбинированной терапии. Авторы пришли к выводу о высокой эффективности применения эссенциальных фосфолипидов в сочетании с метформином для пролонгированного лечения НАСГ у лиц с диабетом 2 типа [27]. A.I. Dajani и соавт. выполнили большое исследование эффективности применения эссенциальных фосфолипидов у пациентов с различными фенотипами НАЖБП: 113 пациентов со стандартным течением НАЖБП получали лечение диетой, физическими упражнениями, Эссенциале в дозе 1,8 г/сут в течение 24 недель, с последующим приемом 0,9 г/сут до 48 недель, 107 больных с сочетанием НАЖБП и сахарного диабета 2 типа принимали лечение, включившее диету, физические упражнения, инсулиновые сенситайзеры и Эссенциале в аналогичных дозах в течение 48 недель, 104 больных с комбинацией НАЖБП и гиперлипидемии помимо стандартной терапии получали статин и Эссенциале в течение 48 недель.
К окончанию лечения была получена отчетливая положительная динамика уровней АЛТ, АСТ, определена тенденция к снижению фиброза печени при эластографии при всех фенотипах заболевания [28].
В нашей стране для лечения НАЖБП широко применяется препарат эссенциальных фосфолипидов Эссенциале форте Н, в своем составе содержащий ПНЖК, экстрагированные из бобов сои. Эссенциале форте Н можно назначать как парентерально, так и перорально. Парентерально Эссенциале форте Н назначают в дозе 1–4 ампул (5–20 мл) в сутки в течение 10–30 дней.
Одновременно или после курса внутривенного введения рекомендуют начать прием препарата внутрь в дозе 6 капсул в сутки в 3 приема. Длительность лечения и кратность курсов устанавливается индивидуально, их оптимальная минимальная продолжительность составляет 3 месяца.
В целом, резюмируя данный обзор, необходимо подчеркнуть, что в настоящее время НАЖБП относят к самым частым заболеваниям печени. К нелекарственным методам лечения НАЖБП относится применение низкокалорийной диеты с достаточным количеством полиненасыщенных жиров и дозированных физических нагрузок с целью снижения массы тела. Среди лекарственных препаратов ведущие позиции занимают инсулиновые сенситайзеры, эссенциальные фосфолипиды (Эссенциале форте Н) и антиоксиданты (витамин Е).


