Актуальность
Mycoplasma pneumoniae – важный возбудитель острых респираторных заболеваний (ОРЗ) у детей. Доля микоплазменной инфекции (МИ) в структуре ОРЗ варьируется от 8 до 40%, зависит от региона, климатических условий, сезона года, динамики генотипического пейзажа на конкретной территории и циклических многолетних колебаний заболеваемости [1–5]. По мнению многих исследователей, МИ распространена значительно шире, чем представляется. Растущая заболеваемость МИ становится весомой проблемой здравоохранения, поскольку M. pneumoniae является одной из основных причин внебольничной пневмонии (ВП) у детей старше 5 лет, хотя может поражать различные отделы респираторного тракта, а также любые органы и системы [2, 6–8].
Описаны как фульминантные формы МИ [9], так и бессимптомное носительство возбудителя, причем, по данным E.B. Spuesens и соавт., M. pneumoniae обнаруживается в верхних отделах респираторного тракта (в полимеразной цепной реакции в реальном времени – ПЦР-РВ, серологических и культуральных тестах) с одинаковой частотой у здоровых детей и при ОРЗ [10]. ДНК M. pneumoniae может сохраняться на слизистых оболочках ротоглотки до 4 месяцев при бессимптомном носительстве и до 7 месяцев – после перенесенной респираторной инфекции [10, 11]. Интересно, что развитие тяжелых форм МИ, по-видимому, обусловлено избыточной иммунной реакцией на предыдущую бессимптомную инфекцию или носительство из-за положительного эффекта обратной связи [12]. Получены доказательства того, что выраженность клинических проявлений МИ (респираторных и «нереспираторных») и вероятность развития ВП служат результатом взаимодействия совокупности большого количества факторов – свойств M. pneumoniae и хозяина (генотипа возбудителя, величины бактериальной нагрузки, возраста пациента, его иммунологической реактивности) [13–15]. Многообразие клинических форм инфекции, отсутствие патогномоничных клинических признаков и надежных методов быстрой диагностики диктуют необходимость выделения предикторов высокого риска МИ у конкретного пациента с целью оптимального выбора эмпирической терапии.
Респираторный микробиом играет важную роль в поддержании физиологических функций дыхательной системы, влияет на частоту, тяжесть и продолжительность респираторных инфекций [16], тесно взаимосвязан с иммунной системой и микробиотой желудочно-кишечного тракта [17]. Обнаружены существенные различия микрофлоры дыхательных путей у детей с пневмококковой и микоплазменной пневмонией [18] или при вирусных инфекциях различной этиологии [19]. И хотя изучение микробиома дыхательных путей является быстро развивающейся областью научных исследований, данных о его изменениях в ассоциации с иммунным ответом хозяина при конкретных респираторных инфекциях недостаточно. Результаты исследований в этой области, особенно с учетом способности M. pneumoniae «уклоняться» от иммунной системы, будут способствовать пониманию взаимосвязей микробиоты различных анатомических сайтов с клиническим состоянием пациента и могут быть полезными для разработки тактики управления МИ.
Цель исследования: определить состояние микробиоты ротоглотки и толстого кишечника, фагоцитарной активности нейтрофилов периферической крови у детей с инфекцией M. pneumoniae.
Материал и методы
Проведено обсервационное сравнительное исследование, в которое включен 91 пациент в возрасте от 1 года до 7 лет независимо от пола. Критериями включения были среднетяжелые формы респираторной инфекции верхних (госпитализация в стационар не позднее 72 часов от начала заболевания) и нижних (госпитализация не позднее 6 суток от начала заболевания) дыхательных путей, подписание законными представителями ребенка информированного согласия на проведение исследования. В исследование не включались пациенты, имевшие функциональную или хроническую гастроэнтерологическую патологию, отягощенный аллергологический анамнез, получавшие антибактериальные или иммунотропные препараты в течение месяца, предшествовавшего госпитализации. Диагностика ВП проведена в соответствии с Федеральными клиническими рекомендациями [20]. Сбор биологического материала пациентов проведен в момент скрининга. Исследование одобрено Независимым этическим комитетом ГБУЗ МО МОНИКИ им. М.Ф. Владимирского.
Помимо рутинного выполнен следующий комплекс обследований:
- Для этиологической верификации диагноза МИ использованы иммуноферментный анализ (ИФА) с определением специфических иммуноглобулинов IgM, IgА, IgG к M. pneumoniae в сыворотке крови (тест – система M. pneumoniae IgM, IgА, IgG, «Savyon», Израиль) и ПЦР с определением ДНК возбудителя (в мазках со слизистой оболочки миндалин и задней стенки глотки). Мазки со слизистых оболочек ротоглотки отбирались в первые сутки госпитализации утром до еды. Сыворотки крови собирались на 5–7-е сутки от начала заболевания (в связи с предполагаемыми сроками выработки специфических антител). Этиологический диагноз МИ устанавливался на основании обнаружения ДНК возбудителя, специфических антител IgM и/или IgА в сочетании или без IgG в диагностических титрах. Наличие только специфических IgG в отсутствие ДНК возбудителя расценивалось как анамнестическое инфицирование.
- Бактериологическое исследование качественно-количественным методом мазков со слизистых оболочек ротоглотки (собранных утром натощак) и фекалий осуществлено в момент скрининга, результаты сравнивались с показателями здоровых детей [21, 22].
- Изучение фагоцитарной функции нейтрофилов периферической крови проведено с музейным штаммом Staphylococcus aureus 209P с определением фагоцитарной активности (ФА) нейтрофилов через 30 и 120 минут инкубации (ФА30 и ФА120) и фагоцитарного индекса (ФИ; число поглощенных микробных клеток) через 30 и 120 минут инкубации (ФИ30 и ФИ120). Индекс переваривания (ИП) нейтрофилов, отражающий литическую функцию фагоцитов, рассчитывался по формуле: ФИ120–ФИ30:ФИ30×100%.
На основании проведенных лабораторных исследований МИ диагностирована у 32 (35,2%) детей: при обнаружении диагностических титров IgM – у 18 (20%), IgM+IgG – у 12 (13%), ДНК+IgM+IgA+IgG – у 2 (2,2%) пациентов. Наличия только специфических IgG в отсутствие ДНК возбудителя или IgM/IgA в данном исследовании ни у одного из пациентов не было выявлено. Таким образом, анализ микробиоты ротоглотки и кишечника, ФА нейтрофилов у детей с МИ проведен в сопоставлении трех групп пациентов: МИ/IgM (n=18), МИ/IgM+IgG (n=14) и группы сравнения, в которую были включены пациенты, не имевшие диагностических доказательств МИ (n=59). В настоящем исследовании у всех пациентов были зарегистрированы только респираторные проявления МИ.
Статистическая обработка полученных данных произведена с помощью программного пакета Statistica 6.0 (StatSoft inc., США). Количественные переменные представлены в виде среднего арифметического и стандартной ошибки среднего. В связи с небольшой численностью групп применены непараметрические методы: U-тест Манна–Уитни (сравнение независимых переменных двух групп), Крускала–Уоллиса (KW-H, ранговый дисперсионный анализ для нескольких независимых переменных), Уилкоксона (сравнение зависимых переменных). Качественные признаки представлены в виде доли от общего числа наблюдений, выраженной в процентах. При сравнении качественных признаков использован χ2-критерий Пирсона или точный критерий Фишера при числе наблюдений в одной из ячеек 4-польной таблицы менее пяти. К множественному сравнению признаков (с поправкой Йетса) приступали только в случае обнаружения статистических различий при их одновременном сравнении. Сравнение качественных признаков проведено с помощью преобразования таблиц сопряженности. Сначала выделили группы, не различавшиеся между собой, объединили их, затем провели сравнение отличающихся групп. Для описания линейной связи количественных признаков нормально распределенной совокупности применялся коэффициент корреляции Пирсона, а для совокупностей, отличных от нормальных, – коэффициент ранговой корреляции Спирмена. Статистически значимыми считали различия при р<0,05.
Результаты исследования
Сравнительный анализ позволил выделить клинико-анамнестические признаки, отличавшие группы пациентов с МИ. Выявлена статистическая разница регистрации различных клинических форм ОРЗ в сравниваемых группах (р=0,029; df=6, табл. 1).

У пациентов с МИ в целом редко наблюдался стенозирующий ларинготрахеит (12,5 против 34%; р=0,050). У каждого второго ребенка с МИ/IgM+IgG была диагностирована ВП.
В группах пациентов с МИ большинство пациентов страдали повторными ОРЗ (65,6 против 37,3% в группе сравнения; р=0,0097, табл. 2). Сочетание IgM+IgG чаще регистрировалось у детей от 3 до 7 лет (78,6 против 53,3% в других группах; р=0,057) и в половине случаев сопровождалось длительным кашлем (не менее 4 недель) достоверно чаще по сравнению с группой МИ/IgM (р=0,022) или ОРЗ другой этиологии (р=0,027; табл. 2).
В целом шансы МИ у пациентов, госпитализированных в стационар и имевших указания на повторные ОРЗ в анамнезе, в 3 раза выше против тех, у которых повторные ОРЗ в анамнезе не регистрируются (табл. 3).
Поскольку ВП в группе МИ встречалась в 25%, а в группе сравнения – в 10,2% (р=0,117), дополнительно проведено сравнение подгрупп детей с ВП и без таковой у пациентов с МИ и другой этиологией ОРЗ. Было подтверждено, что повторные ОРЗ чаще регистрировались у пациентов с МИ вне зависимости от клинической формы (табл. 4).
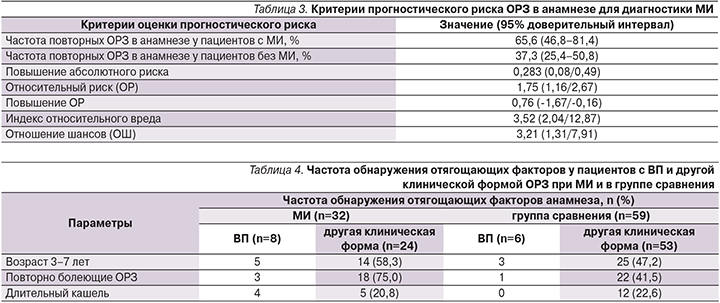
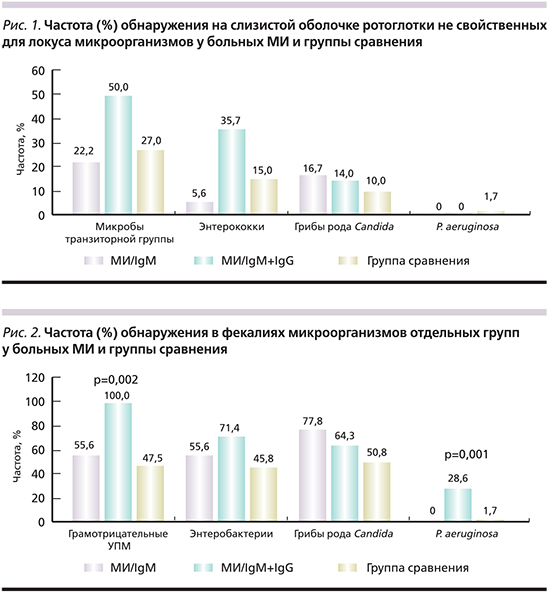
Частота и среднее содержание бактерий различных групп на слизистой оболочке ротоглотки и в фекалиях представлены в табл. 5 и на рис. 1, 2. Выявлены худшие бактериологические показатели пациентов с МИ.
Естественная для ротоглотки ассоциация α-гемолитических стрептококков и нейссерий была подавлена сильнее у пациентов с МИ, чем у детей с другой этиологией ОРЗ. Отсутствие роста нейссерий при МИ встречалось значительно чаще (р<0,001; df=2), причем не выявлено разницы между группами МИ/IgM и МИ/IgM+IgG, а также у пациентов с ВП и другой клинической формой МИ. Не свойственные для данного локуса микроорганизмы (энтеробактерии, псевдомонады, грибы, энтерококки) обнаружены у каждого второго пациента с МИ/IgM+IgG и только в четверти случаев – при МИ/IgM или ОРЗ другой этиологии (рис. 1; р>0,05). Отмечена четкая тенденция к выделению со слизистой оболочки ротоглотки энтерококков, которые являются естественной микрофлорой желудочно-кишечного тракта (р=0,089).
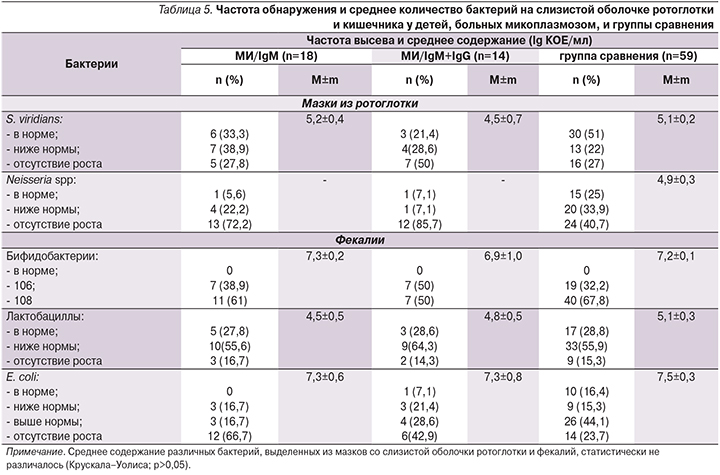
У всех обследованных детей из фекалий высевались бифидобактерии, и у большинства – лактобациллы (табл. 5). Отсутствие роста эшерихий нередко наблюдалось у пациентов с МИ и встречалось чаще, чем у детей с другой этиологией ОРЗ (р=0,009). Эшерихии выделялись лишь у двух пациентов с ВП микоплазменной этиологии, у половины (50%) – при других клинических формах МИ и у большинства детей с ОРЗ другой этиологии вне зависимости от клинической формы (при ВП микоплазменной этиологии – реже; р=0,012). Выявлена высокая частота высева из фекалий грамотрицательных условно-патогенных микроорганизмов (УПМ), которые обнаруживались в 100% случаев в группе МИ/IgM+IgG, и только у каждого второго (47,5–55,6%) пациента в двух других сравниваемых группах (р=0,002). У 28,6% детей группы МИ/IgM+IgG из фекалий была выделена синегнойная палочка, чего не наблюдалось в других группах (р<0,0001; рис. 2). Не выявлено статистических отличий среднего содержания различных бактерий, выделенных бактериологическим методом в мазках со слизистой оболочки ротоглотки и из фекалий у пациентов сравниваемых групп (табл. 4).
Фагоцитарная активность (ФА30), поглотительная и лизирующая способность нейтрофилов периферической крови были сниженными во всех сравниваемых подгруппах (табл. 6). Число нейтрофилов, вступивших в фагоцитоз через 120 минут инкубации, статистически не изменилось, тогда как у здоровых детей оно должно составлять треть значения ФА30. Не отличалась в сравниваемых группах и поглотительная способность фагоцитирующих нейтрофилов (ФИ30). Вместе с тем в группе МИ/IgM среднее число поглощенных нейтрофилами стафилококков за период инкубации не изменилось, в группе МИ/IgM+IgG – увеличилось, в группе сравнения – уменьшилось (см. табл. 6). Динамика ФИ только в группе сравнения была физиологической, хотя и отражала неполный лизис поглощенных стафилококков. Соответственно, ИП был нарушен наиболее глубоко в группе МИ/IgM+IgG (табл. 6).

У пациентов с ВП как микоплазменной, так и другой этиологии поглотительная способность фагоцитов была более низкой, чем при других нозологических формах ОРЗ (р<0,001, табл. 7).
Однако при ВП микоплазменной этиологии лизирующая способность фагоцитирующих клеток была наименьшей (по сравнению с другими подгруппами р<0,05–0,001).
В целом по выборке обнаружена прямая корреляция (р<0,05) количества α-гемолитического стрептококка, выделенного со слизистой оболочки ротоглотки, с поглотительной функцией нейтрофилов (ФИ30; r=0,55), а также нейссерий с ИП (r=0,48) и с числом лактобацилл в фекалиях (r=0,50), последние в свою очередь коррелировали с ФИ120 (r=-0,48) и ИП (r=-0,44).
Обсуждение результатов
Результатами настоящего исследования было показано, что у детей с МИ чаще регистрировались повторные ОРЗ в анамнезе, глубже была подавлена симбионтная микрофлора ротоглотки и кишечника, отмечены более глубокие дефекты лизирующей функции профессиональных фагоцитов и незавершенный фагоцитоз. Биомаркером глубины микробиологических изменений может быть дефицит нейссерий на слизистой оболочке ротоглотки и эшерихий в кишечнике. Вероятно, это косвенно отражает выраженность воспалительного ответа, т.к. максимальная глубина нарушений обнаружена при микоплазменной ВП. Маркером длительных дисбиотических нарушений, в т.ч. ассоциированных с повышенной заболеваемостью респираторными инфекциями, может служить высокая частота выделения УПМ, что в отличие от детей первых месяцев жизни не характерно для детей других возрастных групп, включенных в исследование. Аналогичные тенденции были выявлены нами в предыдущих исследованиях, причем высев не свойственных для ротоглотки энтеробактерий и энтерококков четко ассоциировался с недавно перенесенной ОРЗ [24].
Интересно, что пациенты, у которых было обнаружено сочетание специфических IgM+IgG или диагностирована ВП, характеризовались длительным (более 4 недель) кашлем в анамнезе. Ранее было показано, что более выраженный воспалительный (иммунный) ответ на внедрение M. pneumoniae и риск развития микоплазменной ВП наблюдаются у пациентов с повторным инфицированием или носительством возбудителя [12]. Длительные нарушения микробиоты на фоне повторных ОРЗ, признаком которых, по собственным данным, является высев не свойственных для локуса бактерий [24], могут быть основой восприимчивости к МИ. По данным литературы, конкурентные взаимодействия между бактериями влияют на то, какие виды колонизируют респираторный тракт и потенциально способствуют патогенезу ВП [25]. Представлены сведения, согласно которым состав микробиоты ассоциирован с тяжестью инфекции нижних дыхательных путей [26].
Нельзя исключить активацию персистирующей МИ (в т.ч. с развитием ВП) у 15,4% обследованных детей. По данным А.С. Nilsson и соавт., обнаружение ДНК M. pneumoniae на слизистой оболочке ротоглотки в течение длительного времени после заболевания – обычное явление [11]. При длительной циркуляции IgG и преобладании в группе МИ/IgM+IgG детей старше 3 лет, имеющих более разнообразные контакты в детских коллективах, повторное инфицирование с развитием клинической формы МИ также возможно. W. Jiang и соавт. и Е.В. Spuesens и соавт. продемонстрировали нередкое сочетание M. pneumoniae с респираторными вирусами у детей с ОРЗ, причем при микст-инфекциях величина бактериальной нагрузки была меньшей, что приводит к менее значительному антигенному раздражению иммунной системы, особенно у детей раннего возраста [10, 15]. В совокупности повторные вирусные инфекции и активация персистирующей МИ на их фоне, по-видимому, поддерживают воспаление в верхних дыхательных путях, что клинически проявляется длительным кашлем.
Как показало настоящее исследование, повторные ОРЗ и длительный кашель в анамнезе у ребенка с ВП могут служить поводом для диагностики МИ.
Известно, что внутриклеточная инвазия и другие вирулентные факторы M. pneumoniae обеспечивают ее способность «уклоняться» от иммунной системы. Имеются свидетельства о том, что МИ может вызывать иммуносупрессию и популяционный дисбаланс Т-лимфоцитов [27].
В настоящем исследовании у пациентов с МИ отмечено значительное угнетение поглотительной и лизирующией функций фагоцитирующих клеток, более выраженное при ВП. Ранее было показано, что более значительное угнетение фагоцитоза характерно для детей с затяжным течением МИ [28]. Способность M. pneumoniae длительно выживать в фагоцитах и оказывать повреждающее действие на макрофаги приводит к нарушению клеточной кооперации, необходимой для индукции специфического иммунного ответа [29]. Иммунная дисфункция, вызванная M. pneumoniae, а также дефицит фагоцитарных реакций после повторных ОРЗ играют важную патогенетическую роль в развитии персистенции возбудителя.
Таким образом, значительные нарушения микробиоты двух локусов и функций профессиональных фагоцитов, выявленные у пациентов с МИ, диктуют необходимость проведения дальнейших исследований, направленных на разработку патогенетических методов лечения с применением пробиотиков и иммунотропных препаратов, которые потенциально могли бы препятствовать персистенции возбудителя у предрасположенных групп пациентов.
Выводы
МИ диагностирована у 35,2% пациентов с ОРЗ, госпитализированных в стационар.
МИ, требующая госпитализации в стационар, чаще развивается у детей с повторными ОРЗ в анамнезе (ОР=1,75, 95% доверительный интервал [ДИ] – 1,16–2,67; ОШ=3,21 95% ДИ – 1,31–7,91).
У детей с МИ в отличие от пациентов с другой этиологией ОРЗ на слизистых оболочках ротоглотки обнаруживается дефицит нейссерий и не свойственные для локуса группы микроорганизмов, в кишечнике – дефицит эшерихий с активацией роста других представителей Enterobacteriaceae и Pseudomonas aeruginosa, что свидетельствует о нарушении соотношений симбионтных популяций микробиоты локусов.
У детей с МИ регистрируются глубокие нарушения киллинга поглощенных бактерий фагоцитирующими нейтрофилами периферической крови и незавершенный фагоцитоз, более выраженные при микоплазменной ВП.


