Введение
Юношеская миоклоническая эпилепсия (ЮМЭ) – это широко распространенная форма идиопатической генерализованной эпилепсии с миоклоническими приступами, с возможным наличием других типов приступов (генерализованные тонико-клонические приступы – ГТКП, абсансы), часто с дебютом в подростковом или юношеском возрасте и с особенностями электроэнцефалограммы (ЭЭГ) в виде генерализованных разрядов «спайк», «полиспайк», «волна» при нормальной фоновой ЭЭГ [1]. Клиническая практика свидетельствует о том, что, несмотря на «яркую» выраженность симптоматики, диагностика данного заболевания сильно запаздывает [2–4]. Сохраняются системные ошибки терапевтического менеджмента ЮМЭ как в России, так и за рубежом [5, 6]. В большинстве случаев полный контроль над приступами у больных ЮМЭ достигается на фоне применения низких доз соответствующих противоэпилептических препаратов (ПЭП), что важно помнить при составлении индивидуального плана реабилитации указанной категории пациентов [7]. В связи с тем что при ЮМЭ не наблюдается клинически значимых характерологических изменений, снижения интеллекта и обучаемости, такие пациенты хорошо социально адаптированы. Однако недооценка и поздняя диагностика антиконвульсант-индуцированных нежелательных побочных реакций (НПР) при нерациональной фармакотерапии может служить причиной выраженных когнитивных и психоэмоциональных расстройств, что в ряде случаев недооценивается практикующими врачами первичного звена. Необходимо отметить, что в случае ЮМЭ баланс между эффективностью и безопасностью ПЭП служит основой успешной реабилитации пациентов.
В данной статье представляем клинический случай, при котором наряду со своевременной диагностикой ЮМЭ в связи с нерациональной политерапией заболевания развились тяжелые НПР у девочки-подростка, явившиеся показанием к экстренной госпитализации, нарушению социализации и обучаемости.
Клиническое наблюдение
Пациентка Ю. 15 лет обратилась в Неврологический центр эпилептологиии, нейрогенетики и исследования мозга Университетской клиники КрасГМУ (далее – НЦ УК) в январе 2017 г. с жалобами на приступы, возникавшие в состоянии бодрствования, в дневное (чаще) и ночное (одиночные эпизоды) время суток, с внезапным ощущением страха, беспокойства, ощущением кома в горле, нехватки воздуха длительностью до нескольких минут, с расстройством сна, которые дебютировали зимой 2014 г. (в возрасте 13 лет) на фоне расстройства адаптации, обусловленного реакцией горя после развода родителей. В период дебюта симпатоадреналовых кризов девочка проживала с матерью, приступы возникали во время бессонных ночей, о них она рассказывала отцу по телефону, но не рассказывала матери (не будила ее ночью, не хотела беспокоить). Во время ночных кризов девочка обычно открывала форточку и дышала свежим воздухом, что облегчало ее самочувствие.
С лета 2014 г. девочка стала жить с отцом, но кризы сохранялись, а с весны 2015 г. они стали чаще, тяжелее, развивались преимущественно в дневное время суток как в школе, так и дома и начали сопровождаться повышением уровня артериального давления (максимально до 160/100 мм рт.ст.), дурнотой, иногда сужением уровня сознания, длительность приступов не превышала 1–2 минут. Во время кризов девочка обычно сообщала об ухудшении самочувствия учителям или родителям, ежедневно длительно (более 3 месяцев) принимала препараты валерианы (таблетки экстракта валерианы или капли Корвалол).
Во время очередного приступа в мае 2016 г., развившегося типично при волнении во время урока в школе, девочка на несколько минут утратила сознание и упала на пол со стула в проход между партами, судорог отмечено не было. С дифференциально-диагностической целью впервые была проведена рутинная ЭЭГ, зарегистрирована одиночная короткая (менее 1 секунды) диффузная вспышка с нечетко структурированными комплексами «поли-пик» – медленная волна средней амплитуды с лобно-центральным преобладанием, что было расценено консультирующим детским неврологом по месту прикрепления ребенка как коррелят миоклонического абсанса. Девушке выставлен диагноз ЮМЭ, назначено лечение: Кеппра (леветирацетам, ЛЕВ) в таблетках с постепенной титрацией дозы с 250 мг 2 раза в сутки до 1000 мг 2 раза в сутки к концу июня 2016 г. и пролонгацией терапии без динамического контроля уровня ЛЕВ в крови.
Летом 2016 г. в каникулярный период самочувствие девочки было относительно стабильным. Приступов с июля 2017 г. не было зарегистрировано в течение двух месяцев, но отмечено сокращение потребности в ночном сне. К леветирацетам-индуцированной инсомнии в сентябре 2016 г. присоединились гипервозбудимость, приступы с утратой сознания и подтеканием слюны, постприступной ретроградной амнезией. Девочка повторно проконсультирована детским неврологом, проведен терапевтический лекарственный мониторинг (ТЛМ), когда впервые диагностирована кумуляция уровня ЛЕВ в крови до токсического (более 58 мкг/мл при референсном коридоре 10–37 мкг/мл).
Однако лечащим врачом (детским неврологом) было рекомендовано продолжить прием таблеток Кеппры в суточной дозе 2000 мг, к лечению был добавлен второй ПЭП – Депакин-хроно (вальпроевая кислота, ВК) – с титрацией дозы до 1000 мг/сут (по 500 мг 2 раза в сутки) в течение месяца. Контрольное исследование уровня ВК в крови было проведено через 2 месяца – уровень субтоксический (более 85 мкг/мл) с развитием НПР в виде диффузного выпадения и истончения волос, нарастания нарушений менструального цикла по типу опсоменореи, снижения уровня тромбоцитов в крови, снижения настроения. Результаты дообследования и жалобы были рассмотрены лечащим врачом девочки, но коррекции лечения не проведено. Дополнительно по поводу тревожно-депрессивного синдрома пациентке был назначен Паксил (пароксетин) в таблетках, который затем ввиду низкой переносимости и эффективности был заменен на Золофт (сертралин) 50 мг в сутки, также метаболизирующийся в печени с участием изоферментов цитохрома-Р450 печени, как и Депакин-хроно. На фоне нерациональной политерапии и хронического интоксикационного синдрома к декабрю 2016 г. было отмечено нарастание ЛЕВ и ВК индуцированных непсихотических и психотических расстройств в виде когнитивных, эмоционально-волевых нарушений, выраженной гипервозбудимости, изменения поведения. В связи с нарастающими непсихотическими и психотическими расстройствами с нарушением социализации и снижением обучаемости девочка не смогла посещать школу и была переведена по решению педагогической комиссии на домашнее обучение. Однако противоэпилептическая терапия не была пересмотрена, тяжесть НПР нарастала, в связи с чем к вышеуказанной политерапии после 20 декабря 2016 г. были добавлены антипсихотики (рисперидон, тразодон, галоперидол), что привело к значительному нарастанию тяжести НПР со стороны центральной нервной системы в январе 2017 г.
10 января 2017 г. в дневное время при приготовлении пищи на кухне у девочки внезапно появилось ощущение страха, на фоне суженного уровня сознания девочка позвонила отцу и сообщила о том, что ее кто-то хочет убить, когда отец через несколько минут прибыл домой, девочка в состоянии суженного сознания смогла открыть ему дверь, на ее левом запястье была глубокая поперечная кровоточащая «царапина» ножом. Девочка была возбуждена, беспокойна, прыгала по квартире, по дивану, неадекватно отвечала на вопросы отца, говорила, что «она – не она». Отец нашел скомканную записку, написанную дочерью на клочке бумаги губной помадой с сообщением о том, что «Я – не Я». После того как девочка несколько затихла и прилегла, у нее в положении лежа на диване развился генерализованный тонико-клонический приступ длительностью до 1–2 минут с постприступным сном. Весь эпизод с момента звонка отцу пациентка амнезировала. Вызвана психоневрологическая бригада скорой медицинской помощи, девочка была госпитализирована в психо-неврологический стационар, где в связи с выраженностью НПР психиатром отменены все ранее принимаемые антипсихотики, снижена доза ЛЕВ с 2000 мг до 1000 мг/сут, но его уровень в крови не контролировался. Продолжался прием ВК 1000 мг/сут, несмотря на НПР. Дополнительно назначен третий ПЭП с ферментингибирующим эффектом на печень – ламотриджин (ЛТД) в таблетках, с достижением дозы на момент первичной консультации невролога-эпилептолога НЦ УК 50 мг/сут без контроля уровня в крови. При первичном осмотре неврологом-эпилептологом НЦ УК отмечено, что состояние пациентки по соматическому статусу удовлетворительное, сознание ясное, но повышен уровень личностной и ситуативной тревожности. Девочка в присутствии родителей напряжена, скованна, отвечала на поставленные вопросы верно, но односложно, постоянно оглядывалась на родителей.

В отсутствие родителей девочка несколько расслаблялась, более охотно шла на контакт с врачом, была доброжелательной, говорила, что любит обоих родителей, болезненно переживает их развод. Девочка легкоранима, чувствительна. При возвращении родителей в кабинет пациентка вновь замыкалась (скрещивала руки перед собой в замок, замолкала, смотрела исподлобья). Ориентация в месте, времени и собственной личности сохранена, бредовые высказывания отсутствовали. Общий фон настроения умеренно снижен, но суицидальных мыслей не выказывала. Интеллектуально сохранна, но умеренно снижены объем краткосрочной памяти и мнестический темп, уровень внимания неустойчивый. Кожные покровы с легким лимонным оттенком, рыхлый желтоватый налет на корне языка. Периферические лимфоузлы не пальпировались. Умеренный диффузный гипергидроз, преобладающий на кистях и стопах. Умеренный акроцианоз кистей и стоп. Тремор пальцев кистей вытянутых рук. Черепно-мозговые нервы: без видимой очаговой патологии, функциональные расстройства чувствительности на лице в виде болевой гиперестезии с той стороны, откуда начинается исследование, сторонность меняется. Двигательная сфера: мышечный тонус дистоничен. Рефлексы оживлены по функциональному типу, несколько ниже с ног, парезов нет. Пальценосовая и пяточноколенная пробы без дефекта. В позе Ромберга легкое покачивание, негрубая динамическая атаксия при стойке и ходьбе на пятках. Менингеальных знаков нет. Тазовых нарушений нет.
Девушке в порядке дообследования рекомендовано проведение ТЛМ для уточнения уровня ЛЕВ, ВК и ЛТД; анализ крови на индивидуальную чувствительность к препаратам ВК и антипсихотикам, антидепрессантам группы селективных ингибиторов обратного захвата серотонина; анализ крови на носительство мутации гена глюкуронилтрансферазы; видео-ЭЭГ-мониторинг 3 часа с тестированием уровня сознания во время нагрузочных проб; магнитно-резонансная томография головного мозга высокопольной по протоколу «Эпилепсия» с МР-спектроскопией гиппокампа; клинический анализ крови; расширенный анализ крови на гемостаз, фолиевую кислоту, гомоцистеин. В плане лечения рекомендовано снижение дозы ЛЕВ до 750 мг/сут (500 мг утром и 250 – вечером), снижение дозы ВК до 750 мг/сут под контролем результатов ТЛМ. Кроме того, не рекомендовано наращивание дозы ЛТД выше 50 мг/сут с последующим решением вопроса о целесообразности приема данного препарата после получения результатов ТЛМ и ДНК-типирования, поскольку (со слов девочки и ее родителей) лечащим врачом-психиатром по месту госпитализации планировалось увеличение дозы ЛТД со следующего дня до 100 мг/сут.

Вечером, в день первичного обращения пациентки в НЦ УК (пятница), несмотря на снижение дозы антиконвульсантов, у девочки появилась красная сыпь на коже лица, конечностей и туловища с зудом, с тенденцией к слиянию на конечностях, однако невролога-эпилептолога НЦ УК о высыпаниях родители не уведомили. Продолжен прием ВК 50 мг/сут. На этом фоне в течение последующих дней (суббота, воскресенье) отмечено значительное нарастание выраженности сыпи с распространением на кожу туловища, лица, с появлением отечности мягких тканей лица, отечности слизистой зева и носа, с затруднением носового дыхания, с лихорадкой до 38°С. После приема осельтамивира отмечен регресс температуры тела на несколько часов, но на вторые сутки (воскресенье) температура тела повысилась до 41°С, была резистентной к антипиретикам.
На третьи сутки (понедельник) пациентка осмотрена педиатром и неврологом детской поликлиники по месту жительства, сделано заключение об аллергии, но рекомендаций по отмене ЛТД не последовало. Извещение о НПР не оформлено. Рекомендован прием Супрастина внутрь, клинический эффект не достигнут. На 4-й день после появления сыпи (вторник) пациентка с отцом повторно обратились на прием к неврологу-эпилептологу НЦ УК в связи с сохраняющейся лихорадкой, кожным зудом, появлением на фоне максимально выраженных и сливных участков гиперемии белесоватых папул на лице. На момент повторного обращения пациентка получала политерапию ПЭП (ВК 1000 мг/сут, ЛТД 50 мг/сут, ЛЕВ 750 мг/сут). Со слов отца, перед поездкой в НЦ УК дополнительно был прием антипиретика (название препарата отец не уточнил) в связи с фебрильной лихорадкой до 38–39°С, но без клинического эффекта. При объективном осмотре сознание пациентки ясное, негрубая заторможенность, отмечено наличие генерализованной красной сливной сыпи на коже конечностей, туловища, лице, с зудом, гиперемия и отек слизистых носа и зева с затруднением носового дыхания без насморка, лихорадка – 38,0°С, зев гиперемирован, отечен, небные дужки, небные миндалины гиперемированы, отечны, без налета. Кожа лица ярко гиперемирована с мелкими белесоватыми папулами, пастозность лица, локальное повышение температуры кожи лица до 38,5–38,7°С. Кожа шеи, передней и задней поверхности туловища, верхних и нижних конечностей (кроме кистей и стоп) со сливными высыпаниями красного цвета с зудом (во время консультации пациентка чешет кожу в местах высыпаний), температура кожи в местах высыпаниях на конечностях до 38,5°С, в области кистей – до 36,5°С (рис. 1–4). Со стороны неврологического статуса без видимой отрицательной динамики по сравнению с первичной консультацией. В плане коррекции лечения рекомендована отмена приема ЛТД. Проведен курс инфузионной внутривенной терапии дексаметазоном в течение 5 суток, ингаляции Пульмикортом через небулайзер в связи с одышкой. На фоне проводимой терапии в течение первых суток свежих высыпаний нет, одышка купирована, температура тела снизилась до субфебрильной.
При осмотре девушки неврологом-эпилептологом НЦ УК в динамике через 1 неделю отмечен полный регресс высыпаний на коже, уменьшился зуд, нормализовалась температура тела, сохранились остаточные элементы кожной сыпи на лице, руках, ногах в виде мелко-отрубевидного шелушения, зуд кожи ладоней и стоп. По результатам фармакогенетического тестирования у пациентки выявлено гетерозиготное носительство полиморфизмов c.IVS A 734C(-163 C>A) гена CYP1A2, кодирующего изофермент 1А2 цитохрома-Р450 печени, генотип АС, а также гомозиготное носительство полиморфизма I359L(*3) A>C гена CYP2С9, кодирующего изофермент 2С9 цитохрома-Р450 печени, генотип СС, и гетерозиготное носительство динуклеотидной вставки (ТА)6/(ТА)7 гена UGT1A1, кодирующего фермент глюкозидилтрансферазу печени.
Таким образом, впервые выявлено, что пациентка является медленным метаболизатором за счет генетически-детерминированного замедления метаболизма антиконвульсантов по пути β-окисления и глюкуронизации, что объясняет развитие НПР при приеме средне- и субтерапевтической доз антиконвульсантов при политерапии от легких до серьезных, потребовавших госпитализации пациентки в круглосуточный стационар (психоз, синдром Стивенса–Джонсона).
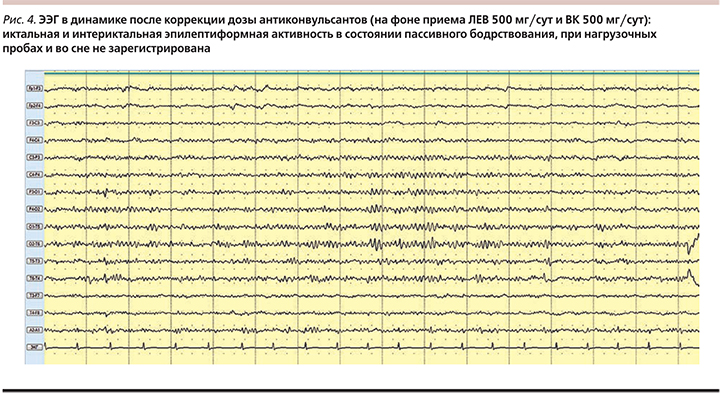
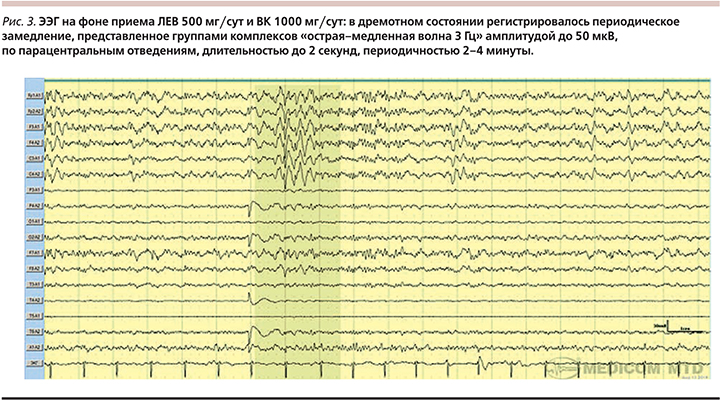
В связи с особенностями фармакогенетического профиля пациентке проведена коррекция противоэпилептической терапии. В настоящее время девочка находится на дуотерапии (ВК 500 мг/сут, ЛЕВ 500 мг/сут), продолжается постепенная отмена препарата ВК, НПР купированы, кроме нарушений менструального цикла. В первые 2 месяца от начала купирования вышеописанных НПР зарегистрировано 2 коротких, до 1 минуты, катамениальных ГТКП в перименструальном периоде. В течение последних месяцев приступов не отмечено. По данным ТЛМ, уровень ВК и ЛЕВ в средней полосе референсного коридора. По данным ЭЭГ-мониторинга, эпилептиформной активности не зарегистрировано. Значительно улучшилось качество жизни, пациентка социально реабилитирована, вновь посещает среднюю школу со сверстниками, готовится к сдаче экзаменов, вновь начала заниматься спортом, когнитивных, эмоционально-волевых и поведенческих расстройств нет. При осмотре в динамике в марте 2016 г. состояние пациентки значительно улучшилось: фон настроения хороший, внешне девочка выглядела ухоженной, улыбчивой, доброжелательной. Общий фон настроения оптимистичный. Кожные покровы и видимые слизистые чистые, улучшилось состояние волос и ногтей. Со стороны психоневрологического статуса без патологии. С целью коррекции нарушений менструального цикла и болезнь-модифицирующей терапии одиночных катамениальных приступов пациентке рекомендована консультация гинеколога-эндокринолога НЦ УК.
Обсуждение
Выбор ПЭП для лечения ЮМЭ зависит от многих факторов, включая сопутствующие заболевания пациента, НПР, выявленные ранее, пол и фармакогенетический профиль [8].
У большинства пациентов с ЮМЭ приступы хорошо контролируются при монотерапии ПЭП. Препаратом первой линии выбора для лечения ЮМЭ в течение многих лет считается ВК, высокая эффективность которой была продемонстрирована у пациентов с ЮМЭ в купировании всех типов припадков. Около 80% пациентов с ЮМЭ имеют ремиссию приступов на монотерапии ВК, причем подавляющему большинству нужен относительно низкий уровень противосудорожных препаратов для достижения адекватного контроля над приступами. В случае неэффективности препаратов ВК они показаны в комбинированной терапии с сукцинимидами (при резистентных абсансах), фенобарбиталом (при резистентных генерализованных судорожных приступах) и клоназепамом (при выраженных миоклониях и фотосенситивности).
Однако эпилептологи все чаще используют другие варианты в качестве терапии первой линии. Так, ЛЕВ показал неменьшую эффективность, чем вальпроаты, а также значительные преимущества по критериям безо-пасности [9–12]. Механизм действия препарата окончательно не известен. Предполагается связывание с протеином синаптических пузырьков 2А (synaptic vesicle 2А, SV2A), ингибирование высвобождения кальция из нейронов, уменьшение проводимости высоковольтажных кальциевых каналов N-типа в гиппокампе, уменьшение действия цинка и β-карболинов на рецепторы гамма-аминомасляной кислоты и глициновые рецепторы, как следствие – снижение активности негативных модуляторов этих рецепторов, а также подавление избыточной синхронизации нейронов [13].
В связи с тем что препарат имеет низкий процент связывания с белками и не метаболизируется в печени, для ЛЕВ характерен очень низкий потенциал лекарственных взаимодействий по сравнению с другими антиконвульсантами, что крайне важно при политерапии и служит очень ценным преимуществом препарата. В том числе ряд авторов подчеркивают отсутствие системной идиосинкразии, токсического действия на печень, гематотоксического действия, эндокринных нарушений [10, 12]. Однако побочные эффекты со стороны центральной нервной системы (нарушение сна, раздражительность, тошнота и рвота, головокружение, головная боль, тремор, гиперкинезы, эмоциональная лабильность, раздражительность, бессонница, тревога, потеря аппетита и двоение в глазах) и узкий терапевтический коридор концентрации ЛЕВ в крови объясняют необходимость динамического клинического и лабораторного контроля для своевременной коррекции разовой и суточной дозировки препарата, хотя обычно и не требуют полной отмены его приема.
Несмотря на благоприятный профиль переносимости, ЛТД не достаточно эффективен в монотерапии больных ЮМЭ [14]. Противо-эпилептическое действие ЛТД основано на блокировании потенциалзависимых натриевых каналов, стабилизации мембран нейронов и ингибировании высвобождения глутаминовой кислоты. В метаболизме ЛТД принимает участие фермент глюкуронилтрансфераза, поэтому у лиц с мутациями генов, отвечающих за синтез данного фермента, могут с большей вероятностью развиваваться НПР, что необходимо обязательно учитывать при назначении данного препарата. Кроме того, ВК в сочетании с ЛТД за счет конкурентного метаболизма печеночными ферментами вызывает замедление метаболизма ЛТД и увеличивает его период полувыведения.
Выводы
Своевременная диагностика ЮМЭ и рациональная фармакотерапия имеют решающее значение для успешного контроля над приступами и реабилитации пациентов с рассматриваемой патологией. Ответственность при назначении антиконвульсантов принадлежит врачу-неврологу-эпилептологу, который на основании собственного опыта принимает решение о выборе фармакотерапии, наиболее подходящей для каждого конкретного больного, что требует обширного запаса знаний в различных областях (неврологии, эпилептологии, нейрогенетики, нейрофизиологии и нейрорадиологии) и большого, постоянно обновляемого и совершенствуемого практического опыта. Лечащий врач детей и подростков, страдающих эпилепсией, должен быть информирован о наиболее перспективных и эффективных доказательных подходах к применению антиконвульсантов в клинической практике, разработанных в настоящее время, а также знать и помнить о возможных НПР на фоне проводимой терапии.
Обладать всеми этими качествами может только эксперт в клинической эпилептологии, работающий в условиях специализированного эпилептологического центра.


