Остеоартрит (ОА) – наиболее частое заболевание суставов, ассоциирующееся с высокой распространенностью, повышенной смертностью, утратой функции и увеличением затрат на лечение пациентов среднего и пожилого возраста [1, 2]. Развитие ОА определяется многими причинами, которые в конечном счете определяют фенотип ОА с вовлечением и повреждением всех тканей пораженной суставной области [3]. Основным клиническим симптомом, определяющим ухудшение качества жизни больных ОА [4], служит хроническая боль. Задача проведения максимально эффективной и безопасной обезболивающей терапии при ОА весьма актуальна еще и в связи с негативным влиянием боли на различные функциональные системы организма, что особенно нежелательно именно для этой категории больных в связи с высокой полиморбидностью [5, 6].
Причины болей при ОА многообразны. Наиболее часто при ОА имеет место воспалительный характер боли, обусловленный облигатным развитием синовита [7]. Поэтому нестероидные противовоспалительные средства (НПВС) используют для обезболивания при ОА очень часто. Неселективные в отношении циклооксигеназы (ЦОГ) НПВС должны использоваться при ОА с большой осторожностью ввиду их отрицательного влияния на слизистую оболочку верхних отделов желудочно-кишечного тракта, интерстиций почек на печень, особенно в пожилом возрасте [8]. Неселективные НПВС усугубляют тяжесть ОА при длительном применении, поэтому при ОА они должны применяться в низких дозах и короткими курсами. Показано, что в наибольшей степени отрицательно на хрящ при ОА влияют производные индол/инденуксусной кислоты (индометацин, метиндол), хотя и производные пропионовой кислоты (ибупрофен, напроксен и др.) также на ~30% ускоряют рентгенологическое прогрессирование ОА [6]. Все неселективные НПВС снижают синтез гликозаминогликанов, необходимых для регенерации хряща. Известно, что селективные ингибиторы ЦОГ-2 (нимесулид, мелоксикам, целекоксиб, этерикоксиб) лучше переносятся пожилыми пациентами с ОА вследствие реального уменьшения частоты побочных эффектов со стороны желудочно-кишечного тракта, почек, печени [8], но у больных, имеющих риск сердечно-сосудистых заболеваний, их прием не может считаться абсолютно безопасным [9, 10]. Использование мелоксикама, в отличие от других НПВС, не только не оказывает негативное влияние, но и даже препятствует разрушению хрящевой ткани [11].
Таким образом, купирование (или уменьшение интенсивности) боли при ОА становится центральной задачей в терапии этого заболевания, т.к. не только приводит к улучшению качества жизни больного, уменьшению прогрессирования, но и влияет на продолжительность их жизни. Европейское общество по клиническим и экономическим аспектам остеопороза и ОА (ESCEO – European Society for Clinicaland Economic Aspects of Osteoporosis and Osteoarthritis), проведя анализ предложений различных экспертных групп для создания консенсуса по ведению больных ОА [12], предложило в 2014 г. и уточнило в 2016 г. [13] алгоритм ведения больных ОА, в котором четко прослеживается осторожный подход к применению НПВС, подтверждается эффективность медленнодействующих симптом-модифицирующих препаратов – SYSADOA (хондроитин сульфата, глюкозамина и внутрисуставного введения гиалуронатов). Эксперты ESCEO в данном алгоритме обозначили, что назначение медленнодействующих препаратов SYSDOA («хондропротекторов») должно осуществляться уже на первых этапах лечения ОА, а назначение НПВС оставлено для больных с недостаточным симптом-модифицирующим действием SYSADOA.
По современным представлениям, фармакологическое действие SYSADOA связано с подавлением активации цитокинового каскада, сопровождающего развитие хронического воспаления и деструкцию хрящевой ткани, что подчеркивает их патогенетически обусловленное действие при ОА [14]. К настоящему времени среди симптоматических медленнодействующих препаратов в лечении ОА наибольшая доказательная база имеется для хондроитин сульфата (ХС) [15]. Наличие у ХС анальгетического и противовоспалительного свойств было установлено в серии рандомизированных контролируемых исследований (РКИ) [16–20] и подтверждено результатами ряда мета-анализов [21–23]. Согласно результатам многочисленных исследований, хондроитин оказывает умеренное или значительное воздействие на болевой синдром и функциональную подвижность суставов при ОА по сравнению с плацебо, является безопасным и характеризуется минимумом побочных эффектов. EULAR (The European League Against Rheumatism) рассматривает ХС в качестве одного из самых безопасных лекарственных средств для лечения ОА. Показано, что препарат имеет значение токсичности, равное 6 по 100-балльной шкале [24]. А M. Hochberg и соавт. подчеркнули, что ХС имеет лучший профиль безопасности по сравнению с другими лекарственными средствами для лечения ОА [25].
Качественные многолетние РКИ продемонстрировали помимо симптоматического действия ХС и глюкозамина сульфата их возможность замедлять прогрессирование сужения суставной щели при ОА [17, 26]. Большинство известных к настоящему времени препаратов ХС выпускается в виде форм для перорального применения, эффект которых начинает проявляться через 12–14 недель от начала лечения, что позволяет уменьшать потребность в использовании НПВС и увеличивать безопасность лечения ОА. В последнее время появились новые формы ХС в виде инъекций для внутримышечного введения. Исследование фармакокинетических особенностей инъекционных форм ХС показало, что при внутримышечном введении значительные концентрации препарата в системном кровотоке выявляются уже через 30 минут, а максимальная концентрация достигается через 1 час. В синовиальной жидкости препарат выявляется уже через 15 минут после внутримышечной инъекции, а максимальная концентрация ХС в хрящевой ткани достигается через 48 часов [27]. Внутримышечный способ введения ХС увеличивает биодоступность и долю нативных молекул в системном кровотоке, благодаря чему может повышаться эффективность проводимой терапии, быстрее развиваться симптоматический эффект.
В клиническом открытом исследовании (включены 35 больных гонартрозом II–III стадий с выраженной болью в суставе, оцененной как 58,0±10,7 мм по ВАШ, средний возраст составил 63,45±6,9 года) все больным назначали внутримышечный препарат ХС, вводимый через день по 0,1 г (первые 3 инъекции), далее с 4-й по 30-ю инъекцию – по 0,2 г. Пациенты продолжали принимать НПВС, при необходимости – анальгезии [28]. По мнению пациентов, срок наступления эффекта составил в среднем 18 дней (от 14 до 25), срок уменьшения потребности в НПВС – 20,5 дня (от 16 до 28). Всего к концу курса лечения внутримышечными инъекциями ХС 97% больных отметили снижение потребности в приеме НПВС и 62% отменили прием НПВС. Эти данные подтверждают, что применение инъекционной формы ХС может обеспечить довольно быстрое наступление клинического эффекта.
В соответствии с алгоритмом ведения больных ОА ESCEO [12–13] следующим шагом в лечении стоит внутрисуставное (в/с) введение препаратов гиалуроновой кислоты. Хотя патофизиология ОА до конца не ясна, известно, что изменение свойств синовиальной жидкости (СЖ) играет большую роль (как механическую, так и патогенетическую) в развитии и прогрессировании ОА. Изменения СЖ при ОА (снижение эластичности и вязкости) приводят к снижению ее лубрикативной и протективной функций.
Гиалуронан (ГН) входит в состав СЖ и в экстрацеллюлярный матрикс в других областях. Он играет важную роль в пластичности и эластичности суставного хряща [29] и в поддержании визкозоэластичности и лубрикационных свойств СЖ [30], выполняет роль фильтра для продуктов деградации хряща, защищает болевые рецепторы на синовиальной мембране (рис. 1).
И концентрация ГН, и протяженность его цепей (молекулярный вес – Мв) уменьшаются у больных гонартрозом [29]. Это легло в основу гипотезы, будто уменьшение вискозности СЖ может быть причиной боли при ОА и послужило предпосылкой к разработке инъекций ГН в качестве замещения СЖ. Данный вид терапии, получивший название «вискосуплементация», разрабатывался как лечение боли при ОА [31].
Для получения препаратов гиалуроновой кислоты используют разные методы:
- экстракции (чаще из петушиных гребешков);
- бактериальной ферментации (гиалуроновая кислота неживотного происхождения);
- NASHA™ (Non-Animal Stabilized Hyaluronic Acid).
Помимо установленного симптоматического действия экзогенно вводимых ГН стали появляться данные, согласно которым эти молекулы не только исполняют роль лубриканта, но и защищают сустав от биомеханических воздействий. В настоящее время существует масса сообщений о комплексном воздействии ГН на биохимические изменения в суставе [32].
Препараты ГН продемонстрировали в экспериментальных исследованиях влияние на многие процессы в СЖ, суставном хряще и субхондральной кости: влияние на матриксные протеогликаны, коллагены и гиаледерины в синовиоцитах, хондроцитах и других клетках [33–35]. Комплексный эффект, который может рассматриваться как болезнь-модифицирующий, включает репаративные процессы в суставе посредством влияния на рост и метаболизм хондроцитов; регуляцию синтеза эндогенного ГН, протеогликанов и коллагенов; ингибицию экспрессии и функции энзимов, участвующих в деградации хряща; регуляцию апоптоза и ингибицию воспалительного ответа [32].
Было показано, что введение ГН (Мв 800 kDa) ингибирует вызванную интерлейкином-1β стимуляцию продукции матриксных металлопротеиназ-1 (ММР-1), ММР-2 и ММР-13, возможно через взаимодействие ГН с CD44 на хондроцитах [36]. Экспрессия этих молекул в СЖ и хряще коррелирует с воспалительной деструкцией хряща у больных ОА [37]. На модели ОА у кролика было показано, что ГН подавляет апоптоз хондроцитов и деградацию хряща, по данным морфометрического анализа [38].
Противовоспалительное действие экзогенно вводимого ГН включает ингибицию миграции лейкоцитов, фагоцитоза лейкоцитами, пролиферации лимфоцитов, продукции простагландинов, предупреждение оксидативного повреждения свободными радикалами и ингибицию противовоспалительных цитокинов [35]. Эти данные подтверждаются и при лечении больных ОА. M. Dougados и соавт. [39] отметили достоверное уменьшение синовиальной эффузии у больных ОА, получивших 4 инъекции ГН.
В литературе широко дискутируется вопрос: влияет ли Мв ГН на его клинические и биологические эффекты? Одно из первых исследований по влиянию Мв ГН на его биологическую активность [40] показало, что синтез ГН синовиальными клетками увеличивался при добавлении экзогенного ГН и что максимальный эффект был получен при введении ГН с Мв между 500 и около 4000 kDa. Введение ГН с Мв менее 500 kDa не давало эффекта, а введение ГН с Мв 4700 и более kDa давало меньшую концентрацию ГН.
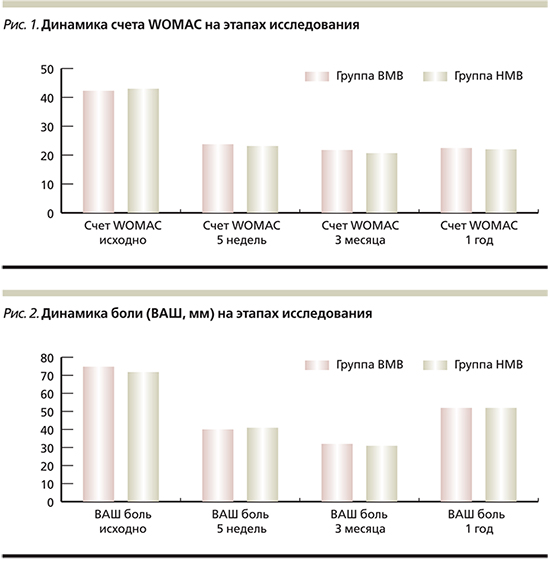
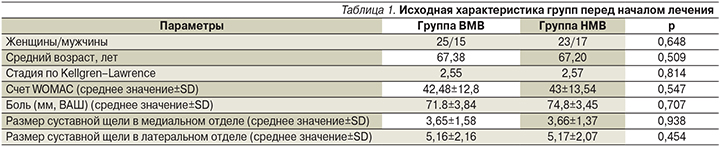
В рандомизированном двойном слепом исследовании сравнивали эффективность применения ГН с высоким молекулярным весом (ВМВ) и низким молекулярным весом (НМВ) в отношении функциональных и клинических параметров [41] при гонартрозе у 80 больных. По исходным данным, обе группы были сопоставимыми (в каждой по 40 пациентов, табл. 1): 40 больным проведено 5 в/с введений 5 мг ГН НМВ с интервалом в 1 неделю и 40 больным – 3 в/с введения ГН ВМВ.
Оценка клинико-функциональных параметров проведена через 5 недель, 3 месяца и через 1 год. В течение всего исследования больным не назначали анальгетических препаратов и физиотерапию. Различий в динамике счета WOMAC (The Western Ontario and McMaster Universities Osteoarthritis Index) и выраженности боли не отмечено ни через 5 недель (р=0,333; р=0,918 соответственно), ни через 3 месяца (р=0,524 и р=0,617), ни через год (р=0,689 и р=0,861) (рис. 1, 2). При сравнении трех нативных ГН (Мв 500–730 kDa, 800 kDa и 3600 kDa; Гилан G-F 20, Мв 6000kDa) по влиянию на хрящ с макроскопической и гистопатологической оценкой на экспериментальной модели ОА у кролика было показано, что все формы ГН имеют достоверный хондропротективный эффект, но наибольший эффект был зарегистрирован при введении ГН с Мв 3600 kDa [42]. В сравнительных клинических исследованиях были получены различные результаты: отмечена и большая эффективность применения ГН с ВМВ [43, 44], и отсутствие различий в эффективности применения ГН с ВМВ и НМВМ [45–47].
С целью сравнительной оценки эффективности лечения больных ОА препаратами ХС и внутрисуставного введения ГК, а также их влияния на потребность в НПВП-терапии и качество жизни пациентов проводилось РКИ у пациентов с ОА коленного сустава (КС) (ссылка) со средней давностью болезни 7 лет [58]. В исследовании преобладали больныхе с II (59%) рентгенологической стадией ОК КС.
С целью оценки течения ОА КС до наччала исследования и через 12 месяцев лечения проводили инструментальное обследование: рентгенографию, магнитно-резонансную томографию в аксиальной, сагиттальной и коронарной проекциях. Пациентов рандомизировали на 3 группы: 1-я группа получала ГК (Ферматрон) внутрисуставно 1,0 мл 3–5 инъекций 1 раз в неделю; пациенты 2-й группы – ХС 500 мг по 1 капсуле 2 раза в день в течение 6 месяцев. Все больные могли принимать НПВП по мере необходимости. 3-я группа принимала только НПВП. По данным визуально-аналоговой шкалы анальгетический эффект в группах ГК и ХС сохранялся на протяжении всего периода наблюдения, без статистически значимых различий между группами на заключительном этапе (р=0,89 по шкале боли при ходьбе). В этих группах выявлено достоверное уменьшение боли в покое (р<0,003) и ночной боли (р<0,0005), что косвенно подтверждает наличие противовоспалительного действия у данных препаратов. По данным опросника SF-36, к концу исследования повышалось качество жизни больных в 1-й и 2-й группах. Общее состояние здоровья достоверно улучшалось у пациентов, принимающих ГК и ХС по сравнению с больными, принимающими только НПВП (р=0,002). В большей степени улучшалось ролевое функционирование, обусловленное эмоциональным состоянием. Также было отмечено снижение потребности в НПВП (на 22% в 1-й группе и на 15% во 2-й группе). При анализе рентгенограмм в динамике выявлено сужение суставной щели КС в медиальном отделе большеберцовой кости у пациентов 3-й группы. У пациентов групп ГК и ХС ширина суставной щели без динамики, что свидетельствует об отсутствии рентгенологического прогрессирования ОА КС. При оценке состояния суставного хряща по данным магнитно-резонансной томографии у пациентов 1-й и 2-й групп достоверных различий в толщине суставного хряща до начала и по завершении исследования не было получено, что свидетельствует о замедлении прогрессирования заболевания на фоне проводимой терапии. В группе контроля было отмечено достоверное уменьшение толщины суставного хряща к концу исследования. В начале исследования явления синовита были выявлены у 30% пациентов. К концу наблюдения было отмечено уменьшение выраженности синовита в группах ГК и ХС. В 3 группе количество случаев синовита не уменьшилось. Результаты, полученные в данном исследовании позволили сделать вывод о достоверном замедлении скорости прогрессирования ОК КС при терапии ГК и ХС, что позволяет отнести их к структурно-модифицирующим препаратам. Кроме того, исследователи отметили хорошую переносимость препаратов, которая не требовала отмены терапии и позволяла проводить длительные курсы лечения.
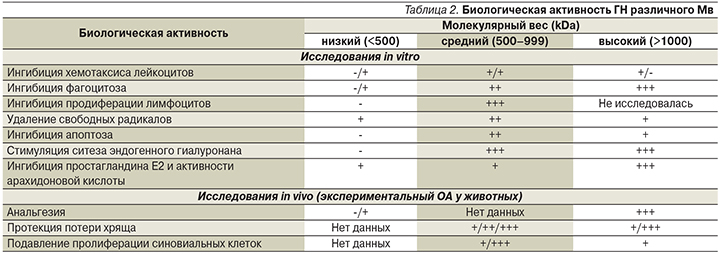
Биологическая активность ГН различного Мв представлена в табл. 2 [48].
Безопасность в/с введения ГН освещена в 7 мета-анализах [49–55]. Побочные эффекты встречались при использовании ГН незначительно чаще, чем на плацебо (относительный риск [ОР]=1,09; 95% ДИ – 1,01–1,15). Как правило, это были транзиторные локальные реакции (боль и припухлость в месте инъекции) с ОР=1,19 (95% ДИ – 1,01–1,41) [49] – 1,34 (95% ДИ – 1,13–1,60) [53]. Использование в/с введения ГН также ассоциируется с риском обострения синовита (ОР=1,51; 95% ДИ – 0,38–3,54), поэтому синовит должен быть купирован до введения ГН.
С успехом применяется в/с введение ГН и для коксартроза [56].
На большой когорте больных (744 734 пациента) ОА показано, что повторные курсы введения ГН увеличивают время до необходимости хирургического лечения ОА (эндопротезирования), чем больше курсов введения ГН, тем на больший срок отодвигается необходимость хирургического лечения [57].
Заключение
На основании экспериментальных и клинических данных вискозосуплементация является эффективным методом лечения ОА различной локализации. Внутрисуставное введение ГН обладает противовоспалительным и анальгетическим действиями. Экспериментальные исследования свидетельствуют, что нивелировка катаболических процессов в суставном хряще (ингибиция провоспалительных медиаторов и металлопротеаз) подтверждает возможность ГН позитивно влиять на течение ОА, замедляя его прогрессирование. Для подтверждения необходимы длительные проспективные контролируемые исследования. Лечение ГН достаточно безопасно, побочные эффекты в виде локальных реакций, как правило, редки и слабо выражены. Факт, что лечение ГН может отсрочить необходимость эндопротезирования суставов, свидетельствует об экономической и психологической выгоде данного метода лечения.
По результатам анализа ряда РКИ можно сделать вывод о высокой эффективности комплексной терапии препаратами ХС и ГК у пациентов с ОА. Немаловажно также отметить высокий профиль безопасности у препаратов данных групп. Это имеет особое значение, принимая во внимание высокую частоту хронизации ОА, и, как следствие, высокую необходимость в длительных повторных курсах терапии. Среди препаратов ХС можно отметить еще один относительно новый препарат ХС – Инъектран, предназначенный для внутримышечного введения, курсом по 25–35 инъекций при ОА периферических суставов. Фармакоэкономические характеристики препарата позволяют рассматривать его как достойную альтернативу препаратам одного с собой класса.


