Эпидемиология внебольничной пневмонии в РФ
 Как отметила Юлия Викторовна Демина, профессор кафедры организации санитарно-эпидемиологической службы Российской медицинской академии непрерывного профессионального образования (РМАНПО), начиная с 1985 г. отмечается стабильно высокий уровень заболеваемости ВП. За 2012–2016 гг. было зарегистрировано 84 эпидемических очага ВП (от 5 случаев в каждом), в т.ч. 39 по оперативным данным. Непосредственно в 2016 г. было зарегистрировано 15 очагов ВП, причем практически во всех очагах из материала от больных ВП выделялись вирусы. При анализе эпидемического сезона 2016–2017 гг. пик ВП совпал с таковым заболеваемости гриппом на 2 недели 2017 г. Это может говорить о большом удельном весе пневмоний, которые развиваются не как осложнения гриппа, а как первичное заболевание.
Как отметила Юлия Викторовна Демина, профессор кафедры организации санитарно-эпидемиологической службы Российской медицинской академии непрерывного профессионального образования (РМАНПО), начиная с 1985 г. отмечается стабильно высокий уровень заболеваемости ВП. За 2012–2016 гг. было зарегистрировано 84 эпидемических очага ВП (от 5 случаев в каждом), в т.ч. 39 по оперативным данным. Непосредственно в 2016 г. было зарегистрировано 15 очагов ВП, причем практически во всех очагах из материала от больных ВП выделялись вирусы. При анализе эпидемического сезона 2016–2017 гг. пик ВП совпал с таковым заболеваемости гриппом на 2 недели 2017 г. Это может говорить о большом удельном весе пневмоний, которые развиваются не как осложнения гриппа, а как первичное заболевание.
В целом сезон гриппа 2016–2017 гг. характеризует низкая интенсивность эпидемиологического процесса с абсолютным доминированием вируса гриппа А (H3N2). На пике сезона в 1,5 раза ниже по сравнению с прошлым годом. Особенность эпидемиологического сезона заключалась в раннем начале подъема заболеваемости, широком географическом распространении гриппа и острых респираторных вирусных инфекций с одновременным вовлечением в эпидемический процесс всех возрастных групп населения. Кроме того, отмечалась большая продолжительность подъема заболеваемости как в целом по стране (12–13 недель), так и в большинстве субъектов РФ (4–6 недель).
 В заключение Ю.В. Демина напомнила, что в настоящее время основной мерой профилактики ВП является вакцинация против гриппа, пневмококковой и гемофильной инфекций, включенной в Национальный календарь профилактических прививок по эпидемиологическим показаниям.
В заключение Ю.В. Демина напомнила, что в настоящее время основной мерой профилактики ВП является вакцинация против гриппа, пневмококковой и гемофильной инфекций, включенной в Национальный календарь профилактических прививок по эпидемиологическим показаниям.
Современное состояние антибиотикорезистентности этиологических агентов пневмонии
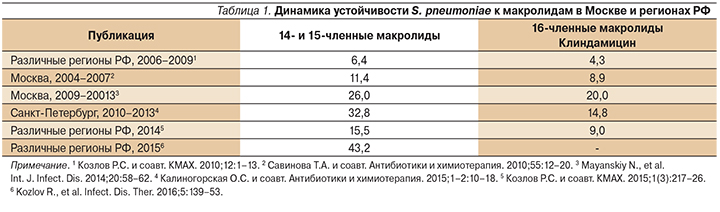
Главный внештатный специалист-микробиолог Комитета по здравоохранению Правительства Санкт-Петербурга, руководитель отдела молекулярной микробиологии и эпидемиологии ФГБУ «Научно-исследовательский институт детских инфекций» Федерального медико-биологического агентств, д.м.н., проф. Сергей Владимирович Сидоренко начал свой доклад с вопроса: что меняется – этиология пневмоний или наше представление об этом? По данным Центров по контролю и профилактике заболеваний США, среди 2259 пациентов с ВП, требовавшей госпитализации, в 62% случаев не было обнаружено ни одного патогена, в 22% был выявлен только вирусный патоген и у 5,5% пациентов был обнаружен Streptococcus pneumoniae (рис. 1). Такие данные говорят в пользу того, что вирусы приобретают все большее значение в палитре этиологических факторов ВП.
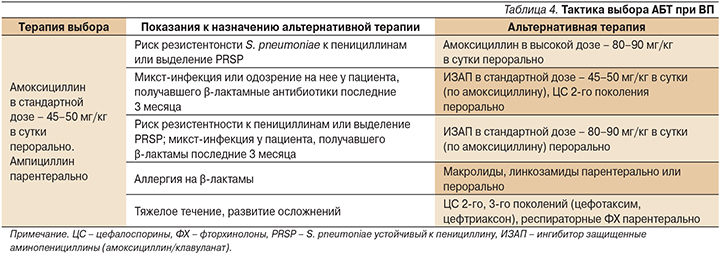
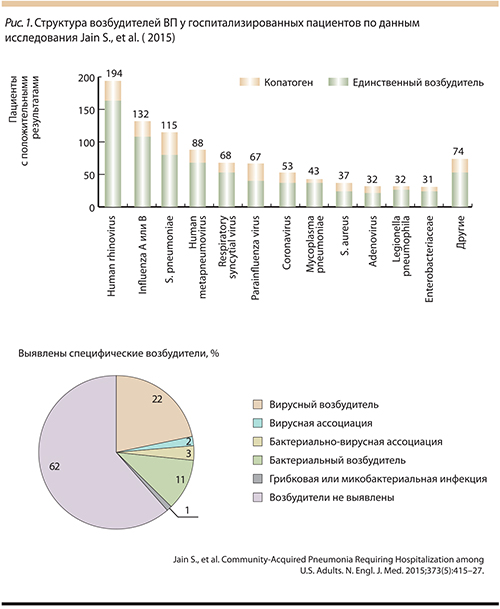
Круг антибиотиков, которые применяются для лечения респираторных инфекций, ограничивается тремя группами: бета-лактамы, макролиды и респираторные фторхинолоны. Оптимистично, по оценкам профессора С.В. Сидоренко, на сегодняшний момент складывается ситуация в отношении устойчивости бактериальной флоры к амоксициллину, не превысивавшей 16% в случае S. pneumoniae и 10–12% в случае H. influenzae. Менее благоприятные тенденции прослеживаются при анализе резистентности S. pneumoniae к макролидам. За последнее десятилетие резистентность возбудителя к 14- и 15-членным макролидам выросла с 6 до 43%. У 16-членных макролидов уровень резистентности в целом в 2 раза ниже (табл. 1).
Как отметил проф. С.В. Сидоренко: «Когда речь идет о 30–40%-ной устойчивости, необходимо пересмотреть место макролидных антибиотиков в эмпирической терапии внебольничных инфекций. На сегодняшний день макролиды нельзя рассматривать как надежные антипневмококковые и антигемофильные препараты». Подводя итог своего выступления, проф. С.В. Сидоренко отметил, что при выборе эмпирической терапии в случае нетяжелых внебольничных пневмоний и в отсутствие факторов риска устойчивости вероятных возбудителей и коморбидности следует отдавать предпочтение амоксициллину.
У пожилых пациентов старше 65 лет с коморбидными заболеваниями и предшествовавшими курсами антибактериальной терапии (АБТ) возрастает роль грамотрицательной микрофлоры. В этой ситуации уже следует рассматривать в качестве стартовой терапии ВП амоксициллин/клавуланат. Как подчеркнул профессор, если указанные факторы отсутствуют, препаратом выбора должен оставаться амоксициллин.
 Стратегия и тактика терапии затяжных пневмоний
Стратегия и тактика терапии затяжных пневмоний
Академик РАН Александр Григорьевич Чучалин отметил, что важной проблемой пульмонологии являются затяжные пневмонии, которые носят прогрессирующий характер, медленно разрешаются, несмотря на проводимую терапию. Факторами риска затяжного течения пневмонии, вызванной S. pneumoniae, служат мультилобарный воспалительный процесс, бактериемия, длительный лихорадочный период, лейкоцитоз свыше 6 дней, лекарственная устойчивость, а также сопутствующие заболевания и состояния – хроническая обструктивная болезнь легких, алкоголизм и вирус иммунодефицита человека. Александр Григорьевич отметил, что каждая пневмония – это прежде всего дисрегуляция иммунного ответа. Особое место в терапии затяжных пневмоний занимает резистентность антибиотиков. К факторам риска резистентности пневмококка можно отнести предшествовавшие случаи пневмонии и связанная с ними антибиотикотерапия, нозокомиальные инфекции и стационарное лечение последние 3 месяца.
При проведении дифференциального диагноза затяжной пневмонии необходимо исключить лекарственные повреждения легких, эмболию в систему легочной артерии и застойную сердечную недостаточность. Важно также оценить факторы риска затяжного течения пневмонии: возраст больного, сопутствующие заболевания, тяжесть течения пневмонического процесса; охарактеризовать вирулентность возбудителя. Ценным показателем в диагностическом алгоритме служит уверенность в разрешении воспалительного процесса. Говоря о случаях неэффективности проводимой терапии, акад. А.Г. Чучалин отметил: «Не идите по накатанному пути. Следует понять, что стоит за пневмонией».
Международные и национальные рекомендации по терапии ВП
Главный пульмонолог Министерства обороны РФ, главный пульмонолог ФГКУ «Главный военный клинический госпиталь им. академика Н.Н. Бурденко», проф. Андрей Алексеевич Зайцев представил обзор актуальных международных и национальных рекомендаций по терапии ВП. Важным вопросом эффективного ведения пациентов с ВП является выбор места лечения больного: амбулаторно, в стационаре или в отделении реанимации и интенсивной терапии. В рекомендациях изложены методики, которые помогают объективно оценить состояние больного. Клинические руководства предлагают использовать на выбор три шкалы. CRB-65 проста в исполнении и требует оценки всего 3 клинических параметров: нарушение сознания, частоты дыхания (ЧД ≥30/мин), артериального давления (диастолическое [ДАД] <60 90="" :="" -="" -iv="" 25="" 30="" 2="" 5="" :="" 40="" 5="" p="">
В сложившейся ситуации определенные изменения наметились в международных рекомендациях. Так, например, в британских рекомендациях 2014 г. (NICE) приоритет отдан антибактериальным препаратам с высокой клинической эффективностью и чувствительностью in vitro в отношении жизнеугрожающего возбудителя, а именно амоксициллину, который является предпочтительным выбором перед макролидами при ведении пациентов с нетяжелыми ВП. «Мы нуждаемся в пересмотре национальных рекомендаций, приоритет должен быть отдан аминопенициллинам в качестве стартовых препаратов лечения ВП. Необходимо пересмотреть применение макролидов, используя их только при непереносимости бета-лактамов и при указании на атипичную этиологию ВП», – отметил проф. А.А. Зайцев.
 В недавно утвержденных Евра-зийских клинических рекомендациях (декабрь 2016 г.) [6], определяющих стратегию и тактику рационального применения АМТ в амбулаторной практике, первой линией терапии назван амоксициллин. Это касается случаев ВП с нетяжелым течением у пациентов без факторов риска полирезистентности S. pneumoniae или при их наличии. Пути улучшения биодоступности и переносимости аминопенициллинов – это использование лекарственных форм антибиотиков, обеспечивающих максимально полное и быстрое всасывание в желудочно-кишечном тракте.
В недавно утвержденных Евра-зийских клинических рекомендациях (декабрь 2016 г.) [6], определяющих стратегию и тактику рационального применения АМТ в амбулаторной практике, первой линией терапии назван амоксициллин. Это касается случаев ВП с нетяжелым течением у пациентов без факторов риска полирезистентности S. pneumoniae или при их наличии. Пути улучшения биодоступности и переносимости аминопенициллинов – это использование лекарственных форм антибиотиков, обеспечивающих максимально полное и быстрое всасывание в желудочно-кишечном тракте.
К ним относятся, например, диспергируемые таблетки, биодоступность амоксициллина в которых может составлять до 93–95% (табл. 3).
Национальная программа по лечению ВП у детей
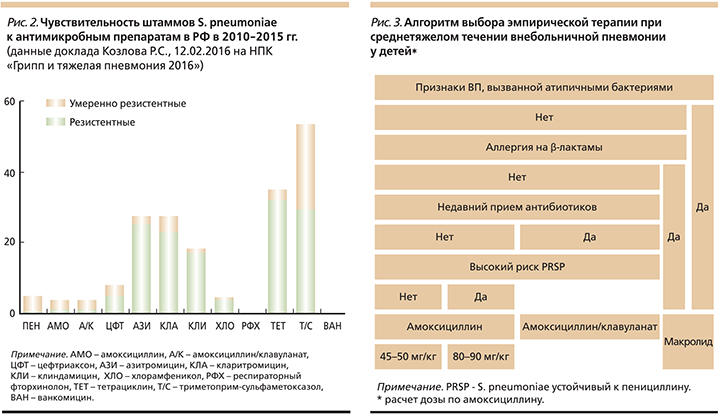
Об итогах внедрения национальной программы лечения ВП у детей, созданной в 2015 г. при участии 79 экспертов, рассказала проф. Наталья Анатольевна Геппе. Она отметила типичные ошибки АБТ у детей: назначение перорального ампициллина, препарата с низкой биодоступностью; применение неактивного в отношении пневмококка гентамицина, а также необоснованный отказ от назначения амоксициллина в пользу ингибитор-защищенных пенициллинов и цефалоспориновых антибиотиков при пневмококковой пневмонии; парентеральное взамен перорального назначение антибактериальных препаратов при среднетяжелом течении ВП и частую смену антибиотиков. При выборе АБТ необходимо учитывать микрофлору, вызывающую ВП у детей, которая изменяется с возрастом. В документе Европейского респираторного общества признается вклад в первую очередь S. pneumoniae и только затем остальных бактериальных агентов, включая атипичную микрофлору [7].

АБТ оказывает решающее влияние на прогноз пневмонии при достоверном или вероятном диагнозе. В случае тяжелого течения ее следует начать незамедлительно. Детям со среднетяжелым течением ВП целесообразно пероральное назначение антибактериальных препаратов. В случае тяжелого течения ВП необходим переход на парентеральное введение антибактериальных препаратов или на ступенчатую терапию (табл. 4). Для детей старше 3 месяцев основным антибиотиком лечения ВП является амоксициллин, который имеет высокую стабильную активность в отношении пневмококка – наиболее частого и опасного возбудителя. Продолжительность АБТ при ВП, вызванной типичными бактериями, составляет 7–10 дней, атипичными бактериями – 10–14 дней. «Амоксициллин на сегодняшний день является препаратом выбора при терапии ВП у детей, что подтверждают документы ВОЗ и ЮНИСЕФ. Не просто амоксициллин, а в лекарственной форме диспергируемые таблетки», – отметила профессор Н.А. Геппе, продолжив: «Преимущества диспергируемых лекарственных форм очевидны: возможность использования у детей раннего возраста, легкость образования жидких форм и растворение в небольшом объеме жидкости дают возможность более точно дозировать препарат». В национальной программе при нетяжелых вариантах течения ВП используется амоксициллин в стандартной дозе. В случае наличия признаков резистентности пневмококка доза амоксициллина может быть повышена до 80–90 мг/кг в сутки.
 Переходя к вопросу применения макролидов при ВП, проф. Н.А. Геппе определила место этих антибиотиков как препаратов, применяемых при непереносимости бета-лактамов, а также для терапии ВП, вызванной атипичными возбудителями. При этом предпочтение отдается 16-членным макролидам (джозамицину). В отличие от 14-, 15-членных макролидов к джозамицину не развивается устойчивость по механизму эффлюкса у основного возбудителя S. pneumoniae, а также у пиогенного стрептококка, что особенно актуально в современных условиях растущей резистентности.
Переходя к вопросу применения макролидов при ВП, проф. Н.А. Геппе определила место этих антибиотиков как препаратов, применяемых при непереносимости бета-лактамов, а также для терапии ВП, вызванной атипичными возбудителями. При этом предпочтение отдается 16-членным макролидам (джозамицину). В отличие от 14-, 15-членных макролидов к джозамицину не развивается устойчивость по механизму эффлюкса у основного возбудителя S. pneumoniae, а также у пиогенного стрептококка, что особенно актуально в современных условиях растущей резистентности.
Говоря о преимуществах макролидных антибиотиков, нельзя не коснуться их неантибиотических эффектов, например противовирусной активности. Согласно заключению международных профессиональных сообществ, таких как British Thoracic Society и IDSA, все дети с установленным клиническим диагнозом пневмонии должны получать антибиотик, а в некоторых случаях пневмония может потребовать одновременно антибактериальной и противовирусной терапии. В связи с этим обращает на себя внимание новая научная работа японских коллег по изучению противовирусной активности джозамицина. Речь идет об экспериментальной работе, которая показала выраженный противовирусный эффект 16-членного макролида джозамицина при инфицировании экспериментальных животных летальной дозой вируса гриппа A/H1N1 [4]. Согласно выводам авторов, джозамицин ингибирует репликацию вируса гриппа А, в т.ч. самые опасные с точки зрения летальности его штаммы, препятствует развитию заболевания, значительно повышает уровень выживаемости при гриппе (уровень выживаемости мышей в группе составил 80,9% при введении летальной дозы), а также защищает легкие от цитотоксического действия. Сочетание антибактериальных свойств с потенциально противовирусным действием выделяет джозамицин в группе макролидов, особенно принимая во внимание сложную дифференциальную диагностику вирусной и бактериальной пневмонии.