ЭПИДЕМИОЛОГИЯ
Цереброваскулярные заболевания во всем мире занимают второе место среди причин смерти и являются главной причиной инвалидизации взрослого населения. По данным ВОЗ, в 2002 г. в мире от инсульта умерли около 5,5 млн человек.
Заболеваемость инсультом значительно варьируется в различных регионах – от 1 до 5 случаев на 1000 населения в год. Невысокую заболеваемость отмечают в странах Северной и Центральной Европы (0,38–0,47 на 1000 населения), высокую – в Восточной Европе. В Российской Федерации заболеваемость инсультом среди людей старше 25 лет составляет 3,48, а смертность – 1,17 на 1000 населения в год. В США частота инсульта среди жителей европеоидной расы составляет 1,38–1,67 на 1000 населения.
По данным международных многоцентровых исследований, соотношение ишемического и геморрагического инсультов составляет в среднем 4:1–5:1 (80–85% и 15–20%).
Доля ОНМК в структуре общей смертности в России составляет 21,4%. Смертность от инсульта среди пациентов трудоспособного возраста увеличилась за последние 10 лет более чем на 30% (41 на 100 тыс. населения). Ранняя 30-дневная летальность после инсульта сос-тавляет 34,6%, а в течение года умирают приб-лизительно 50% больных, т.е. каждый второй заболевший.
Инсульт – преобладающая причина инвалидизации населения (3,2 на 1000 населения). По данным Национального регистра инсульта, 31% пациентов, перенесших инсульт, нуждаются в посторонней помощи для ухода за собой, 20% не могут самостоятельно ходить. Лишь 8% выживших больных могут вернуться к прежней работе.
Национальный регистр инсульта (2001–2005) показал, что смертность от инсульта в России достоверно коррелирует с заболеваемостью, однако если уровень заболеваемости инсультом между регионами страны различается максимум в 5,3 раза, то различия в смертности составляют 20,5 раз. Это свидетельствует о разном качестве медицинской помощи в регионах, что подтверждается различиями показателей госпитальной летальности между регионами более чем в 6 раз.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Этиология
В связи с тем, что ИИ не является отдельным заболеванием, для него невозможно определить единый этиологический фактор. Выделяют факторы риска, ассоциированные с повышенной частотой развития ИИ. Их разделяют на немодифицируемые (возраст, пол, наследственная предрасположенность) и модифицируемые (артериальная гипертензия любого происхождения, заболевания сердца, мерцательная аритмия, инфаркт миокарда в анамнезе, дислипопротеинемия, сахарный диабет, бессимптомное поражение сонных артерий).
Выделяют также факторы риска, связанные с образом жизни: табакокурение, избыточная масса тела, низкий уровень физической активности, неправильное питание (в частности, недостаточное потребление фруктов и овощей, злоупотребление алкогольными напитками), длительное психоэмоциональное напряжение или острый стресс.
Патогенез
Острая фокальная ишемия мозга вызывает определенную последовательность молекулярно-биохимических изменений в веществе мозга, способных привести к тканевым нарушениям. Характер изменений зависит от величины снижения мозгового кровотока, длительности этого снижения, а также от чувствительности вещества мозга к ишемии.
В норме мозговой кровоток составляет 50–55 мл крови на 100 г вещества мозга в минуту. Умеренное снижение кровотока сопровождается селективной экспрессией генов и снижением процессов синтеза белка. Более выраженное снижение кровотока (до 30 мл на 100 г/мин) приводит к активации анаэробного гликолиза и развитию лактат-ацидоза.
При снижении мозгового кровотока до 20 мл на 100 г/мин развивается глутаматная экс-айтотоксичность и увеличивается содержание внутриклеточного кальция, что запускает механизмы структурного повреждения мембран и других внутриклеточных образований.
При значительной ишемии (до 10 мл на 100 г/ мин) происходит аноксическая деполяризация мембран, при этом гибель клеток обычно наступает в течение 6–8 мин.
Помимо некроза в очаге ишемического поражения происходит гибель клеток по типу апоптоза, для реализации которого существуют определенные клеточные механизмы, включающие несколько уровней внутриклеточной регуляции.
При умеренном снижении мозгового кровотока наблюдается увеличение степени экстракции кислорода из артериальной крови, в связи с чем может сохраняться обычный уровень потребления кислорода в веществе мозга, несмотря на имеющееся снижение мозговой перфузии, выявляемое методами нейровизуализации. Снижение мозгового кровотока может иметь и вторичный характер, отражать уменьшенную потребность клеток мозга в энергии при первичном снижении их активности, в частности при некоторых фармакологических и токсических воздействиях на мозг.
Степень снижения мозгового кровотока и его длительность в сочетании с факторами, влияющими на чувствительность мозга к гипоксическому повреждению, определяют степень обратимости тканевых изменений на каждом этапе патологического процесса. Зону необратимого повреждения называют ядром инфаркта, зону ишемического поражения обратимого характера обозначают термином «пенумбра» (ишемическая полутень).
Важный момент – время существования пенумбры, так как с течением времени обратимые изменения переходят в необратимые, т.е. соответствующие участки пенумбры переходят в ядро инфаркта.
КЛАССИФИКАЦИЯ
В зависимости от патогенетического механизма развития острой фокальной ишемии мозга выделяют несколько вариантов ИИ. Наибольшее распространение получила классификация TOAST (Trial of Org 10172 in Acute Stroke Treatment), согласно которой выделяются следующие варианты ИИ:
- атеротромботический – вследствие атеросклероза крупных артерий, приводящего к их стенозу или окклюзии. При фрагментации атеросклеротической бляшки или тромба развивается артерио-артериальная эмболия, также включаемая в данный вариант инсульта;
- кардиоэмболический – наиболее частыми причинами являются мерцание предсердий, клапанный порок сердца, инфаркт миокарда, особенно давностью до 3 мес;
- лакунарный – вследствие окклюзии артерий малого калибра, поражение которых связано с артериальной гипертензией или сахарным диабетом;
- ИИ, связанный с другими более редкими причинами – неатеросклеротическими васкулопатиями, гиперкоагуляцией, гематологическими заболеваниями, гемодинамическим механизмом развития фокальной ишемии мозга, расслоением стенки артерий;
- ИИ неизвестного происхождения, к которому относят инсульты с неустановленной причиной или с наличием двух и более возможных причин, когда невозможно поставить окончательный диагноз.
Выделяют ИИ в сосудистых бассейнах:
- внутренняя сонная артерия;
- позвоночные артерии и их ветви;
- основная артерия и ветви;
- средняя мозговая артерия;
- передняя мозговая артерия;
- задняя мозговая артерия.
В остром периоде инсульта по клиническим критериям выделяют легкий, средней тяжести и тяжелый ИИ.
По тяжести поражения в качестве особого варианта выделяют малый инсульт, имеющаяся при котором неврологическая симптоматика регрессирует в первый 21 день заболевания.
В зависимости от динамики неврологических расстройств выделяют:
- инсульт в развитии («инсульт в ходу» – при нарастании выраженности неврологической симптоматики);
- завершенный инсульт (при стабилизации или обратном развитии неврологических расстройств).
Периоды ИИ:
- острейший период – первые 3 сут, из них первые 4,5 ч определяют как «терапевтическое окно» (возможность использования тромболитических препаратов для системного введения);
- острый период – до 28 сут;
- ранний восстановительный период – до 6 мес;
- поздний восстановительный период – до 2 лет;
- период остаточных явлений – после 2 лет.
ДИАГНОЗ
Клинические признаки и симптомы
Клиническая симптоматика при ИИ разнообразна и зависит от локализации и объема очага поражения головного мозга. Наиболее частой локализацией очага инфаркта мозга бывает каротидный (80–85%), реже – вертебрально-базилярный бассейн (15–20%).
Общемозговые симптомы характерны для инсультов средней и тяжелой степени. Выявляются нарушения сознания – оглушенность, сонливость или возбуждение, возможна кратковременная потеря сознания. Возможна головная боль, которая может сопровождаться тошнотой или рвотой; головокружение, боль в глазных яблоках, усиливающаяся при движении глаз. Реже наблюдаются судорожные припадки.
Очаговая неврологическая симптоматика
На фоне общемозговых симптомов инсульта появляются очаговые симптомы поражения головного мозга. Клиническая картина у каждого конкретного больного определяется тем, какой участок мозга пострадал из-за повреждения кровоснабжающего его сосуда.
Инфаркты в бассейне кровоснабжения средней мозговой артерии
При окклюзии проксимального отдела средней мозговой артерии (сегмент Ml) может возникать субкортикальный инфаркт, в то время как корковая область кровоснабжения остается непораженной при достаточном кровотоке по менингеальным анастомозам.
При отсутствии данных коллатералей может развиваться обширный инфаркт в области кровоснабжения средней мозговой артерии.
При инфаркте в области кровоснабжения поверхностных ветвей средней мозговой артерии может остро возникать девиация головы и глазных яблок в сторону пораженного полушария, при поражении доминантного полушария возможно развитие тотальной афазии и ипсилатеральной идеомоторной апраксии.
При поражении субдоминантного полушария развиваются контралатеральное игнорирование пространства, анозогнозия, апросодия, дизартрия.
Инфаркты головного мозга в области верхних ветвей средней мозговой артерии клинически проявляются контралатеральным гемипарезом (в основном верхних конечностей и лица) и контралатеральной гемианестезией той же преимущественной локализации при отсутствии дефектов полей зрения.
При обширных очагах поражения могут появляться содружественное отведение глазных яблок и фиксация взора в сторону пораженного полушария.
При поражениях доминантного полушария развивается моторная афазия Брока. Так же часто встречают оральную апраксию и идеомоторную апраксию ипсилатеральной конечности. Инфаркты субдоминантного полушария приводят к развитию пространственного одностороннего игнорирования и эмоциональным нарушениям.
При окклюзии нижних ветвей средней мозговой артерии могут развиваться двигательные нарушения, сенсорная аграфия и астереогноз. Часто обнаруживают дефекты полей зрения: контралатеральную гомонимную гемианопсию или (чаще) верхнюю квадрантную гемианопсию.
Поражения доминантного полушария приводят к развитию афазии Вернике с нарушением понимания речи и пересказывания, парафазическими семантическими ошибками. Инфаркт в субдоминантном полушарии приводит к развитию контралатерального игнорирования с сенсорным преобладанием, анозогнозии.
Для инфаркта в бассейне кровоснабжения стриатокапсулярных артерий характерны выраженный гемипарез (или гемипарез и гемигипестезия) или гемиплегия с дизартрией или без нее. В зависимости от размеров и локализации поражения парез преимущественно распространяется на лицо и верхнюю конечность или на всю контралатеральную половину тела.
При обширном стриатокапсулярном инфаркте могут развиваться типичные проявления окклюзии средней мозговой артерии или ее пиальных ветвей (например, афазия, игнорирование и гомонимная латеральная гемианопсия).
Для лакунарного инфаркта характерно развитие в области кровоснабжения одной из одиночных перфорантных артерий (одиночные стриатокапсулярные артерии). Возможно развитие лакунарных синдромов: изолированных гемипареза, гемигипестезии, атактического гемипареза или гемипареза в сочетании с гемигипестезией.
Наличие любых, даже транзиторных, признаков дефицита высших психических функций (афазия, агнозия, гемианопсия и т.д.) позволяет достоверно дифференцировать стриатокапсулярные и лакунарные инфаркты.
Инфаркты в бассейне кровоснабжения передней мозговой артерии
Инфаркты в бассейне кровоснабжения передней мозговой артерии встречают в 20 раз реже инфарктов в области кровоснабжения средней мозговой артерии. Наиболее частым клиническим проявлением бывают двигательные нарушения, при окклюзии кортикальных ветвей в большинстве случаев развивается моторный дефицит в стопе и всей нижней конечности и менее выраженный парез верхней конечности с обширным поражением лица и языка. Сенсорные расстройства обычно слабо выражены. а иногда отсутствуют полностью. Возможно также недержание мочи.
Инфаркты в бассейне кровоснабжения задней мозговой артерии
При окклюзии задней мозговой артерии развиваются инфаркты затылочной и медиобазальных отделов височной доли. Наиболее частыми симптомами бывают дефекты полей зрения (контралатеральная гомонимная гемианопсия). Могут присутствовать фотопсии и зрительные галлюцинации, особенно при поражении субдоминантного полушария. Окклюзия проксимального сегмента задней мозговой артерии (Р1) может приводить к развитию инфарктов ствола мозга и таламуса, вследствие того что эти области кровоснабжаются некоторыми из ветвей задней мозговой артерии (таламосубталамические, таламоколенчатые и задние хориоидальные артерии).
Инфаркты в вертебробазилярном бассейне кровоснабжения
Окклюзия единственной перфорирующей ветви базилярной артерии приводит к развитию ограниченного инфаркта ствола мозга, особенно в мосте и среднем мозге. Инфаркты ствола мозга сопровождаются симптомами поражения черепных нервов на ипсилатеральной стороне и моторными или сенсорными нарушениями на противоположной стороне тела (альтернирующие синдромы поражения ствола головного мозга). Окклюзия позвоночной артерии или ее основных пенетрирующих ветвей, отходящих от дистальных отделов, может приводить к развитию латерального медуллярного синдрома (синдром Валленберга–Захарченко).
Кровоснабжение латеральной медуллярной области также вариабельно и может осуществляться мелкими ветвями задненижней мозжечковой, передней нижней мозжечковой и базилярной артерий.
Анамнез
При сборе анамнеза заболевания необходимо выяснить точное время появления симптоматики, скорость и последовательность возникновения симптомов.
Для инсульта характерно внезапное возникновение неврологических симптомов; очаговая симптоматика бывает определяющей для диагностики острого нарушения мозгового кровообращения.
При сборе анамнеза жизни необходимо выявить возможные факторы риска инсульта – артериальную гипертензию, сахарный диабет, мерцательную аритмию и другие нарушения сердечного ритма, атеросклероз, перенесенные сосудистые заболевания (инфаркт миокарда, транзиторные ишемические атаки), гиперхолестеринемию, курение и др. Необходимо также уточнить наследственный анамнез.
Физикальное обследование
Физикальное обследование больного ИИ проводят по общепринятым правилам по системам органов (дыхательная, сердечно-сосудистая, пищеварительная, мочевыделительная и др.). При оценке неврологического статуса отмечают наличие и выраженность общемозговых симптомов, менингеального синдрома и очаговой неврологической симптоматики. Для выявления последних необходима последовательная оценка функций черепных нервов, двигательной системы, чувствительной и координаторной сфер, вегетативной системы и высших психических функций.
 Для оценки уровня сознания используется шкала комы Глазго (табл. 1). Шкала включает оценку таких параметров, как открывание глаз, двигательная и словесная реакции. Шкала комы Глазго имеет диапазон баллов от 3 (минимальное количество баллов, означающее наиболее тяжелую степень комы) до 15 (максимальное количество баллов, означающее нормальный уровень сознания).
Для оценки уровня сознания используется шкала комы Глазго (табл. 1). Шкала включает оценку таких параметров, как открывание глаз, двигательная и словесная реакции. Шкала комы Глазго имеет диапазон баллов от 3 (минимальное количество баллов, означающее наиболее тяжелую степень комы) до 15 (максимальное количество баллов, означающее нормальный уровень сознания).
Для количественной оценки тяжести неврологического дефицита у больных инсультом применяется шкала инсульта Национального института здоровья (NIHSS).
Шкала тяжести инсульта Национального института здоровья США (NIHSS)
1. Уровень сознания (выставляется оценка в баллах):
- 0 – в сознании, активно реагирует;
- 1 – сомноленция, но можно разбудить при минимальном раздражении, выполняет команды, отвечает на вопросы;
- 2 – сопор, требуется повторная стимуляция для поддержания активности, или заторможен, требуется сильная и болезненная стимуляция для произведения нестереотипных движений;
- 3 – кома, реагирует только рефлекторными действиями или не реагирует на раздражители.
2. Уровень сознания – ответы на вопросы
Спросить у больного, какой сейчас месяц, и его возраст. Записать первый ответ. Если афазия или сопор – оценка 2.
Если эндотрахеальная трубка, сильная дизартрия, языковой барьер – 1.
- 0 – правильный ответ на оба вопроса;
- 1 – правильный ответ на один вопрос;
- 2 – не даны правильные ответы.
3. Уровень сознания – выполнение команд
Пациента просят открыть и закрыть глаза, сжать и разжать непарализованную руку. Зас-читывается только первая попытка:
- 0 – правильно выполнены обе команды;
- 1 – правильно выполнена одна команда;
- 2 – ни одна команда не выполнена правильно.
4. Движения глазных яблок
Учитываются только горизонтальные движения глаз:
- 0 – норма;
- 1 – частичный паралич взора;
- 2 – тоническое отведение глаз или полный паралич взора, не преодолеваемый вызыванием окулоцефалических рефлексов.
5. Исследование полей зрения:
- 0 – норма;
- 1 – частичная гемианопсия;
- 2 – полная гемианопсия.
6. Парез лицевой мускулатуры:
- 0 – норма;
- 1 – минимальный паралич (асимметрия);
- 2 – частичный паралич – полный или почти полный паралич нижней группы мышц;
- 3 – полный паралич (отсутствие движений в верхней и нижней группах мышц).
7. Движения в верхних конечностях
Руки поднимаются под углом 45° в положении лежа, под углом 90° – в положении сидя. Если больной не понимает задания, врач должен поместить руки в требуемое положение сам. Баллы записываются отдельно для правой и левой конечностей:
- 0 – конечности удерживаются в течение 10 с;
- 1 – конечности удерживаются менее 10 с;
- 2 – конечности не поднимаются или не сохраняют заданного положения, но производят некоторое сопротивление силе тяжести;
- 3 – конечности падают без сопротивления силе тяжести;
- 4 – нет активных движений;
- 5 – невозможно проверить (конечность ампутирована, искусственный сустав).
8. Движения в нижних конечностях
В положении лежа поднять паретичную конечность на 5 с под углом 30°. Баллы записываются отдельно для правой и левой конечностей:
- 0 – конечности удерживаются в течение 5 с;
- 1 – конечности удерживаются менее 5 с;
- 2 – конечности не поднимаются или не сохраняют поднятого положения, но производят некоторое сопротивление силе тяжести;
- 3 – конечности падают без сопротивления силе тяжести;
- 4 – нет активных движений;
- 5 – невозможно проверить (конечность ампутирована, искусственный сустав).
9. Атаксия конечностей
Пальценосовая и пяточно-коленная пробы проводятся с двух сторон, атаксия засчитывается в том случае, если она не обусловлена парезом:
- 0 – отсутствует;
- 1 – в одной конечности;
- 2 – в двух конечностях.
10. Чувствительность
Учитывается только расстройство по гемитипу:
- 0 – норма;
- 1 – легкие или средние нарушения;
- 2 – значительное или полное нарушение чувствительности.
11. Афазия
Пациента просят описать картинку, назвать предмет, прочитать предложение:
- 0 – нет афазии;
- 1 – легкая афазия;
- 2 – выраженная афазия;
- 3 – полная афазия.
12. Дизартрия:
- 0 – нормальная артикуляция;
- 1 – легкая или средняя дизартрия. Не выговаривает некоторых слов;
- 2 – выраженная дизартрия;
- 3 – интубирован или другой физический барьер.
13. Агнозия (игнорирование):
- 0 – нет агнозии;
- 1 – игнорирование к двусторонней последовательной стимуляции одной сенсорной модальности;
- 2 – выраженная гемиагнозия или гемиагнозия более чем в одной модальности.
Полученные данные соответствуют следующей выраженности неврологического дефицита:
- 0 – состояние удовлетворительное;
- 3–8 – неврологические нарушения легкой степени;
- 9–12 – неврологические нарушения средней степени;
- 13–15 – тяжелые неврологические нарушения;
- 16–34 – неврологические нарушения крайней степени тяжести;
- 34 – кома.
Применение шкалы NIHSS позволит объективно подходить к состоянию больного инсультом и проводить оценку неврологического статуса в период пребывания больного в стационаре. Суммарный балл определяет тяжесть и прогноз заболевания.
При оценке менее 10 баллов вероятность благоприятного исхода через 1 год составляет 60–70%, а при оценке более 20 баллов – 4–16%. Эта оценка имеет также важное значение для планирования тромболитической терапии и контроля ее эффективности. Степень функционального восстановления больных инсультом оценивают по индексу Бартела, модифицированной шкале Рэнкина, шкале комы Глазго.
Лабораторные и инструментальные исследования
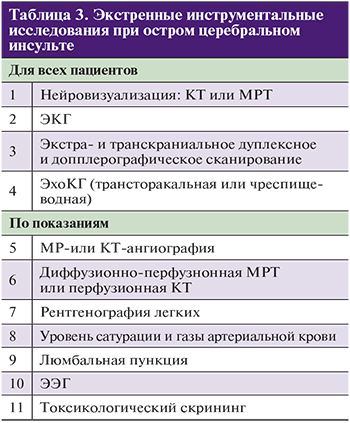
Лабораторные исследования (см. табл. 2)

Инструментальные исследования (см. табл. 3)
КТ и МРТ
Основные методы диагностики церебрального инсульта – КТ и МРТ – в настоящее время позволяют с высокой надежностью выявлять изменения, определяющие адекватный выбор методов лечения. Наиболее часто в остром периоде инсульта используется КТ в связи с ее круглосуточной доступностью в сосудистых центрах и возможностью проведения ангиографического и перфузионного исследований.
Компьютерная томография (+КТ-ангиография+КТ-перфузия).
При бесконтрастном КТ-исследовании обычно решаются следующие задачи:
- Выявление томографических признаков, нехарактерных для острого инсульта и предполагающих наличие других форм поражения мозга (опухоль, энцефалит, ушиб мозга и т.п.);
- Выявление внутричерепного кровоизлияния и его осложнений (смещение мозга, гидроцефалия, ангиоспазм);
- Выявление ранних признаков ишемического поражения:
- ранние гиподенсивные изменения в зоне ишемического поражения по сравнению с нормальным веществом мозга в противоположном («здоровом») полушарии с оценкой распространенности поражения – больше (равно) или меньше одной трети зоны кровоснабжения средней мозговой артерии;
- признаки положительного объемного эффекта в области поражения в виде сдавления конвекситальных (корковых) борозд и утраты ребристого вида коры островка в первые часы инсульта и сдавления желудочков и смещения срединных структур мозга обычно к концу первых суток заболевания;
- утрата контраста между серым и белым веществами в области лентикулярного ядра, головки хвостатого ядра, коры островка и конвекситальной коры;
- гиперденсивность ствола средней или задней мозговой артерии и «симптом точки», который связан с окклюзией ветвей средней мозговой артерии.
Визуализация ишемических изменений на КТ в течение первых часов от развития неврологических расстройств возможна у 2/3 пациентов со среднетяжелым и тяжелым инсультом, однако у пациентов с незначительным неврологическим дефицитом в первые часы заболевания она возможна не более чем в половине случаев.
КТ без контрастного усиления является надежным и быстрым способом для исключения различных острых внутричерепных кровоизлияний как противопоказаний к тромболитической терапии в первые часы инсульта.
Магнитно-резонансная томография (ДВИ, Т2, FLAIR, МРТ-перфузия, МР-ангиография)
В последние годы продемонстрировано преимущество МРТ при диагностике ишемических поражений мозга, а при использовании высокопольных томографов и новых режимов исследования то же справедливо и для геморрагического инсульта. При использовании быстрых режимов на высокопольных МР-томографах длительность МРТ-исследования сопоставима с длительностью КТ, в частности, предлагаются адекватные протоколы МРТ-исследования при остром инсульте длительностью 6–10 мин. Подострые и хронические внутричерепные кровоизлияния более точно и надежно по сравнению с КТ, диагностируются методами МРТ, в частности Т1- и Т2*- взвешенными изображениями.
Для раннего выявления ишемического поражения вещества мозга используются диффузионно-взвешенные изображения (ДВИ), которые позволяют надежно и без временной задержки диагностировать наличие цитотоксического отека в зоне поражения, что обычно указывает на развитие необратимого поражения (инфаркта мозга). Изменения на ДВИ, характерные для цитотоксического отека, сохраняются в течение 5–7 дней, после чего наступает «псевдонормализация», связанная с разрушением клеток в зоне необратимого поражения мозга. ДВИ позволяет надежно диагностировать повторное развитие инфаркта мозга на фоне постишемических изменений, что обычно представляет значительные трудности при использовании КТ или других режимов МРТ-исследования.
Использование градиентных Т2*-взвешенных изображений позволяет выявлять как острые (на высокопольных томографах), так и перенесенные ранее внутримозговые кровоизлияния, что связано с парамагнитными эффектами элементов крови, соответсвенно – деоксигемоглобина и гемосидерина. Выявление участков отложения гемосидерина в тканях позволяет ретроспективно диагностировать перенесенные геморрагические нарушения мозгового кровообращения, включая субклинические с небольшим объемом поражения вещества мозга.
После 6–12 ч ишемии информативность приобретают SE -(Т1, Т2) и FLAIR -режимы МРТ.
Перфузионная КТ и МРТ – метод оценки кровотока в головном мозге на микроциркуляторном уровне. Перфузия позволяет вычислить физиологические параметры объема и скорости мозгового кровотока, времени прохождения контрастного вещества через определенный объем ткани и жизнеспособность мозговой ткани. Информативна уже в первые минуты ишемии мозга. Скоростные значения на перфузионных картах особенно показательны для определения зоны ядра инфаркта, зоны пенумбры, здоровой ткани.
Мультиспиральная компьютерная ангиография
Возможность менее инвазивной визуализации артерий и вен головного мозга, а также перфузии мозга. Может замещать рентгенохиругическую ангиографию в оценке более проксимальных артериальных и крупных венозных сосудов, но ограничена в оценке дистальных – мелких и глубоких – сосудов. Включает внутривенное введение рентгенконтрастного вещества с последующим сканированием в тонких срезах по мере прохождения контрастного вещества через сосудистое русло.
Магнитно-резонансная ангиография (МРА) позволяет неинвазивно визуализировать сосуды головного мозга. Времяпролетная (Time of Flight, ToF) МРА применяется для скрининговых исследований артерий, выявления аневризм, артерио-венозных мальформаций и шунтов, патологических извитостей, дислокаций.
Ангиографические методики, включая КТА и МРА, рекомендуется в срочном порядке проводить пациентам с ТИА, малым инсультом и спонтанным регрессом симптоматики для выявления возможных сосудистых изменений, при которых показано оперативное лечение. Ангиография позволяет определить место и причину окклюзии и выявить пациентов с высоким риском повторного инсульта.
Совместное использование ДВИ и перфузионных МРТ-изображений позволяет решать диагностические задачи, которые невозможно решить при использовании других методов КТ и МРТ. На перфузионных MPT-изображениях выявляют участки гипоперфузии мозга. Сопоставление распространенности данных изменений с величиной гиперинтенсивных участков на ДВИ позволяет дифференцировать зону необратимых ишемических повреждений вещества мозга от пенумбры – зоны гипоперфузии с потенциально обратимыми тканевыми изменениями.
Ограничения МРТ заключаются в более длительном времени и более высокой стоимости исследования, невозможности исследования пациентов с металлическими телами в полости черепа и кардиостимуляторами. В настоящее время общепринятым стандартом при исследовании больных с острой сосудистой неврологической патологией считают предпочтительное использование КТ в 1-е сутки заболевания в целях дифференциальной диагностики между ишемическим поражением и геморрагическим инсультом, поскольку в это время выявляемость кровоизлияний при КТ выше, чем при МРТ, за исключением случаев использования специальных режимов исследования на высокопольных магнитно-резонансных (МР) томографах.
Ультразвуковые методы
Транскраниальная допплерография (ТКДГ) – дает информацию не только о скорости кровотока в главных внутричерепных артериях, но и о степени компенсации кровотока в исследуемом сосудистом бассейне, позволяет мониторировать кровоток по мозговым артериям для выявления сигналов от эмболов в пульсирующем потоке крови.
Наличие хорошей программы обнаружения таких сигналов и применение ряда проб позволяют определять источник эмболии (сердце, аорта, брахиоцефальные артерии) и состав эмболов. Эти данные влияют на выбор лечения в остром периоде инсульта и при вторичной его профилактике (антиагреганты или антикоагулянты), помогают в оценке эффективности лечения.
В первые часы или дни после закупорки часто наступает реканализация артерии. Поэтому в остром периоде инсульта ТКДГ целесообразно начинать как можно раньше и оценивать в динамике, так как скорость кровотока в артерии далеко не всегда помогает определить место ее окклюзии.
Дуплексное сканирование – сочетание ультразвуковой визуализации в режиме реального времени для оценки анатомического строения артерии с импульсным допплеровским анализом кровотока в любой интересующей точке просвета сосуда (с цветным кодированием сигналов для определения направления кровотока и его скорости).
Дуплексное сканирование позволяет выявлять пациентов с тяжелым стенозом сонной артерии на ранних этапах, когда показана катетеризационная ангиография и операция – каротидная эндартерэктомия.
ЭхоКГ показана пациентам:
- с подозрением на парадоксальную эмболию магистральных сосудов головного мозга;
- при неустановленной причине инсульта;
- с подозрением на кардиальный источник эмболии (при церебральных инфарктах в разных сосудистых бассейнах);
- с подозрением на патологию аорты.
По показаниям могут также применяться:
- электроэнцефалография – при наличии судорожного синдрома;
- рентгенография органов грудной клетки;
- холтеровское суточное мониторирование ЭКГ;
- суточное мониторирование АД;
- осмотр глазного дна, периметрия;
- УЗИ органов брюшной полости;
- УЗДГ сосудов почек;
- УЗИ почек.
Дифференциальный диагноз
ИИ необходимо дифференцировать прежде всего от внутримозговых кровоизлияний. Решающую роль играют нейровизуализирующие исследования – КТ или МРТ.
Иногда возникает необходимость в дифференциальной диагностике со следующими состояниями и заболеваниями:
Эпилептический припадок. После завершения фокального судорожного припадка у больного на протяжении определенного времени (обычно менее 24 ч) могут возникать очаговые неврологические симптомы, такие как слабость, онемение в конечностях, нарушение речи или зрения. В отличие от инфаркта головного мозга, очаговая симптоматика после припадка достаточно быстро регрессирует, однако в случае если у больного судорожный припадок сопровождал развитие инсульта, бывает невозможно определить, в какой степени возникшие неврологические нарушения обусловлены состоянием после припадка или непосредственно самим инсультом.
Мигрень. У больных могут возникать односторонняя слабость или онемение в конечностях, нарушения зрения или речи, связанные с приступом мигренозной головной боли («сложная» или ассоциированная мигрень). Помимо этого у таких больных повышен риск развития инсульта. Из-за высокой распространенности как мигрени, так и инсульта опасно относить возникшие неврологические нарушения к мигрени только на основании ее наличия в анамнезе. Наилучшее правило заключается в том, что в таких случаях лучше не ставить в качестве первого диагноза осложненную мигрень или мигренозный инсульт, если у больного не наблюдалось ранее подобных состояний, сопровождавшихся возникновением неврологических нарушений.
Синкопальные состояния обычно возникают из-за снижения системного артериального давления или аритмии. Инсульт редко отдельно проявляется синкопальным состоянием. Они могут возникать у больных с вертебробазилярной недостаточностью, но при наличии инсульта обычно дополнительно возникают признаки поражения ствола головного мозга или мозжечка, если обморок выступает составной частью симптоматики инсульта.
Субдуральная гематома. В зависимости от месторасположения она может вызвать слабость в контралатеральных конечностях или онемение, напоминающие инсульт. Дифференциальную диагностику проводят с помощью КТ головного мозга.
Паралич Белла (нейропатия лицевого нерва). При этом заболевании слабость лицевых мышц возникает на стороне поражения. При инсульте в стволе возникает периферический паралич лицевого нерва, а также и другие симптомы, такие как слабость в контрлатеральных конечностях, нарушение движения глазных яблок или ипсилатеральное поражение отводящего нерва.
Гипогликемия. У лиц с низким уровнем глюкозы плазмы крови могут возникать симптомы, напоминающие инсульт. Очень важно оценить уровень глюкозы плазмы крови и при необходимости восполнить ее недостаток.
Опухоль центральной нервной системы. Месторасположение опухоли определяет особенности наблюдаемых признаков и симптомов.
В отличие от инсульта, опухоль не проявляется в виде внезапно возникающей очаговой симптоматики, за исключением тех случаев, когда она вызывает судорожный припадок.
Герпетический энцефалит. При данной инфекции в основном поражаются лобные доли и у больных могут возникать афазия, гемипарез или выпадение полей зрения. Начало заболевания может быть острым и на ранних стадиях напоминать клиническую картину инсульта. При этом лихорадка, плеоцитоз в ликворе, снижение уровня сознания и судорожные припадки в значительно большей степени характерны для герпетического энцефалита.
Доброкачественные пароксизмальные головокружения. При этом заболевании могут возникать головокружение, тошнота, рвота, чувство нарушения координации движений, обычно при повороте головы в одном направлении. Причина данного синдрома заключается в поражении лабиринта, а не в инсульте. Однако, так же как и при обмороке, наличие любой стволовой или мозжечковой симптоматики должно вызывать настороженность в отношении возможного инсульта.
Конверсионные нарушения. У больных могут развиваться неврологические симптомы: общая слабость, онемение, затруднение речи как проявление стресса или психического заболевания. Однако всегда следует предполагать, что у больного может быть истинное неврологическое заболевание.
Все эти заболевания клинически могут проявляться признаками, похожими на симптомы инсульта. Дифференциальную диагностику проводят с помощью МРТ головного мозга в диффузионно-взвешенном режиме, при котором выявляют нарушения, возникающие при инсульте, но не при состояниях, схожих с ним клинически.
ЛЕЧЕНИЕ
Основные задачи проводимых лечебных мероприятий (медикаментозных, хирургических, реабилитационных) – восстановление нарушенных неврологических функций, профилактика осложнений и борьба с ними, вторичная профилактика повторных нарушений мозгового кровообращения.
Показания к госпитализации
Всех пациентов с подозрением на ОНМК следует госпитализировать в блок интенсивной терапии специализированного отделения для лечения больных инсультом. Транспортировку осуществляют на носилках с приподнятым до 30° головным концом.
Противопоказаний к госпитализации нет!
Относительными ограничениями являются:
- терминальная кома;
- деменция в анамнезе с выраженной инвалидизацией до развития инсульта;
- терминальная стадия онкологических заболеваний.
Немедикаментозное лечение
Включает мероприятия по уходу, оценку и коррекцию функции глотания, профилактику и лечение инфекционных осложнений (пролежни, пневмония, инфекции мочевыводящих путей и др.).
Раннее и адекватное питание больных – обязательная и ежедневная задача терапии. Наличие нарушений глотания, а также нарушение сознания являются показанием к проведению энтерального зондового питания. Расчет необходимых доз нутриентов проводят с учетом физиологических потерь и метаболических потребностей организма, тем более что при развитии ишемии возникает синдром гиперкатаболизма-гиперметаболизма. Недостаточность вводимых энтерально сбалансированных смесей требует дополнительного назначения парентерального питания. Доказано, что подавляющее большинство пневмоний при инсульте возникает в результате тех или иных нарушений глотания и микроаспираций. Следовательно, тестирование и раннее выявление нарушений глотания являются важной задачей.
При любом введении пищи или лекарственных препаратов пациент должен находиться в полусидячем положении в течение 30 мин после кормления. Санацию ротовой полости проводят после каждого приема пищи.
Хирургическое лечение
Цель хирургической декомпрессии при обширных инфарктах мозга – уменьшение внутричерепного давления, увеличение перфузионного давления и сохранение церебрального кровотока. В серии проспективных наблюдений хирургическая декомпрессия при обширном полушарном инфаркте позволила уменьшить летальность с 80 до 30% без увеличения количества тяжелоинвалидизированных выживших больных. При инфаркте мозжечка с развитием гидроцефалии вентрикулостомия и декомпрессия становятся операциями выбора. Как и при обширном супратенториальном инфаркте, операцию следует выполнять до развития симптомов вклинения ствола головного мозга.
Медикаментозное лечение
Лечение ИИ основывается на следующих главных позициях:
- базисная терапия;
- специфическая терапия;
- нейрометаболическая поддержка;
- медицинская реабилитация;
- предупреждение и лечение осложнений.
Базисная терапия ИИ
Базисная терапия – основные терапевтические стратегии, направленные на стабилизацию состояния тяжелобольных пациентов и коррекцию тех нарушений, которые могут осложнить восстановление неврологических функций. Базисная терапия является недифференцированной и не зависит от характера инсульта. Она включает поддержание функций дыхания и кровообращения, коррекцию метаболических и волемических нарушений, контроль уровня артериального давления, профилактику и лечение таких состояний, как припадки, венозные тромбозы, дисфагии, аспирационные пневмонии и другие инфекционные осложнения, коррекцию повышенного внутричерепного давления.
Рекомендации
Рекомендуется проведение мониторинга неврологического статуса, частоты сердечных сокращений, артериального давления, температуры и сатурации кислородом в течение 72 ч у больных с сохраняющимся неврологическим дефицитом.
Всем больным со снижением уровня сознания (8 баллов и меньше по шкале комы Глазго) показана интубация трахеи. Кроме того, интубация показана при аспирации или высоком ее риске при неукротимой рвоте и выраженном бульбарном или псевдобульбарном синдроме. Решение вопроса о необходимости ИВЛ принимают исходя из основных общих реанимационных положений:
- тахипноэ 35–40 в 1 мин, брадипноэ менее 12 в 1 мин.
- снижение рО2 менее 60 мм рт.ст., увеличение рСО2 более 50 мм рт.ст. в артериальной крови и жизненная емкость легких менее 12 мл/кг массы тела;
- нарастающий цианоз.
Все больные со сниженным уровнем бодрствования, наличием клинических либо нейровизуализационных признаков отека головного мозга и/или повышенного внутричерепного давления должны находиться в постели с приподнятым до 30° головным концом (без сгибания шеи!). У этой категории больных должны быть исключены или сведены к минимуму эпилептические припадки, кашель, двигательное возбуждение и боль.
Рекомендуется подача кислорода в случае снижения показателя сатурации кислородом ниже 95%;
Рекомендуется регулярный мониторинг жидкостного и электролитного баланса у пациентов с тяжелым инсультом или с расстройствами глотания.
Раствор хлорида натрия 0,9% рекомендуется для восполнения водного баланса в течение первых 24 ч от начала инсульта.
Не рекомендуется рутинное снижение артериального давления в острейшем периоде инсульта.
Рекомендуется осторожное снижение артериального давления у пациентов с высоким давлением при повторных измерениях (>220/120 мм рт.ст.) с выраженной сердечной недостаточностью, расслоением аорты или гипертонической энцефалопатией. Используют следующие антигипертензивные препараты: ингибиторы АПФ (каптоприл, эналаприл, периндоприл), антагонисты рецепторов АТ II (эпросартан, кандесартан), бета-адреноблокаторы (пропранолол, эсмолол), альфа-бета-адреноблокаторы (проксодолол, лабеталол), вазодилататоры (нитропруссид натрия).
Следует избегать резкого снижения артериального давления.
Рекомендовано возмещение объема жидкости при низком артериальном давлении, возникшем вследствие гиповолемии или явившимся причиной неврологического ухудшения в остром периоде инсульта. Объем парентерально вводимой жидкости (из расчета 30–35 мл/кг, может варьироваться от 15–35 мл/кг) с поддержанием гематокрита 30–33%. Рекомендуется физиологический раствор хлорида натрия для коррекции гиповолемии. Суточный баланс введенной и выведенной жидкости должен составлять 2500–2800 мл/1500–1800 мл, т.е. должен быть положительным. В случае развития отека мозга, отека легких, сердечной недостаточности рекомендуется слегка отрицательный водный баланс.
Недопустима терапия гипоосмолярными растворами (например, 5%-ная глюкоза) при опасности повышения внутричерепного давления.
Рекомендуется мониторинг уровня глюкозы.
При уровне гликемии >180 мг/дл (>10 ммоль/л) рекомендуется снижение уровня глюкозы сыворотки крови при помощи инсулина.
При гипогликемии (<50 мг/дл [<2,8 ммоль/л]) рекомендуется внутривенное введение декстрозы или инфузия 10–20%-ного раствора глюкозы.
Рекомендуется поиск сопутствующей инфекции при повышении температуры тела >37,5°C.
Рекомендуется лечение лихорадки (при температуре >37,5°C) при помощи парацетамола и физического охлаждения. Особенно жестко необходимо контролировать и корригировать температуру тела у пациентов с нарушенным сознанием, так как гипертермия увеличивает размер инфаркта и отрицательно влияет на клинический исход.
Профилактическое назначение антибиотиков не рекомендуется иммунокомпетентным пациентам;
Для профилактики тромбоза глубоких вен голени всем больным показано использование компрессионных чулок до полного восстановления нарушенных двигательных функций, прерывистая пневмокомпрессия. Для профилактики тромбоза глубоких вен голени и тромбоэмболии легочной артерии используют прямые антикоагулянты (низкомолекулярные гепарины).
Для купирования судорожного синдрома применяются диазепам, кислота вальпроевая, карбамазепин, при рефрактерном эпилептическом статусе – тиопентал натрия, пропофол.
Для мониторинга неврологического статуса следует использовать шкалу NIH (см. выше).
Специфическая терапия
Специфическое лечение при ИИ состоит в проведении реперфузионной терапии.
Различают медикаментозную ТЛТ, включающую системный внутривенный тромболизис, внутриартериальный селективный тромболизис с внутриартериальным введением фибринолитика, и ТЛТ с использованием механических устройств для реканализации (аспирационный катетер, устройства Penumbra, Catch, Merci Retrieval System, ультразвуковая деструкция тромба и т. д.), а также комбинации медикаментозной ТЛТ и механических технологий.
Для системной ТЛТ при ИИ используют внутривенное введение тканевого рекомбинантного активатора плазминогена rt-PA (Алтеплаза – Актилизе), который показан в течение первых 4,5 ч после начала развития инсульта у больных в возрасте от 18 до 80 лет – с осторожностью.
Противопоказания к тромболитической терапии:
- время появления первых симптомов больше 4,5 часов от начала заболевания или время появления первых симптомов инсульта не известно (например, развитие инсульта во время сна – так называемый ночной инсульт);
- повышенная чувствительность к алтеплазе, гентамицину;
- систолическое АД выше 185 мм рт.ст. или диастолическое АД выше 110 мм рт.ст. или необходимость в/в введения препаратов для снижения АД до этих границ;
- нейровизуализационные (КТ, МРТ) признаки внутричерепного кровоизлияния, опухоли мозга, артериовенозной мальформации, абсцесса мозга, аневризмы церебральных сосудов;
- хирургическое вмешательство на головном или спинном мозге;
- подозрение на субарахноидальное кровоизлияние;
- признаки тяжелого инсульта: клинические (балл по шкале инсульта NIH >25), нейровизуализационные (по данным КТ головного мозга и/или МРТ головного мозга в режиме ДВИ очаг ишемии распространяется на территорию более 1/3 бассейна средней мозговой артерии);
- одновременный прием пероральных антикоагулянтов, например варфарина при МНО >1,3;
- применение прямых антикоагулянтов (гепарин, гепариноиды) в предшествующие инсульту 48 ч со значениями АЧТВ выше нормы;
- предшествующие инсульт или тяжелая черепно-мозговая травма в течение 3 мес;
- существенный регресс неврологической симптоматики за время наблюдения за пациентом;
- легкие неврологические симптомы (NIH <4 баллов);
- геморрагический инсульт или инсульт неуточненного характера в анамнезе;
- инсульты любого генеза в анамнезе у больного сахарным диабетом;
- желудочно-кишечные кровотечения или кровотечения из мочеполовой системы за последние 3 нед. Подтвержденные обострения язвенной болезни желудка и двенадцатиперстной кишки в течение последних 3 мес;
- обширное кровотечение в настоящее время или в течение предыдущих 6 мес;
- тяжелые заболевания печени, включая печеночную недостаточность, цирроз печени, портальную гипертензию (с варикозным расширением вен пищевода), активный гепатит;
- острый панкреатит;
- бактериальный эндокардит, перикардит;
- аневризмы артерий, пороки развития артерий и вен. Подозрение на расслаивающую аневризму аорты;
- новообразования с повышенным риском кровотечения;
- большие операции или тяжелые травмы в течение последних 14 сут, малые операции или инвазивные манипуляции в последние 10 дней;
- пункции некомпремируемых (центральных) артерий и вен в течение последних 7 суток;
- длительная или травматичная сердечно-легочная реанимация (более 2 мин);
- беременность, родовспоможение, 10 дней после родов (отсутствует достаточное количество данных);
- количество тромбоцитов <100 000/мкл;
- глюкоза крови менее 2,7 ммоль/л или более 22,0 ммоль/л;
- геморрагические диатезы, включая почечную и печеночную недостаточность;
- данные о кровотечении или острой травме (переломе) на момент осмотра;
- судорожные приступы в дебюте заболевания, если нет уверенности, что приступ является клинической манифестацией ишемического инсульта с постиктальным резидуальным дефицитом.
Обследование пациентов перед проведением тромболитической терапии
Тромболитическая терапия при ишемическом инсульте должна проводиться в стационарах в условиях блока интенсивной терапии и реанимации при условии обязательного наличия в их структуре служб нейровизуализации (компьютерной или высокопольной магнитно-резонансной томографии) и лабораторной диагностики, функционирующих ежедневно круглосуточно. Тромболизис может проводиться лишь после исключения геморрагического характера поражения мозга.
Необходимо максимально стремиться к сокращению времени от момента поступления пациента в стационар до начала введения тромболитика, которое не должно превышать 60 мин (оптимально – менее 40 мин). С целью уменьшения временных затрат при поступлении пациентов с клиникой инсульта необходимы соблюдение отработанного порядка действий персонала, обязательное соблюдение стандартного диагностического протокола, использование формализованных шкал и алгоритмов.
При поступлении больного с симптомами инсульта необходимы:
- сбор анамнеза (с обязательным указанием точного времени начала заболевания, данными о перенесенных инсультах, кровотечениях, эпилептических приступах, хирургических вмешательствах и манипуляциях);
- оценка жизненно важных функций (ЧДД, ЧСС, АД) и неврологического статуса по общепринятым методикам;
- оценка неврологического статуса с использованием шкалы инсульта NIH (см. выше), позволяющей количественно отразить степень выраженности неврологического дефицита. При суммарном балле 25 и более по шкале NIH фибринолитическая терапия противопоказана;
- безотлагательное проведение бесконтрастной компьютерной томографии головного мозга. Заключение о результатах КТ должно быть получено в течение 40 мин от поступления пациента в стационар;
- забор венозной крови для проведения клинического анализа (с обязательным определением количества тромбоцитов), уровня гликемии, показателей МНО и АЧТВ. Результаты анализов должны быть получены в течение 20 мин от поступления больного в стационар;
- установка кубитального периферического венозного катетера.
Протокол проведения тромболитической терапии
При проведении тромболитической терапии необходимо обеспечить в течение как минимум 24 час мониторирование следующих жизненно важных функций:
- уровня АД;
- частоты сердечных сокращений;
- частоты дыхательных движений;
- температуры тела;
- сатурации кислородом.
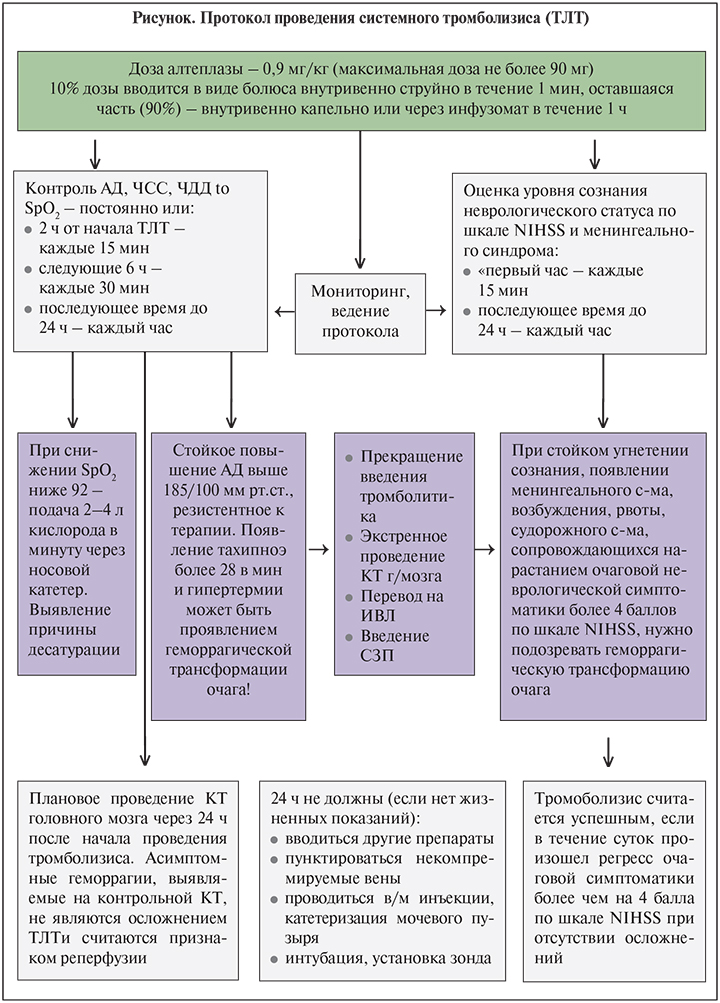
Введение тромболитика должно быть начато как можно раньше. Рекомендуемая доза алтеплазы – 0,9 мг/кг массы тела (максимальная доза – 90 мг); 10% дозы вводится в виде болюса внутривенно струйно в течение 1 мин, а оставшаяся часть (90%) – внутривенно капельно в течение 1 ч. При проведении процедуры фибринолиза не следует одновременно вводить другие препараты.
Во время процедуры тромболитической терапии и по ее завершении в течение суток необходимо контролировать динамику неврологического статуса.
Кратность оценки неврологического статуса по шкале NIH:
- во время проведения ТЛТ – каждые 15 мин;
- каждые 30 минут последующие 6 час;
- до 24 ч после процедуры тромболизиса – каждые 60 мин.
Следует отметить необходимость тщательного исследования менингеального синдрома при каждом осмотре больного, поскольку шкала NIH позволяет оценить только общемозговую и очаговую неврологическую симптоматику.
Кроме того, во время введения фибринолитика и после него необходимо:
- при развитии наружных кровотечений применять давящие повязки;
- следить за признаками появления крови в моче, кале, рвотных массах;
- избегать пункции и катетеризации вен и артерий во время введения алтеплазы;
- избегать катетеризации мочевого катетера во время введения алтеплазы и как минимум в течение 30 мин после завершения инфузии алтеплазы;
- избегать постановки назогастрального зонда во время введения алтеплазы и в течение 24 ч после завершения инфузии.
Если пациент нуждается в проведении инвазивных манипуляций (установка назогастрального зонда, мочевого катетера), необходимо данные манипуляции провести до начала ТЛТ.
Необходимо немедленно прекратить введение алтеплазы в случаях:
- развития анафилактической реакции, одним из маркеров которой может быть артериальная гипотензия;
- нарастания неврологического дефицита с увеличением на 4 и более баллов по шкале инсульта NIH;
- развития обильного кровотечения.
При внезапном ухудшении состояния пациента, возникновении выраженной головной боли, тошноты или рвоты, психомоторного возбуждения необходимо прекратить введение тромболитика и повторить КТ-исследование. При возникновении локальных геморрагий (из мест инъекций или десен (симптом «улыбки вампира»)) прекращения процедуры тромболизиса не требуется, остановка кровотечения возможна путем прижатия.
До проведения процедуры ТЛТ и в течение суток после нее не следует выполнять внутримышечных инъекций. Катетеризация центральных некомпремируемых вен (подключичной, яремной) запрещена в течение суток после ТЛТ. Пациент должен соблюдать постельный режим, не рекомендуется кормление после тромболизиса в течение 24 ч.
Контроль и коррекция уровня артериального давления при проведении ТЛТ
Во время проведения ТЛТ необходимо тщательно контролировать уровень АД. Систолическое АД не должно превышать 180 мм рт.ст., диастолическое – 105 мм рт.ст. Повышение АД во время тромболитической терапии или после нее значительно увеличивает риск развития наиболее тяжелого осложнения тромболизиса – геморрагической трансформации очага ишемического поражения мозга. При повышении систолического АД выше 180 мм рт.ст. и/или диастолического выше 105 мм рт.ст. во время проведения тромболизиса необходимо прекращение процедуры тромболитической терапии и снижение уровня АД ниже этих пределов.
Контроль артериального давления должен осуществляться:
- в течение 2 ч от начала ТЛТ – каждые 15 мин;
- следующие 6 ч – каждые 30 мин;
- в последующее время до 24 ч от начала ТЛТ – каждые 60 мин.
Отсутствие управляемого и быстрого эффекта ограничивает использование пероральных и сублингвальных лекарственных форм для коррекции артериальной гипертензии при проведении тромболитической терапии. Необходимо использовать формы для внутривенного введения.
Возможно применение следующих препаратов:
- ингибиторы ангиотензипревращающего фермента – эналаприлат (энап Р), однако одновременное применение ингибиторов АПФ с алтеплазой увеличивает риск развития ангионевротического отека;
- нитраты – изосорбит динитрат (изокет), нитроглицерин (перлиганит), однако частым побочным действием нитратов является развитие выраженной головной боли, которая может маскировать развитие внутричерепного кровоизлияния;
- вазодилятаторы – нитропруссид натрия (нанипрус);
- ганглиоблокаторы – азаметония бромид (пентамин);
- альфа-адреноблокаторы – урапидил (эбрантил), проксодолол (альбетор);
- блокаторы кальциевых каналов – нимодипин (нимотоп).
Сопутствующая терапия
Одновременно с введением алтеплазы не следует вводить другие препараты. При выраженном кровотечении (особенно из некомпремируемых сосудов) введение тромболитика должно быть прекращено. Показано введение свежезамороженной плазмы. Одновременное применение ингибиторов АПФ может повышать риск анафилактоидных реакций.
Запрещенные препараты
Антикоагулянты (гепарин, варфарин, дабигатран, ривароксабан и др.) и антиагреганты (аспирин, клопидогрел, дипиридамол) должны быть назначены не ранее 24 ч от начала проведения ТЛТ, поскольку в противном случае значительно возрастает риск кровотечений. Больные, получавшие аспирин до тромболизиса, имеют более высокий риск развития геморрагических осложнений, однако прием антиагрегантов до инсульта не является противопоказанием к выполнению тромболизиса.
Через 24 ч после ТЛТ для исключения внутричерепных кровоизлияний и гематом перед назначением антикоагулянтов или антиагрегантов необходимо проведение повторной КТ головного мозга (или раньше в случае клинического ухудшения).
Если провести тромболизис после нейровизуализирующего исследования невозможно, пациентам с ИИ как можно раньше назначают ацетилсалициловую кислоту в суточной дозе 100–300 мг. Раннее назначение препарата уменьшает частоту возникновения повторных инсультов на 30% и 14-дневную летальность – на 11%.
Положительное влияние прямых антикоагулянтов на больных инсультом в настоящее время не доказано. В связи с этим препараты гепарина не используют как стандартное средство для лечения больных со всеми патогенетическими типами инсульта. Однако выделены ситуации, при которых назначение препаратов гепарина считают оправданным: прогредиентное течение атеротромботического инсульта, кардиоэмболический инсульт, симптомная диссекция экстракраниальных артерий, тромбоз венозных синусов, дефицит протеинов С и S.
При применении гепаринов необходимы отмена принимаемых антиагрегантов, контроль активированного частичного тромбопластинового времени (строго обязателен при внутривенном введении гепарина натрия) и более жесткий контроль за гемодинамикой.
Нейрометаболическая поддержка
Нейрометаболическая поддержка (нейроцитопротекция) – любая стратегия (или комбинация стратегий), препятствующая или замедляющая повреждение ткани мозга, способствующая морфологическому, метаболическому и функциональному восстановлению нейронов и их окружения.
При ишемическом инсульте могут быть применены следующие средства нейропротекции:
Магния сульфат – блокатор возбуждающих аминокислот, кальциевых каналов, церебральный вазодилататор. Продемонстрирована его хорошая переносимость и эффективность.
Тиоктовая (альфа-липоевая) кислота – выполняет функции кофермента в митохондриях, участвует в окислительно-восстановительных реакциях, способствует утилизации углеводов, нормализует энергетический обмен, в патологических условиях имеет свойство «ловушки» свободных радикалов, активирует процессы биосинтеза восстановленного глутатиона, улучшает синтез оксида азота и стресс-белков (HSP72). Безопасность и эффективность показаны в мультицентровом исследовании ПОБЕДА.
Глицин – заменимая аминокислота, центральный нейромедиатор тормозного типа, оказывает антидепрессивное и седативное действия. Обладает глицин- и ГАМКергическим, альфа1-адреноблокирующим, антиоксидантным и антитоксическим действиями; регулирует деятельность глутаматных (NMDA) рецепторов. Безопасен. Применяется трансбуккально или сублингвально.
Семакс – синтетический аналог фрагмента АКТГ (метионил-глутамил-гистидил-фенилаланил-пролил-глицил-пролин), лишенный гормональной активности, относится к классу регуляторных пептидов. Влияет на процессы, связанные с обменом глюкозы и синтезом АТФ в нейронах и глиальных клетках, что увеличивает переносимость нервной тканью гипоксии. Снижает интенсивность перекисного окисления липидов, способствует восстановлению физико-химических свойств мембран, активирует синтез нейротрофических факторов. Вводится интраназально.
Церебролизин – комплекс пептидов, полученных из головного мозга свиньи, часть из которых обладает структурным и функциональным сходством с нейротрофическими факторами (цилиарным нейротрофическим фактором CNTF, нейротрофическим фактором глиальных клеток GDNF, инсулиноподобными факторами роста IGF-1 и IGF-2. Эффективность и безопасность применения Церебролизина при ИИ была продемонстрирована в крупномасштабных рандомизированных двойных слепых проспективных плацебо-контролируемых исследованиях. Показана безопасность применения Церебролизина спустя час после проведения процедуры тромболизиса и более быстрое восстановление пациентов после инсульта, что обеспечивает повышение реабилитационного потенциала пациента и способствует включению его в процесс ранней нейрореабилитации. Продемонстрировано существенное преимущество препарата в группе тяжелых пациентов (NIHSS 12) по восстановлению неврологического дефицита в сочетании с достоверным снижением летальности. Показано улучшение моторных и когнитивных функций к 90-му дню инсульта при применении препарата в остром периоде заболевания.
Полипептиды коры головного мозга скота – комплекс полипептидов и нейромедиаторов, способный оказывать тканеспецифичное воздействие на кору головного мозга, нормализовать соотношение возбуждающих и тормозящих аминокислот в головном мозге, регулировать содержание дофамина и серотонина, восстанавливать биоэлектрическую активность клеток головного мозга, оказывать влияние на окислительный стресс (антиоксидантный эффект) и ГАМКергическое влияние. Клинические исследования эффективности проводились в рамках многоцентровых контролируемых исследований.
Актовегин – депротеинизированный дериват крови телят, включающий более 200 биологических субстанций и имеющий мультимодальное антиоксидантное, антиапоптотическое и нейропротективное действие. Доказано достоверно более значительное восстановление когнитивных функций больных в течение первых 6 мес после ишемического инсульта, а также снижение риска формирования выраженных постинсультных когнитивных нарушений.
Цитиколин – (цитидин–5–дифосфохолин) – донатор холина для синтеза ацетилхолина, незаменимый метаболит для синтеза мембранных фосфолипидов. Оказывает мультимодальное действие: восстанавливает активность Na+/K+–АТФазы клеточной мембраны, снижает активность фосфолипазы A2 и участвует в синтезе фосфатидилхолина, т.е. оказывает антиоксидантный и мембраностабилизирующий эффект, ингибирует глутаматиндуцированный апоптоз и усиливает механизмы нейропластичности. Применение цитиколина снижает долгосрочную смертность и частоту инвалидизации с увеличением количества положительных результатов лечения. Показано преимущество применения цитиколина в отношении снижения инвалидности у пациентов с умеренным и тяжелым неврологическим дефицитом, если лечение было начато в течение 24 час после развития инсульта.
Холина альфосцерат – холин принимает участие в синтезе ацетилхолина, оказывает положительное действие на нейротрансмиссию, глицерофосфат – в синтезе мембранного фосфолипида. Препарат способствует улучшению передачи импульсов в холинергических нейронах, оказывает положительное влияние на эластичность мембран нервных клеток, а также на функцию рецепторов.
Этилметилгидроксипиридина сукцинат – ингибитор свободнорадикальных процессов и мембранопротектов, подавляет перекисное окисление липидов, повышает активность супероксиддисмутазы, соотношение липид–белок, уменьшает вязкость мембраны, увеличивает ее текучесть. Модулирует активность мембраносвязанных ферментов, рецепторных комплексов, что способствует сохранению структурно-функциональной организации биомембран, транспорта нейромедиаторов и улучшению синаптической передачи. Вызывает усиление компенсаторной активации аэробного гликолиза и снижение степени угнетения окислительных процессов, активацию энергосинтезирующих функций митохондрий, стабилизацию клеточных мембран. Включение этилметилгидроксипиридина сукцината в терапию ИИ способствует более выраженному достоверному уменьшению симптомов и функциональных нарушений к 9–10-ой нед лечения, более выраженной положительной динамике в отношении разрешения неврологической симптоматики, в том числе у пациентов с сахарным диабетом, достоверно более быстрому купированию депрессивных расстройств, улучшению качества жизни.
Инозин+никотинамид+рибофлавин+янтарная кислота. Янтарная кислота – эндогенный внутриклеточный метаболит цикла Кребса, выполняющий в клетках организма универсальную энергосинтезирующую функцию. Стимулирует аэробный гликолиз и синтез АТФ в клетках, улучшает тканевое дыхание. Рибофлавин (витамин В2) является флавиновым коферментом (ФАД), активирующим окислительно-восстановительные реакции цикла Кребса. Никотинамид (витамин РР) – амид никотиновой кислоты, активирует никотинамид-зависимые ферменты цикла Кребса, необходимые для клеточного дыхания и стимуляции синтеза АТФ. Инозин обладает способностью активировать ряд ферментов цикла Кребса, стимулируя синтез ключевых ферментов-нуклеотидов. Все компоненты являются естественными метаболитами организма и стимулируют тканевое дыхание.
Данные мета-анализа оценки клинической эффективности парентерального введения комбинации инозина, никотинамида, рибофлавина и янтарной кислоты при неврологических заболеваниях и различных поражениях ЦНС показали устойчивое повышение вероятности наступления позитивного исхода.
Винпоцетин (Кавинтон) – имеет многоплановые механизмы влияния на мозговой кровоток, которые включают антивазоконстрикторный эффект и ингибирование агрегационной активности тромбоцитов, а также способность нормализовать атромбогенный потенциал сосудистого эндотелия. Открытые нерандомизированные клинические исследования применения в остром периоде ИИ свидетельствуют о выраженном положительном гемореологическом эффекте препарата преимущественно у больных с лакунарным патогенетическим подтипом инсульта: уменьшался проагрегантный ответ тромбоцитов и дисбаланс факторов гуморальной регуляции гемостаза. По данным клинических исследований, препарат показал хорошую переносимость. По данным дуплексного сканирования МАГ с определением объемного полушарного кровотока (в условиях «острого опыта» – до и после однократной инфузии препарата), Кавинтон (винпоцетин) одинаково влиял на кровоток в здоровом и поврежденном полушариях мозга, что обеспечивало отсутствие феномена «обкрадывания».
Применение Кавинтона (винпоцетина) позволяет воздействовать на нейропластический потенциал головного мозга, необходимый для реорганизации системы контроля равновесия тела после ОНМК. Использование Кавинтона Комфорте (диспергируемые таблетки) в суточной дозе 30 мг (в комбинации с упражнениями вестибулярной гимнастики) достоверно повышает уровень мозгового нейротрофического фактора (BDNF) в плазме крови. BDNF служит регулятором стимулозависимого синаптогенеза и долговременной потенциации в различных отделах головного мозга, индуцируя формирование специфической памяти, стимуляция его синтеза посредством применения Кавинтона Комфорте может способствовать более успешной реабилитации больных со статодинамическими нарушениями после инсульта.
Мемантин – селективный блокатор NMDA – глутаматных рецепторов. Позволяет активировать рецепторы в процессе запоминания и блокировать их избыточную активацию в условиях повышенной эксайтотоксичности. Способен защищать холинергические нейроны и их окончания от повреждения, связанного не только с эксайтотоксическим эффектом, но и с токсическим действием β-амилоида, уменьшает аномальное гиперфосфорилирование τ-протеина и образование нейрофибриллярных клубочков, являющихся основным патоморфологическим маркером дегенеративного процесса при БА. Показано выраженное влияние Акатинола мемантина на восстановление высших психических функций и в меньшей степени двигательного дефицита у больных, перенесших левополушарный инсульт. При малых и средних постинсультных очагах включение Акатинола мемантина в курс нейрореабилитации активирует резервные возможности пораженного полушария. Применение мемантина позволяет стабилизировать и замедлять прогрессирование синдрома умеренных когнитивных расстройств. Наиболее выраженной положительная динамика была в сфере идеаторного праксиса, зрительно-пространственных и речевых функций, подборе слов, запоминании инструкций, увеличении объема слухо-речевой и зрительной памяти, улучшения инициации, планирования, качества выполнения повседневных действий, что позволяет сделать вывод о снижении степени инвалидизации больных, связанной с когнитивными расстройствами.
Медицинская реабилитация
Целью медицинской реабилитации является минимизация последствий нарушения мозгового кровообращения и сопутствующих заболеваний, предотвращение развития осложнений, повышение мотивации на выздоровление, оказание эмоциональной поддержки семье, обучение доступным для пациента приемам самообслуживания, подготовка к выписке на следующий этап реабилитации. Основными принципами медицинской реабилитации при церебральном инсульте являются раннее начало, мультидисциплинарность, адекватность, обоснованность, комплексность, преемственность, максимальное активное участие пациента, этапность, длительность.
Медицинская реабилитация включает:
- оценку (диагностику) нарушения функций; факторов риска проведения реабилитационных мероприятий; факторов, ограничивающих проведение реабилитационных мероприятий; морфологических параметров; функциональных резервов организма; состояния высших пси-
- хических функций и эмоциональной сферы; нарушений бытовых и профессиональных навыков; ограничения активности;
- формирование цели проведения реабилитационных мероприятий текущей (кратковременной) или итоговой (для определенного этапа и условий проведения реабилитационных мероприятий);
- формирование индивидуальной программы реабилитации;
- комплексное применение лекарственной и немедикаментозной терапии, а также средств, адаптирующих окружающую среду к функциональным возможностям пациента, и (или) функциональные возможности пациента к окружающей среде, в том числе посредством использования средств передвижения, протезирования и ортезирования;
- оценку эффективности реабилитационных мероприятий и прогноз.
Начинаться мероприятия по медицинской реабилитации должны в условиях сосудистого отделения, в первые 24–48 ч от момента развития церебрального инсульта при условии:
- стабильного состояния базовых показателей жизнедеятельности пациента в течение 24 ч;
- отсутствия загрудинных болей в течение 24 часов, за исключением стабильной стенокардии;
- отсутствия некупированных нарушений ритма и проводимости;
- наличия перспективы восстановления функций, повышения мобильности и социальной активности пациента (реабилитационного потенциала);
- наличия медицинского индивидуального плана проведения реабилитационных мероприятий;
- мотивированности (если пациент в сознании) пациента к предстоящему лечению;
- риск развития осложнений не должен превышает перспективу восстановления функций;
- отсутствия противопоказаний к проведению отдельных методов медицинской реабилитации на основании установленного реабилитационного диагноза.
Пациентам, имеющим выраженное нарушение функции, полностью зависимым от посторонней помощи в осуществлении самообслуживания, перемещения и общения и не имеющим перспективы восстановления функций (реабилитационного потенциала), подтвержденной результатами обследования, медицинская реабилитация проводится в медицинских организациях, осуществляющих уход за пациентами, и заключается в поддержании достигнутого или имеющегося уровня функций и приспособления окружающей среды под уровень возможного функционирования пациента.
Многочисленными исследованиями показано, что, чем раньше начаты реабилитационные мероприятия, тем они эффективнее, поэтому особое значение имеет внедрение в практику системы ранней реабилитации.
В острейший период церебрального инсульта, когда пациент находится в БИТРе, комплекс реабилитационных мероприятий направлен на восстановление сознания, дыхания, глотания, пищеварения, выделения, восстановление и поддержание уровня вегетативной регуляции функций, сохранение неповрежденных функций на должном уровне, обеспечение адекватного объема сенсорной стимуляции с целью восстановления нарушенных функций, предотвращение осложнений вследствие аспирации, длительного вынужденного положения, седации, миорелаксации, искуственной вентилляции легких, обезвоживания, недоедания.
Для пациентов, находящихся в сниженном состоянии сознания, применяются методы психологической реабилитации психотерапевтическими методами. С учетом отсутствия вербального контакта с пациентами методы работы основаны на нескольких подходах, основными из которых являются процессуально-ориентированный, телесно-ориентированный, биодинамический, элементы танатотерапии.
Все пациенты с дисфагией нуждаются в наблюдении и проведении комплекса лечебно-реабилитационных мероприятий: нутритивной поддержки, физических тренировок и физиотерапии, логопедической коррекции, терапии боли, психологической коррекции.
Эффективным способом предотвращения ортостатической недостаточности, нарушения гравитационного градиента, восстановления вегетативной регуляции, сенсомоторной стимуляции и поддержания сохранных функций на должном уровне является ранняя вертикализация пациента, осуществляемая в зависимости от его функционального состояния с помошью поворотного стола, стендера.
Поддержание должного уровня сенсомоторной активности, влияния стволовых рефлекторных и автоматизированных управляющих реакций на мышечно-тонические реакции пациента, вентиляции легких, профилактики развития трофических нарушений на раннем этапе обеспечивается применением различных лечебных положений, регулярно меняющихся в процессе осуществления ухода за пациентом в течение дня, а также нейроразвивающих кинезотерапевтических стратегий (Баланс, Войта, PNF, Бобат и др.), пассивно-активных роботизированных электромеханических технологий.
После перевода пациента в отделение для больных ОНМК продолжается процесс персонифицированной комплексной, преемственной реабилитации, направленной на предотвращение развития повторного нарушения мозгового кровообращения, максимально возможное восстановление функций пациента и адаптация к условиям и требованиям окружающей среды с целью повышения качества жизни.
С целью восстановления двигательной функции целесообразно использование нейроразвивающих терапевтических стратегий, основанных на использовании сохранных рефлекторных и автоматизированных влияний (Бобат, Brunnstrom, PNF, Войта, Баланс), общеукрепляющих стратегий двигательной терапии (изометрические, изотонические, изокинетические упражнения), в т.ч. направленные на поддержание и увеличение толерантности к нагрузкам (аэробный циклический тренинг), воздействий, направленных на восстановление схемы тела, устойчивости в различных положениях, ходьбы, координаторных взаимоотношений частей тела между собой и во взаимоотношении с окружающей средой (симметричные тренировки, тренировки с использованием зеркала, тренировки с изменением характеристик опоры); воздействий, восстанавливающих активные контакты с окружающей средой и формирующих способы влияния на окружение в новых условиях функционирования. С этой целью могут использоваться помимо кинезотерапии гидрокинезотерапия и роботомеханотерапия, в том числе с разгрузкой веса тела до 40%, тренажеры, различные технологии с биологической обратной связью, технологии с виртуальной реальностью, функциональная электростимуляция мышц, магнитотерапия, лазеротерапия и др. светотерапия, электротерапия, криотерапия, вибротерапия.
С целью нивелирования морфологических (укорочение нижней конечности) и функциональных (гипермобильность суставов, рекурвация колена и др.) дефектов, не связанных с сосудистым поражением мозга, но осложняющих процесс восстановления для улучшения стабильности во время ходьбы, рекомендуется использование ортезов.
В случае если недостаточность двигательной функции связана с выраженным повышением тонуса и сопровождается болью, значительным ограничением выполнения гигиенических мероприятий и выраженным снижением функции в комплексе реабилитационных мероприятий, необходимо предусмотреть возможность использования миорелаксантов или ботулотоксина с контролем эффективности влияния терапии на состояние мышечного тонуса. При этом следует отдавать предпочтение медикаментозному лечению ботулотоксином перед оральными формами миорелаксантов из-за побочных эффектов.
В мероприятия по нейропсихологической реабилитации включаются пациенты, имеющие дефицит сознания, внимания, памяти, управляющих функций и критичности, речи, визуальное игнорирование, нарушение праксиса. Для преодоления регуляторной апраксии ведущим методом является создание развернутых программ деятельности и действий и их постепенное сворачивание; кинестетической апраксии – методы, основанные на постепенно усложняющихся манипулятивных движениях в мелких суставах верхних конечностей с различным по структуре материалом; кинетической – методы, предусматривающие раздельно-конструктивный подход к выполнению копирующих движений; пространственной – методы, направленные на восстановление схемы тела, взаимодействия частей тела между собой, с предметами окружающего пространства, предметов окружающего пространства между собой, представление этих действий, конструирование и планирование похожих действий. Наиболее известными методами при работе по приспособлению пациента с апраксией к повседневным окружающим его условиям являются стратегический тренинг, исследовательский тренинг, метод безошибочного выполнения.
Восстановление дефицита управляющих функций признано очень важным направлением нейрореабилитации, так как эти расстройства тормозят прогресс во всех других сферах лечения. Выбор направления занятий и заданий определяется тем, какой из аспектов восстанавливается. При этом важнейшим принципом восстановления и компенсации управляющих функций является четкое структурирование предъявляемых больному заданий и условий их выполнения.
У пациентов с речевыми нарушениями вследствие поражения правого полушария больше внимания обратить на оценку общих когнитивных функций, таких как ориентация во времени и месте, внимание, краткосрочная память, зрительно-пространственное восприятие, а также связность, уместность и прагматика их высказываний, нарративов и пересказов. Для постановки этого диагноза логопеду важно тесно взаимодействовать с нейропсихологом, который проводит скрининг-оценку когнитивных функций.
У пациента с нарушением моторной стороны речи больше внимания уделяется оценке неречевых симптомов, предусматривающих изучение строения артикуляционного аппарата, объема артикуляционных движений, состояния мимической и речевой мускулатуры, дыхания и голоса. В рамках диагностики устной речи при дизартрии и других моторных нарушениях проводится исследование произносительной стороны речи (звукопроизношения, темпа, ритма, просодики, разборчивости речи); синхронности процессов артикуляции, дыхания и голосообразования.
Рекомендации
- Медицинская реабилитация начинается в первые 24–48 ч от развития заболевания в отделении реанимации и интенсивной терапии и включает мероприятия по оценке глотания, ранней вертикализации, ранней мобилизации, сенсорной стимуляции и профилактики осложнений.
- В медицинскую реабилитацию включаются пациенты, имеющие реабилитационный потенциал.
- Медицинская реабилитация включает диагностические мероприятия, постановку цели, формирование индивидуальной программы реабилитации, комплексное применение лекарственной и немедикаментозной терапии, оценку эффективности реабилитационных мероприятий и прогноз.
- Для диагностики должны использоваться стандартизированные методы клинической, лабораторной, инструментальной оценки, клинические шкалы и тесты.
- Реабилитационные мероприятия проводятся специально укомплектованной и подготовленной мультидисциплинарной командой, включающей невролога, реаниматолога (в БИТиРе), врача ЛФК, врача-физиотерапевта, инструктора-методиста по лечебной физкультуре, нейропсихолога-логопеда, медицинского психолога, эрготерапевта (специалиста по социально-бытовой реабилитации), медицинских сестер, социального работника, сиделок или ухаживающих за пациентом и самого пациента.
- Физическая реабилитация является обязательным компонентом реабилитационных мероприятий, но никакой из ее методов не имеет преимуществ.
- При нарушении взаимодействия и общения пациента с инсультом вследствие нарушения высших психических функций и речи рекомендовано специальное корригирующее лечение.
- Восстановление навыков самообслуживания является обязательным компонентом реабилитационных программ.
- С целью нивелирования морфологических и функциональных дефектов, не связанных с сосудистым поражением мозга, но осложняющих процесс восстановления, для улучшения стабильности во время ходьбы рекомендуется использование ортезов.
- С целью коррекции повышения мышечного тонуса рекомендуется отдавать предпочтение ботулиническому токсину перед оральными миорелаксантами.
- Родственники, ухаживающий персонал (сиделки) и сам пациент должны быть обязательно активно включены в процесс медицинской реабилитации.
Предупреждение и лечение осложнений
Для лечения инфекционных осложнений после инсульта рекомендовано использование антибиотиков.
Профилактическое использование антибиотиков не рекомендовано; левофлоксацин может быть вреден для пациентов с острым инсультом.
Ранняя регидратация и использование компрессионных чулок рекомендованы для уменьшения риска тромбоэмболий.
Ранняя мобилизация рекомендована для предотвращения таких осложнений, как аспирационная пневмония, тромбозы глубоких вен и пролежни.
Подкожное введение гепарина или низкомолекулярных гепаринов показано пациентам с высоким риском венозных тромбозов и ТЭЛА через >24 ч после тромболизиса.
Назначение антиконвульсантов рекомендовано для профилактики повторных постинсультных судорожных припадков. Профилактическое использование антиконвульсантов у пациентов, не имевших эпиприпадков во время развития инсульта, не рекомендовано.
Пациентам с недержанием мочи рекомендована консультация специалиста.
Питание per os рекомендовано пациентам без дисфагии.
Ранняя постановка назогастрального зонда (в первые 48 ч) рекомендована пациентам с нарушениями глотания.
Гастростомия не рекомендована в первые 2 нед после развития инсульта.
Вторичная профилактика ИИ
Вторичная профилактика должна быть начата не позднее 48 ч после развития ИИ. Индивидуализированная вторичная профилактика инсульта уменьшает риск развития повторного нарушения мозгового кровообращения на 20–30%.
Коррекция факторов риска
- отказ от курения или уменьшение числа выкуриваемых сигарет;
- прекращение злоупотребления алкоголем, тем, кто не употребляет алкоголь, не нужно рекомендовать его употребление;
- увеличение физической активности, если она низкая. Рекомендуется (при отсутствии противопоказаний) постепенное достижение физической активности, которая была до инсульта, и ее постепенное увеличение, если она была низкой;
- рациональное питание с использованием в достаточном количестве фруктов и овощей, растительного масла, ограничение потребления продуктов, богатых холестерином;
- снижение избыточного веса путем снижения калорийности питания, увеличения физической активности;
- рекомендуется лечение расстройств дыхания во время сна, таких как синдром сонных апноэ, при помощи постоянного положительного давления в дыхательных путях;
- лечение сахарного диабета с достижением уровня глюкозы, близкого к нормальному (5,6 ммоль/л), поддержание АД на уровне 130/80 мм рт.ст. и ниже. Применение существующих рекомендаций для гликемического контроля и целевых уровней АД для пациентов с диабетом рекомендуется и для пациентов, перенесших инсульт. Это существенно снижает риск микроваскулярных осложнений (нефропатия, ретинопатия, диабетическая полиневропатия). В качестве антигипертензивных средств следует использовать ингибиторы ангиотензинпревращающего фермента и блокаторы рецепторов к ангиотензину-II, которые наиболее эффективны в предупреждении заболевания почек.
Лекарственные терапия
Антигипертензивная терапия
Снижение АД рекомендуется для профилактики ИИ и других сосудистых заболеваний. Снижение АД целесообразно и при отсутствии артериальной гипертензии. Оптимальный уровень АД индивидуален; следует постепенно снизить АД на 10/5 мм рт.ст. и достигнуть нормальных значений АД ниже 140/90 мм рт.ст., в случае сахарного диабета и почечной недостаточности – 130/80 мм рт.ст., для больных с лакунарным инсультом – ниже 130/80 мм рт.ст. У больных, имеющих существенный стеноз (сужение более 70% диаметра) или окклюзию сонных артерий, целесообразен более высокий уровень систолического АД.
Могут быть использованы различные классы антигипертензивных средств с учетом индивидуальных особенностей; рекомендуется включение в терапию диуретиков, комбинации диуретика и ингибитора ангиотензипревращающего фермента. Применение эпросартана, более эффективно во вторичной профилактике ИИ, чем применение нитрендипина.
Антитромботическая терапия
При некардиоэмболическом инсульте (атеротромботическом, лакунарном и инсульте с неясной причиной) рекомендуются антиагрегантные средства, при кардиоэмболическом инсульте – непрямые антикоагулянты.
Ацетилсалициловая кислота (аспирин) для вторичной профилактики ИИ рекомендуется в дозе от 75 до 325 мг в сут.
Клопидогрел применяется по 75 мг в сут. Небольшое преимущество клопидогрела над аспирином наиболее значимо для больных сахарным диабетом, клиническими проявлениями атеросклероза в разных сосудистых бассейнах.
Комбинация клопидогрела с ацетилсалициловой кислотой не рекомендуется в рутинной практике, так как сопровождается существенным увеличением геморрагических осложнений. Комбинация клопидогрела и 100 мг аспирина показана пациенту, который перенес не только ИИ, но и стентирование коронарных артерий, мелкоочаговый инфаркт миокарда (без образования зубца Q) или имеет нестабильную стенокардию в течение не менее 9 мес.
Дипиридамол 200 мг замедленного высвобождения назначается два раза в сутки, не имеет достоверных преимуществ над аспирином.
Назначение дипиридамола целесообразно в случаях непереносимости аспирина или клопидогрела или резистентности к этим препаратам.
Комбинация дипиридамола замедленного высвобождения 200 и 25 мг аспирина назначается 2 раза в сут, имеет незначительное преимущество над аспирином. Эта комбинация не эффективнее приема одного клопидогрела.
Непрямые антикоагулянты рекомендуются больным фибрилляцией предсердий, искусственным клапаном сердца или другой причиной кардиоэмболического ИИ.
Варфарин назначается по 2,5–10 мг/сут с достижением и постоянным поддержанием МНО на уровне 2–3, используется при различных причинах кардиоэмболического инсульта. Требуется постоянный лабораторный контроль МНО.
При неклапанной фибрилляции предсердий рекомендуются новые пероральные антикоагулянты, которые не уступают по эффективности варфарину, но имеют более низкую частоту внутричерепных кровотечений. Применение новых пероральных антикоагулянтов не требует, в отличие от варфарина, регулярного контроля МНО.
Дабигатран назначается по 150 или 110 мг (при клиренсе креатинина 30–50 мл/мин) в сут в два приема, в дозе 150 мг 2 раза в сутки дабигатран значительнее, чем варфарин, снижает частоту повторного ИИ. Кроме того, дабигатран может быть использован для профилактики ТГВ и ТЭЛА в дозе 150 мг х 2 раза в день.
Ривароксабан применяется по 20 или 15 мг (при клиренсе креатинина 30–50 мл/мин) один раз в сут. Кроме того, ривароксабан может быть использован для профилактики и лечения ТГВ и ТЭЛА.
Апиксабан применяется по 5 или 2,5 мг (при 2 и более из нижеперечисленных критериев: возраст 80 лет и старше, вес 60 кг и меньше, уровень креатинина 133 ммоль/л и больше) 2 раза в сут.
Если нельзя использовать непрямые антикоагулянты, то используют антитромбоцитарные средства, при этом комбинация клопидогрела (75 мг в сут) и аспирина (75–100 мг в сут) незначительно эффективнее, чем прием одного аспирина (75–100 мг в сут), но частота геморрагических осложнений сопоставима с применением пероральных антикоагулянтов.
Статины
Среди групп препаратов, нормализующих липидный спектр крови, доказанной эффективностью для профилактики ИИ обладают статины.
Статины рекомендуются больным, перенесшим некардиоэмболический ИИ, имеющим признаки церебрального атеросклероза или уровень общего холестерина 5,6 ммоль/л и выше. Целевой уровень холестерина ЛПНП при терапии статинами составляет 1,8 ммоль/л и менее.
Статины назначаются и при отсутствии клинических проявлений ишемической болезни сердца, гиперхолестеринемии.
Хирургические методы лечения
Каротидная эндартерэктомия
В последние годы получены убедительные данные о преимуществах хирургического метода лечения – каротидной эндартерэктомии (КЭАЭ) по сравнению с консервативным лечением пациентов с гемодинамически значимым сужением сонных артерий (более 70% просвета сосуда). В рандомизированных клинических исследованиях показано, что риск развития церебрального инсульта при хирургических вмешательствах уменьшается с 26 до 9% ко 2-му году и с 16,8 до 2,8% – к 3-му году. Отмечено снижение показателей 10-летней смертности от сердечно-сосудистых нарушений на 19% среди пациентов, подвергшихся каротидной эндартерэктомии. КЭАЭ рекомендуется при гомолатеральном (очагу ИИ) выраженном стенозе (сужении 70–99% диаметра) внутренней сонной артерии в период 6 мес с момента ИИ. Результат лучше при операции в ранние сроки (особенно до 2 нед), если нет противопоказаний.
КЭАЭ является операцией выбора. Однако на сегодняшний день существует соглашение между экспертами, выделяющее категорию пациентов, которым рекомендуется эндоваскулярное вмешательство, так как проведение КЭАЭ у них сопряжено с повышенным риском осложнений.
Каротидное стентирование
Эндоваскулярное вмешательство применяется в следующих случаях: когда проведение КЭАЭ затруднено в связи с особым расположением стеноза (локализация стеноза с неудобным доступом для КЭАЭ); имеется высокий риск проведения общей анестезии пациентам с соматической патологией (тяжелая сердечно-легочная недостаточность, осложненный сахарный диабет, неконтролируемая артериальная гипертензия и др.); имеется расслоение внутренней сонной артерии; радиационный стеноз внутренней сонной артерии; предшествующее облучение или радикальное хирургическое вмешательство на шее; рестеноз после КЭАЭ; фибромаскулярная гиперплазия; артериит Такаясу и др. При этом периоперативная заболеваемость и смертность не должны превышать 4–6%.
Наложение экстраинтракраниального анастомоза не рекомендуется в качестве стандартного вмешательства у больных, перенесших ИИ и имеющих закупорку ВСА. Этот метод лечения обсуждается в тех случаях, когда доказано снижение цереброваскулярной реактивности на стороне окклюзии ВСА или у больного имеются клинические проявления очаговой ишемии в бассейне закупоренной артерии, несмотря на оптимальное медикаментозное лечение.
Рекомендации
КЭАЭ показана больным со стенозом сонной артерии более 70%, сопровождающимся симптоматикой, в центрах с показателями периоперационных осложнений (все инсульты и смерть) менее 6%.
КЭАЭ может быть показана больным со стенозом сонной артерии 50–69%, сопровождающимся симптоматикой. В этих случаях КЭАЭ наиболее эффективна для мужчин, перенесших полушарный инсульт.
КЭАЭ не рекомендуется пациентам со стенозом сонной артерии менее 50%.
До, во время и после операции каротидной эндартерэктомии пациентам следует назначать антиагрегантную терапию.
Пациентам с противопоказаниями к КЭАЭ или при стенозе в хирургически недоступном месте можно выполнить каротидную ангиопластику.
Наличие атеротромботической бляшки с неровной (эмбологенной) поверхностью повышает риск развития ИИ в 3,1 раза и определяет показания к КЭАЭ.
Больным с рестенозом после КЭАЭ можно выполнить каротидную ангиопластику или стентирование.
Оценка эффективности лечения
Общие индикаторы эффективности
- полная стабилизация жизненно важных функций (дыхание, центральная гемодинамика, оксигенация, водно-электролитный баланс, углеводный обмен);
- минимизация неврологического дефицита и отсутствие неврологических осложнений (отек головного мозга, судорожный синдром, острая окклюзионная гидроцефалия, кровоизлияние в зону инфаркта, дислокация), подтвержденное данными нейровизуализации (КТ, МРТ);
- отсутствие соматических осложнений (пневмония, ТЭЛА, тромбоэмболии глубоких вен нижних конечностей, пролежни, пептические язвы, инфекции мочевыводящих путей и др.);
- нормализация уровня АД с достижением целевых значений к 5–7-му дню перенесенного ИИ;
- восстановление повседневной независимости и по возможности трудоспособности.
Эффективность тромболитической терапии определяется успешной реканализацией и реперфузией в пораженном сосудистом бассейне, клинической динамикой и отсутствием осложнений, в частности геморрагической трансформации очага поражения головного мозга. Положительная динамика в течение первых 24 ч после проведения тромболитической терапии, как правило, позволяет прогнозировать последующее хорошее восстановление.
Случаи клинического улучшения с уменьшением балла по шкале инсульта NIH на 4 и более через 24 часа после начала ТЛТ могут расцениваться как значительное, или «драматическое», улучшение.
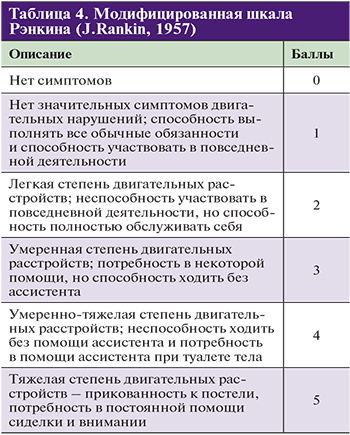 Конечные исходы оцениваются по модифицированной шкале Рэнкина, согласно которой 0–1 балл соответствует благоприятному исходу, а 0–2 балла – выходу на независимость в повседневной жизни.
Конечные исходы оцениваются по модифицированной шкале Рэнкина, согласно которой 0–1 балл соответствует благоприятному исходу, а 0–2 балла – выходу на независимость в повседневной жизни.
Реканализация инфаркт-зависимой артерии после проведения ТЛТ верифицируется на основании данных ультразвуковых методов исследования, а также данных МР или КТ-ангиографии.
Осложнения и побочные эффекты лечения
Самой частой неблагоприятной реакцией, связанной с введением фибринолитиков, являются кровоизлияния, приводящие к снижению гематокрита и (или) гемоглобина. Выделяют следующие типы кровотечений, связанных с ТЛТ:
- малые кровотечения (обычно вследствие пункции или повреждения кровеносных сосудов, из десен);
- большие кровотечения (в желудочно-кишечном или урогенитальном тракте, в забрюшинном пространстве, центральной нервной системе или кровотечения из паренхиматозных органов).
При лечении острого ишемического инсульта основной нежелательной реакцией ТЛТ является симптомное внутримозговое кровоизлияние (при использовании алтеплазы частота достигает 6–8%). В случае развития потенциально опасного кровотечения, особенно церебрального, лечение должно быть прекращено. Тем не менее в целом необходимости в замещении факторов свертывания не возникает вследствие короткого периода полувыведения алтеплазы и умеренного действия препарата на системные факторы коагуляции. Для большинства больных с кровотечениями достаточно прекращения тромболитической терапии, возмещения объема циркулирующей жидкости и осуществления мануальной компрессии кровоточащего сосуда. В тех редких случаях, когда указанные консервативные меры недостаточны, показано применение препаратов крови. Необходимо учитывать, что с введением фибринолитика можно связать только те осложнения, которые развились в течение 24–36 ч после введения алтеплазы.
Геморрагическая трансформация очага поражения головного мозга является симптомной, если ее развитие приводит к увеличению суммарного балла по шкале инсульта NIH на 4 и более баллов. В большинстве случаев внутримозговых геморрагий после ТЛТ регистрируется формирование асимптомной геморрагической трансформации, выявляемой методами КТ или МРТ, которая зачастую сопутствует клиническому улучшению и является свидетельством реперфузии.
При подозрении на внутримозговое кровоизлияние в обязательном порядке должны быть проведены нейровизуализационные исследования (КТ или МРТ головного мозга).
При необходимости пациент должен быть проконсультирован врачом-нейрохирургом.
Значительно реже на фоне введения алтеплазы возникают аллергические реакции и ангионевротический отек языка и губ. Для некоторых пациентов введение алтеплазы сопровождается тошнотой и рвотой.
Ошибки и необоснованные назначения
Рутинное снижение артериального давления при умеренной артериальной гипертензии, слишком резкое снижение артериального давления с уровней, требующих его коррекции (>220/120 мм рт. ст.).
Назначение антикоагулянтов (гепарин, варфарин, дабигатран) и антиагрегантов (аспирин, клопидогрел, дипиридамол, тиклопидин) одновременно или ранее 24 ч от начала проведения ТЛТ.
Проведение ТЛТ ранее 48 часов после применения антикоагулянтов.
Проведение ТЛТ позднее первых 4,5 ч после начала развития инсульта или когда время начала его развития неизвестно.
Проведение ТЛТ при тяжелом инсульте (балл по шкале инсульта NIH >25) или, напротив, при легких неврологических симптомах (NIH <4 баллов)
Применение для ТЛТ тромболитических препаратов I поколения (cтрептокиназа, антистреплаза, урокиназа и др.);
Применение кортикостероидов при отеке головного мозга;
Отсутствие должного учета всех противопоказаний.
Применение в острейшем и остром периодах ИИ препаратов, способствующих истощению нейронов или вызывающих синдром обкрадывания. К таким препаратам относятся ноотропы и вазоактивные средства (пирацетам, пикаитлон, эуфиллин, пентоксифиллин, ницерголин).
ПРОГНОЗ
Прогноз ИИ определяется клиническим и функциональным исходом заболевания – вероятность летального исхода, длительность периода восстановления, вероятность развития осложнений, отдаленных неврологических последствий и повторного инфаркта мозга.
Главными факторами, влияющими на прогноз для жизни, являются возраст пациента, локализация очага, причина, тип и изначальная тяжесть инсульта. В дальнейшем на исход инсульта влияют своевременность поступления в стационар, адекватность лечения, наличие тяжелых сопутствующих заболеваний, психических нарушений, присоединение неврологических осложнений (отек мозга с поражением ствола или мозжечка, комы), позднее начало реабилитации, развитие повторного инсульта.
Неблагоприятными прогностическими факторами при ИИ являются пожилой возраст, значительное и стойкое повышение температуры тела (поражение центра терморегуляции), гипотония, аритмии сердца, тяжелая стенокардия или состояние после инфаркта миокарда, выраженные когнитивные расстройства, грубый гемипарез, соматические болезни в стадии декомпенсации и/или тяжелые инфекционно-воспалительные заболевания и угнетение сознания с развитием комы.



