Эффективное купирование хронической, прежде всего стойкой интенсивной, боли до настоящего времени остается серьезной проблемой во всех странах мира. Эта проблема актуальна и значима во многих аспектах – медицинском и гуманистическом, политическом и правовом, социальном и экономическом.
Хроническая боль (ХБ) – чрезвычайно распространенное явление. Как показали результаты широкомасштабного исследования «Pain in Europe», в котором участвовали более 46 тыс. человек из 16 стран, каждый пятый (19%) из числа опрошенных взрослых европейцев страдает от ХБ (неонкологического генеза) в среднем в течение 7 лет, а 21% опрошенных ХБ беспокоила в течение 20 лет и более. Из числа всех респондентов 2/3 отмечали наличие умеренной и 1/3 – сильной боли (по 10-балльной шкале) [1].
По данным Российской ассоциации по изучению боли, распространенность хронического болевого синдрома (ХБС) в России варьируется от 13,8 до 56,7%, составляя в среднем 34,3 случая на 100 человек. Более 40% людей, страдающих ХБ, указывают на то, что болевые ощущения серьезно снижают качество их жизни [2].
Анализ современных российских научных публикаций показывает, что основным лекарственным средством (ЛС), рекомендуемым для терапии ХБС, обусловленного заболеваниями неопухолевой природы, в т.ч. и при обострении боли, остаются нестероидные противовоспалительные препараты (НПВП). Сегодня практикующие ревматологи и неврологи практически не назначают опиоидные анальгетики (ОА), что связано, по мнению авторов этих публикаций, с «громоздкой и неоправданно жесткой системой контроля за их медицинским использованием». Указывается, что «вся практика терапевтического лечения боли в России, по сути, держится на НПВП» [3].
Авторами данной статьи уже неоднократно указывалось [4, 5], что в настоящее время не существует никаких ограничений для назначения и выписывания слабого ОА трамадола, в т.ч. пациентам неонкологического профиля. Однако назначение сильных опиоидов и на сегодня остается серьезной проблемой.
В практической медицине последняя возникает прежде всего при оказании медицинской помощи пациентам с интенсивным ХБС, когда проведение мультимодальной неопиоидной анальгетической терапии с включением слабых опиоидов не дает желаемых результатов и необходимо использование сильных ОА, включенных в контролируемую группу наркотических средств (НС) и психотропных веществ (ПВ).
Многочисленные и разноплановые проблемы применения ОА с целью купирования ХБС в настоящее время рассматриваются не только российским медицинским сообществом, но и на других уровнях: от Государственной Думы и Правительства России до общественных организаций и общества в целом [4].
За последние несколько лет в России произошли существенные изменения нормативно-правовой базы, расширяющие права медицинских работников при назначении и выписывании НС и ПВ [6].
Начало этих изменений было положено приказом Минздрава России № 1175н от 20.12.2012, принципиальным отличием которого от предшествовавших является положение о назначении НС и ПВ пациентам с выраженным болевым синдромом любого генеза, т.е. основным фактором, определяющим тактику обезболивания, является не диагноз, а интенсивность боли. Другим имеющим принципиальное значение положением приказа следует считать возможность при назначении НС и ПВ отказа от проведения врачебной комиссии [6, 7].
С июля 2015 г. вступили в силу изменения, внесенные Федеральным законом от 31.12.2014 № 501-ФЗ «О внесении изменений в Федеральный закон № 3-ФЗ “О наркотических средствах и психотропных веществах”» (далее в тексте Федеральный закон № 3-ФЗ). Принципы государственной политики РФ в сфере оборота НС и ПВ, суммарно отражающие приоритетность мер по борьбе с незаконным их применением, были дополнены принципом доступности НС и ПВ гражданам, которым они необходимы в медицинских целях [6, 8]. Это дополнение, ведущее к изменениям в сфере медицинского оборота НС и ПВ, должно способствовать улучшению качества обезболивания у нуждающихся в этих ЛС пациентов.
Действительно, утвержденные в последнее время подзаконные акты, касающиеся хранения, перевозки, отпуска и других действий по обороту НС и ПВ, дают возможность улучшить обеспечение пациентов этой группой ЛС [5, 6, 9]. Однако Федеральным законом № 3-ФЗ определяются правила оборота НС и ПВ, т.е. действий, предусматривающих непосредственный контакт с НС, в то время как назначение наркотических лекарственных препаратов (работа с медицинской документацией) не входит в перечень действий по обороту НС и ПВ.
Важно отметить, что сведения, содержащиеся в медицинской документации, защищены законом о персональных данных, и лица, контролирующие оборот НС и ПВ, неправомочны оценивать обоснованность их назначения [10]. Кроме того, из действующей редакции Федерального закона № 3-ФЗ исключен пункт о работе в медицинских организациях комиссий по проверке целесообразности назначения НС и ПВ [11]. По мнению авторов, обоснованность назначения НС и ПВ обязательно должна контролироваться при проверке качества оказания медицинской помощи.
Необходимо подчеркнуть: чтобы врачи могли проводить адекватную анальгетическую терапию с использованием НС и ПВ, а также с целью осуществления контроля обоснованности их назначения в каждом конкретном случае, в нормативной базе должно быть сделано указание на необходимость применения НС и ПВ в медицинских целях при наличии соответствующих показаний. На сегодня имеются методические рекомендации по применению НС и ПВ, но в федеральных нормативных актах такое положение отсутствует.
Это положение должно было бы регламентироваться Федеральным законом № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации». Но и этим законом определено лишь право граждан на «облегчение боли, связанной с заболеванием и (или) медицинским вмешательством доступными методами или лекарственными препаратами» (Ст. 19; глава 4; пункт 5,4) [12]. Очевидно, что для обеспечения качественного обезболивания врач должен назначать ЛС, соответствующие интенсивности и характеру боли, а не препараты, доступные в настоящий момент (имеются в наличии в медицинских и/или аптечных организациях).
Ведущими российскими специалистами в области обезболивания (в первую очередь профессором Н.А. Осиповой) неоднократно вносились предложения о необходимости изменения вышеуказанной формулировки в Федеральным законе № 3 23-ФЗ, в т.ч. и на заседаниях рабочей группы Минздрава РФ «по подготовке предложений о внесении изменений в нормативные правовые акты в сфере оборота наркотических и психотропных лекарственных средств» [13].
По мнению авторов, право граждан на облегчение боли, связанной с заболеванием и/или медицинским вмешательством, должно реализовываться с использованием методов и лекарственных препаратов (в т.ч. ОА) в соответствии с интенсивностью боли, на основе базовых принципов купирования болевого синдрома.
Таким образом, предлагаемой формулировкой определялась бы стратегия лечения боли (обязательное назначение НС при интенсивной боли, не контролируемой мультимодальной неопиоидной терапией в сочетании со слабыми опиоидами1), а выбор сильных опиоидов (наркотических анальгетиков), необходимых для адекватного обезболивания, должен осуществляться в соответствии с тактикой, предлагаемой в данной статье.
Общеизвестно, что своевременно начатая адекватная анальгетическая терапия снижает риск формирования патологических ХБС [5, 15–18]. Следовательно, если назначенная неопиоидная анальгетическая терапия не дает должного эффекта и пациент продолжает испытывать боль, риск хронизации боли повышается. Даже когда проводимая неопиоидная терапия полностью патогенетически обоснована, ее недостаточная эффективность провоцирует формирование дополнительных патологических механизмов.
Поэтому очевидна необходимость своевременного начала анальгетической терапии. В отсутствие полноценного эффекта неопиоидной терапии целесообразно безотлагательное усиление терапии опиоидными препаратами.
В назначении НС при интенсивной ХБ нуждаются не только онкологические больные, но и пациенты с заболеваниями и состояниями неопухолевого генеза [1, 2, 19–21], когда основной задачей служит выбор оптимальных препаратов, снижающих риск хронизации боли.
По мнению авторов, выбор НС целесообразнее осуществлять не в соответствии с градацией «онкологический/неонкологический пациент», а в соответствии с прогнозом в отношении жизни, т.к. тактика применения НС пациентами любого профиля должна определяться не диагнозом, а прогнозом и динамикой состояния.
Так, у пациентов с неблагоприятным прогнозом в отношении жизни основной целью терапии является обеспечение постоянного «контроля боли»2. При назначении НС пациентам с благоприятным прогнозом тактика анальгетической терапии наряду с избавлением от боли и профилактикой ее хронизации должна включать и меры, предотвращающие развитие опиоидной толерантности.
Рост последней планомерно снижает эффект терапии, а закономерное при росте толерантности увеличение доз НС повышает риск их побочных эффектов [22–24].
Здесь необходимо отметить, что одной из задач плана мероприятий (дорожной карты) «Повышение доступности наркотических средств и психотропных веществ для использования в медицинских целях», утвержденного в 2016 г. Распоряжением Правительства РФ, является расширение номенклатуры НС, используемых для купирования ХБС, в частности регистрация таблетированной формы морфина короткого действия [25].
Этот препарат хорошо изучен и действительно долгое время считался «золотым» стандартом для базовой терапии интенсивной онкологической ХБ. На основании результатов исследований, проведенных учеными в разных странах [26–28], и собственного опыта полагаем, что в настоящее время нельзя считать короткодействующий морфин препаратом выбора для базовой терапии сильной ХБ.
Необходимо отметить, что как иностранные, так и отечественные авторы отмечают прямую связь между продолжительностью эффекта ОА и скоростью нарастания опиоидной толерантности и развитием гиперальгезии, которые формируются значительно быстрее при использовании НС короткого действия [22, 29–36].
В ряде публикаций указывается, что применение короткодействующих опиоидов (в. т.ч. в таблетированных формах) в отличие от ЛС с медленным высвобождением приводит к быстрому росту не только опиоидной толерантности, но и наркогенного потенциала [36–43].
Считаем, что короткодействующие ОА, в частности таблетки морфина короткого действия, должны применяться в течение непродолжительного времени для подбора дозы пролонгированных препаратов и при «прорывах боли» на фоне их применения3. Кроме того, вследствие увеличения доз короткодействующих опиоидов повышаются и затраты на их приобретение, что снижает экономическую целесообразность длительного применения морфина короткого действия.
Таким образом, выбор опиоидных препаратов для лечения ХБС, без сомнения, должен в первую очередь основываться на их соответствии интенсивности боли, но немаловажным при благоприятном прогнозе в отношении жизни пациента является выбор ЛС с минимальным наркогенным потенциалом.
Среди ОА, относящихся к Списку II [44] и чаще других применяемых в настоящее время на территории РФ, можно выделить следующие – морфин, фентанил и бупренорфин. Сравнивая указанные НС, необходимо отметить, что они в порядке снижения наркогенного потенциала и скорости роста опиоидной толерантности располагаются следующим образом: морфин→фентанил→бупренорфин [39, 45]. Следовательно, в отсутствие противопоказаний препараты на основе лекарственного средства морфин в стандартной ситуации должны применяться только пациентами с неблагоприятным прогнозом.
Здесь необходимо отметить, что за 1999–2010 гг. количество назначений ОА в США, по данным Отчета «Vital Sings» Центра по контролю и профилактике заболеваний США (CDC), увеличилось в 4 раза [46]. Вместе с тем на фоне увеличения числа назначений врачами ОА значительно возрос уровень смертности от их передозировки. Так, за 1999–2008 гг. число смертей, связанных с передозировкой НС, увеличилось с 4 до 15 тыс., и ежедневно умирают от передозировки НС более 40 американцев. Как отмечает директор CDC Thomas Frieden: «Применение данных препаратов в дозах, значительно превышающих терапевтические, приобрело угрожающие масштабы и становится причиной более высокого уровня смертности по сравнению со смертностью от передозировок героина и кокаина вместе взятых» [46].
Приведенные выше данные еще раз подчеркивают необходимость обоснованного назначения и тщательного выбора НС при проведении анальгетической терапии, что особенно важно при благоприятном прогнозе в отношении жизни пациента. Для пациентов с благоприятным прогнозом предпочтение следует отдавать препаратам на основе ЛС бупренорфин и фентанил. При этом необходимо понимать, что ЛС еще не есть лекарственный препарат и фармакологические свойства различных лекарственных форм, созданных на основе одного и того же ЛС, могут существенно различаться.
Например, в повседневной российской практике используется две лекарственные формы ЛС фентанил: ампулы для инъекций и трансдермальные терапевтические системы (ТТС). Если фентанил в виде ТТС – это один из опиоидных препаратов выбора для купирования интенсивной ХБ, то его инъекционная форма используется в основном в анестезиологической практике4.
Какие же характеристики инъекционных НС препятствуют их применению при проведении адекватной терапии ХБС?
Организационные проблемы проведения инвазивной опиоидной терапии по ряду причин значительно ухудшают качество жизни не только самих пациентов, но и их близких, а при рассмотрении фармакокинетических параметров необходимо отметить, что все инъекционные лекарственные формы НС характеризуются короткой продолжительностью анальгетического эффекта, быстрым ростом опиоидной толерантности и высоким реализующимся на пике концентрации наркогенным потенциалом, что значительно ограничивает пределы их эффективности и продолжительности применения [36, 37].
Разумеется, продолжительность анальгетического эффекта зависит и от самого ЛС, но у большинства инъекционных лекарственных форм ОА она не превышает 2–4 часов (бупренорфин до 6 часов), а период полувыведения инъекционного фентанила составляет всего 10–30 минут.
Таким образом, тактику выбора как самого ОА, так и его лекарственной формы должны определять следующие факторы:
- интенсивность боли (фактор, определяющий выбор ОА в соответствии с его анальгетическим потенциалом);
- прогноз в отношении жизни пациента;
- планируемая продолжительность применения ОА (чаще всего основывается на прогнозе в отношении жизни пациента).
Следовательно, препаратом выбора для базовой терапии сильной ХБС являются неинвазивные пролонгированные лекарственные формы НС. Их неоспоримое преимущество доказывается и в научных статьях, и в официальных методических рекомендациях [36–38, 47].
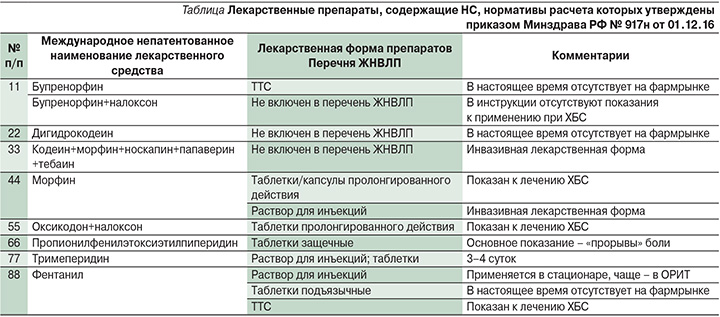
В настоящее время приказом Минздрава России № 917н (см. таблицу) утверждены нормативы расчета потребности в НС, предназначенных для медицинского применения как в амбулаторных условиях, так и в условиях стационара [48]. Для практической деятельности крайне важно наличие или отсутствие конкретных лекарственных форм в Перечне жизненно необходимых и важнейших лекарственных препаратов для медицинского применения (ЖНВЛП) [49].
Таким образом, в реальной практике список препаратов для терапии ХБС представлен следующими лекарственными формами НС: ТТС фентанила; таблетки/капсулы морфина сульфата пролонгированного действия; таблетки пролонгированного действия оксикодон+налоксон.
Если ТТС фентанила и таблетки/капсулы морфина сульфата пролонгированного действия достаточно хорошо известны российским специалистам, большинство из которых имеют многолетний опыт их применения, то таблетированный препарат пролонгированного действия оксикодон+налоксон является принципиально новым для России. В то же время включение этого препарата в приказ Минздрава РФ, утверждающий норматив расчета потребности в НС, требует ознакомления с его свойствами широкого круга медицинских работников.
Попытки улучшить лечебные свойства ОА проводятся издавна. Так, из опиумного алкалоида тебаина, который в чистом виде не используется из-за высокой токсичности (входит в состав омнопона), получены полусинтетические опиоиды бупренорфин и оксикодон, рекомендованный Европейской ассоциацией паллиативной помощи как альтернатива морфину [50]. При пероральном приеме 10 мг оксикодона эквивалентны 15–20 мг морфина сульфата.
Налоксон – «чистый» опиоидный антагонист, лишенный морфиноподобной активности. Действуя как конкурентный антагонист, он блокирует связывание морфина (морфиноподобных агонистов) с опиоидными рецепторами или вытесняет уже связанный ОА. Общеизвестен и применяется в виде раствора для инъекций как антидот при передозировке НС. Однако для приема внутрь не используется, т.к. быстро метаболизируется в печени.
В то же время конкурентный антагонизм налоксона при пероральном приеме позволяет уменьшить связывание морфиноподобных агонистов с опиоидными рецепторами кишечника.
Пероральный прием комбинации оксикодон+налоксон обеспечивает выраженный анальгетический эффект с одновременным снижением опиоидного торможения перистальтики кишечника, а пролонгированная лекарственная форма этой комбинации (Таргин) реализует все преимущества лекарственных анальгетиков с медленным высвобождением.
Рассматривая проблемы выбора НС в масштабе страны, целесообразно привести цитату из исследования аналитической компании Frost & Sullivan «Анализ продуктов и производственного процесса на рынке ОА»: «В связи с ростом числа смертей от злоупотребления опиоидами в США и Европе и недовольством общественности многие регуляторные органы вынуждены были утвердить только препараты, защищенные от ненадлежащего применения...»5–6.
С этой точки зрения комбинация ОА с конкурентным антагонистом опиоидных рецепторов (налоксоном) является, кроме того, и защищенной от немедицинского применения. Действительно, при нецелевом применении – парентеральном введении кустарно приготовленного раствора Таргина–налоксон, действующего уже через 1–3 минуты, блокирует воздействие оксикодона на опиоидные рецепторы ЦНС, исключая развитие центрального опиоидного эффекта как самой цели немедицинского использования.
Заключение
Врачам и организатором здравоохранения необходимо помнить, что боль нельзя терпеть и если патогенетически обоснованная неопиоидная терапия ХБ неэффективна, врач обязан назначать ОА, при этом руководствуясь следующими правилами:
- Все ОА должны назначаться на фоне продолжающейся патогенетически обоснованной анальгетической терапии неопиоидными препаратами (с учетом их совместимости).
- Оптимально назначение неинвазивных лекарственных форм.
- В терапии ХБ препаратом выбора являются пролонгированные лекарственные формы. Коротко-действующие опиоидные препараты должны назначаться только коротким курсом с учетом ограничений, имеющихся для каждого конкретного препарата (или разово, при «прорыве боли»).
- В основе выбора ОА для лечения ХБС лежит в первую очередь их соответствие интенсивности боли, но немаловажным фактором выбора является и прогноз в отношении жизни пациента. При благоприятном прогнозе особенно важен выбор ЛС с минимальным наркогенным потенциалом.
Кроме того, необходимо подчеркнуть следующие моменты:
Правовое регулирование деятельности в сфере оборота НС, ПВ и их прекурсоров, а также в области противодействия их незаконному обороту осуществляют в пределах своей компетенции федеральные органы государственной власти. Но организационная доступность НС и ПВ обусловлена не только федеральными нормативно-правовыми актами, но и качеством исполнения этих нормативно-правовых актов на местах.
Перечень зарегистрированных (и регистрируемых) в России НС способен обеспечить проведение адекватной анальгетической терапии в нашей стране, однако недостаточное знание врачами и организаторами здравоохранения на всех уровнях нормативно-правовых актов, с одной стороны, и фармакологических особенностей применения ОА, с другой, значительно снижают качество анальгетической терапии.
В связи с этим необходимо проведение целевых образовательных курсов, посвященных изучению всех вышеуказанных проблем, не только для врачей лечебных специальностей, но и для провизоров, и для организаторов здравоохранения во всех регионах с дальнейшим повышением их персональной ответственности за некачественное решение проблем организации обеспечения пациентов.
Проведение таких образовательных курсов необходимо и для контролирующих органов, в частности для работников территориальных органов Росздравнадзора, т.к. контролировать качество организации обеспечения и проведения терапии НС и ПВ возможно только на высокопрофессиональном уровне.
Организация адекватной анальгетической терапии в России вовсе не должна сводиться только к увеличению объема применяемых НС. Масштабы роста немедицинского применения опиоидных лекарственных препаратов, имеющие место, например, в США, обязывают крайне осторожно относиться к выбору препаратов, рекомендуемых к использованию. А рост смертности населения в ряде стран от передозировки назначаемых врачами НС, квалифицируемый сегодня специалистами этих стран как эпидемия, предостерегает нас от возможных ошибок в выборе оптимальных ОА (с учетом не только самого ЛС, но и его лекарственной формы).
Таким образом, для улучшения качества анальгетической терапии в нашей стране повышение уровня применения НС крайне необходимо, но за счет препаратов, обладающих относительно невысоким наркогенным потенциалом и относительно низким риском их немедицинского использования.


