Введение
Анемия устанавливается при концентрации гемоглобина менее 120 г/л у небеременных женщин и менее 130 г/л у мужчин. По данным Всемирной организации здравоохранения, анемией страдают 2 млрд жителей Земли, 80–90% этих состояний связано с дефицитом железа (железодефицитные синдромы), а более половины является железодефицитной анемией (ЖДА).
В России, по данным Минздрава, анемией страдают 15% населения [1, 2].
Для лечения ЖДА назначают препараты, содержащие железо: органические соли (например, фумарат железа и др.), неорганические соли (например, сульфат железа, т.н. железный купорос), полимальтозные комплексы с гидроксидами железа и др. В то же время за последние десятилетия сложилась практика долговременного приема (месяцы и годы) многокомпонентных комплексов микронутриентов, содержащих сульфат железа. Можно сказать, что ЖДА настолько напугала врачей, что возникла своего рода мания поголовного назначения комплексов микронутриентов (как правило, содержащих сульфат железа) с целью профилактики несуществующей ЖДА [3, 4].
Однако из клинической практики хорошо известно, что железосодержащие (сульфат железа) препараты могут вызывать различные побочные эффекты – запоры или, наоборот, диарею, боли в эпигастрии, тошноту, рвоту, иногда нарушение функции печени [5].
Двухвалентное железо (Fe2+) в составе сульфата железа легко окисляется до прооксидантного трехвалентного железа (Fe3+), которое, распространяясь по организму, способствует усиленному формированию гемосидероза (т.е. нефизиологических и нерастворимых отложений окислов железа в тканях, т.н. гемосидерина) [6].
Гемосидероз поражает органы в следующей последовательности: печень, миокард, скелетная мускулатура, почки, мозг, органы зрения, суставы [7]. Таким образом, печень страдает от гемосидероза в первую очередь. В норме печень – это депо железа, в котором оно сохраняется в форме плотно упакованных ферритиновых гранул, исключающих контакт ионов Fe2+ с окисляющими агентами и c мембранами гепатоцитов.
При использовании неорганических форм железа ионы Fe2+ окисляются до Fe3+ с образованием гемосидерина – темно-желтого пигмента, включающего смесь окислов железа с денатурированными белками. Денатурированные белки активируют аутоиммунные реакции, что наряду с прооксидантными свойствами трехвалентного железа поддерживает хроническое воспаление, вызывает повреждения паренхимы печени и замещение ее дисфункциональной фиброзной тканью. Чрезмерное накопление железа в печени в форме гемосидерина существенно замедляет процесс регенерации печени, что провоцирует развитие цирроза печени и поражение других органов (сердца, почек, мозга и др.).
Целью настоящего исследования явилась сравнительная оценка развития хронической перегрузки железом при длительном применении препаратов на основе сульфата железа и полимальтозного комплекса железа.
Материал и методы
Исследование было проведено на 30 белых крысах массой 200–250 г, разделенных на 3 группы. Группа 1 (n=10) служила интактным контролем. Группа 2 (n=10) получала сульфат железа в составе сиропа актиферрин, который был выбран для удобства зондирования. Сироп вводился в желудок через зонд в дозе 0,6 мл/кг. Группа 3 (n=10) получала железа (III) гидроксид полимальтозат в виде сиропа в дозе 0,5 мл/кг в желудок через зонд. Препараты железа вводили ежедневно в течение 2 месяцев.
Через 2 месяца после введения препаратов животных помещали на сутки в обменные клетки для определения выделительной функции почек, после чего гильотинировали. В день 0 и в день 60 в крови определяли активность аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), уровни билирубина, общего белка и креатинина, в моче – концентрацию белка (с помощью стандартных наборов). В день 61 производили забор печени, почек и головного мозга на гистологическое исследование, в патогистологической лаборатории определяли железо в ткани с помощью реакции берлинской лазури. После краниотомии головной мозг извлекался целиком, печень и почки также эвисцерировались целиком.
Для гистологических анализов все органы фиксировали в 10%-ном растворе нейтрального формалина. Проводка тканей осуществлялась по стандартной схеме (обезвоживание в этиловом спирте, ксилоле) с последующим изготовлением парафиновых блоков. Изготовленные на микротоме «Microm» гистологические срезы толщиной 6 мкм окрашивали гематоксилином и эозином. Дубликаты срезов с помощью набора реактивов компании «Биовитрум» окрашивали по Перлсу для выявления в тканях трехвалентного железа. Результатом проведенной реакции стало образование нерастворимой окрашенной соли железа, т.н. берлинской лазури (4Fe³+3K4Fe(CN)6 →Fe4(Fe(CN)6)3). Морфологическое исследование гистологических срезов проводили на анализаторе изображения «BioVision» (Австрия), микрофотографии получены с помощью исследовательского микроскопа «Micros МС 200» и цифровой окулярной камеры DCM 900. Статистическую обработку полученных данных проводили с использованием программы Statistica 6. Различия между группами считали статистически значимыми при p<0,05. Данные в таблице представлены в виде M±m.
Результаты исследования
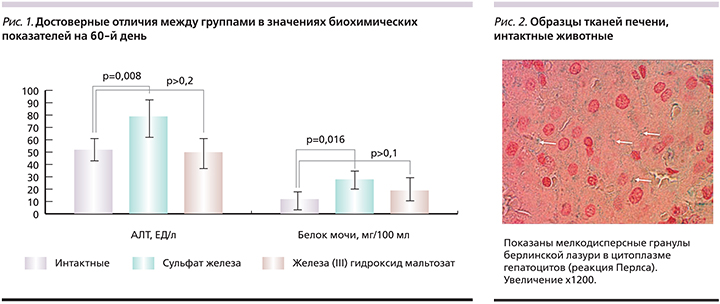
На день 0 между группами не было установлено различий во всех исследованных биохимических показателях. Проведенное на день 60 биохимическое исследование крови показало, что длительное применение сульфата железа оказывает повреждающее действие на гепатоциты, что подтверждается достоверным повышением активности АЛТ (см. таблицу, рис. 1), тогда как применение полимальтозного комплекса железа не повышало уровня АЛТ.
Кроме того, на фоне приема сульфата железа изменялась и функция почек: наблюдалось некоторое повышение диуреза при применении железа (III) гидроксид полимальтозат (носящее, возможно, компенсаторный характер – для ускорения выведения солей железа), а также протеинурия, которая при применении актиферрина была статистически значимой. Таким образом, применение сульфата железа было ассоциировано с нарушениями функции печени.
Гистологическое исследование секционного материала (печени, почек, головного мозга) подтвердило результаты биохимических исследований и показало существенные повреждения паренхимы печени на фоне гемосидероза.
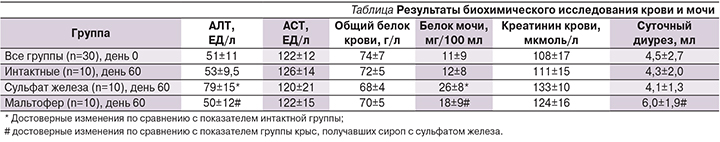
Гистологическое исследование тканей интактных животных показало, что в головном мозге и в почках при проведении реакции Перлса образования берлинской лазури не наблюдалось. Гистологическое исследование ткани печени показало, что во всех 10 образцах цитоплазма гепатоцитов содержала равномерно распределенные мелкодисперсные железосодержащие гранулы, что, вероятнее всего, объясняется нормальным метаболизмом гепатоцитов с образованием трансферрина (рис. 2).
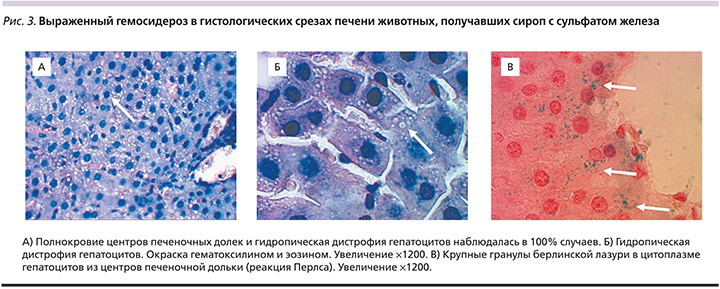
 У 10 из 10 животных, получавших сульфат железа, обнаружены выраженные патогистологические изменения тканей печени. Несмотря на полнокровие центральных вен и синусоидов, прецентральной зоны печеночных долек, гепатоциты находились в состоянии умеренно выраженной гидропической (вакуольной) дистрофии (рис. 3А, 3Б). Проведение реакции Перлса позволило выявить крупные включения кристаллов берлинской лазури в паренхиме и частично в цитоплазме гепатоцитов, расположенных близи центральной вены (рис. 3В).
У 10 из 10 животных, получавших сульфат железа, обнаружены выраженные патогистологические изменения тканей печени. Несмотря на полнокровие центральных вен и синусоидов, прецентральной зоны печеночных долек, гепатоциты находились в состоянии умеренно выраженной гидропической (вакуольной) дистрофии (рис. 3А, 3Б). Проведение реакции Перлса позволило выявить крупные включения кристаллов берлинской лазури в паренхиме и частично в цитоплазме гепатоцитов, расположенных близи центральной вены (рис. 3В).
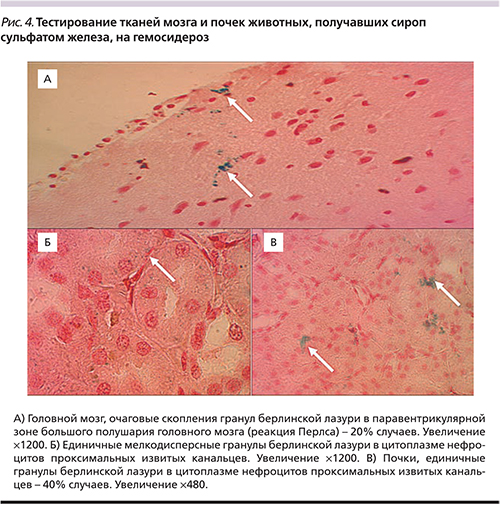
У животных, получавших сульфат железа, исследование головного мозга с помощью реакции Перлса выявило очаговое образование берлинской лазури в субэпендимарном отделе (паравентрикулярной зоне) левого полушария большого мозга (рис. 4А). В почках 2 из 10 животных реакция Перлса дала слабоположительный результат, который выражался образованием мелкодисперсных гранул берлинской лазури в цитоплазме нефроцитов проксимальных извитых канальцев (рис. 4Б и 4В).
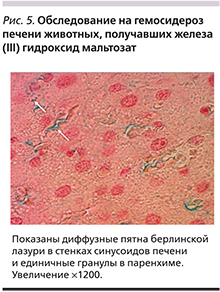
Патогистологические изменения печени у крыс, получавших железа (III) гидроксид полимальтозат в максимальной дозе, характеризовались очаговой вакуольной дистрофией гепатоцитов центральной зоны печеночной дольки. Реакция Перлса оказалась слабоположительной и выражалась прокрашиванием берлинской лазурью стенок внутридольковых синусоидных кровеносных капилляров (диффузные пятна берлинской лазури), единичными мелкими гранулами берлинской лазури в паренхиме (рис. 5). При исследовании с помощью реакции Перлса головного мозга и почек крыс, получавших железа (III) гидроксид полимальтозат, образования берлинской лазури не наблюдалось ни у одного из животных.
Таким образом, гистологическое исследование показало, что длительное (в течение 2 месяцев) применение сульфата железа приводило к выраженному гемосидерозу паренхимы печени, мозга и почек. Выраженный гемосидероз паренхимы печени при длительном применении сульфата железа сопровождался более заметными дистрофическими изменениями гепатоцитов. При приеме железа (III) гидроксид полимальтозат отмечалось весьма низкое отложение гемосидерина в печени, меньшая степень повреждения печени (более низкие значения уровня АЛТ) и почек (менее выраженная протеинурия), что подтверждает низкую токсичность полимальтозных комплексов [10].
Заключение
Вследствие обширного круга биологических ролей железа дефицит железа в организме должен обязательно быть скомпенсирован. К сожалению, в настоящее время в научно-медицинской среде преобладают две радикальные позиции, которые условно можно назвать «ультраправой» и «ультралевой».
«Ультралевая» позиция, представленная преимущественно в западной литературе, апеллирует к полному отказу от назначения любых железосодержащих препаратов, т.к. «железо перегружает организм и укорачивает длительность жизни» и вообще – «железа достаточно в продуктах». При этом не делается никаких различий между фармакологическими формами железа. Такой «ультралевый» подход порождает массовые фобии по отношению к препаратам железа и, естественно, способствует широчайшему распространению ЖДА, особенно среди беременных, детей и пожилых пациентов.
Например, в медицинской прессе можно даже встретить прямо-таки экстремистские предложения о необходимости «полного истощения железа для первичной профилактики сердечно-сосудистых заболеваний у пожилых пациентов» [9]. Удивительно, насколько часто могут забываться фундаментальные положения кардиологии и неврологии о том, что «ишемия – это недостаток кислорода»…
«Ультраправая» позиция состоит в запугивании дефицитом железа до такой степени, что проводится повсеместное долговременное «профилактическое» назначение препаратов железа (опять же без учета различий между фармакологическими формами железа). В результате такой «профилактики», особенно с использованием довольно токсичного сульфата железа, происходит реальная «перегрузка» организма железом, т.е. формирование гемосидероза в различных тканях организма.
Настоящее исследование показывает несостоятельность именно этой «ультраправой» позиции и подчеркивает важность учета различий между фармакологическими формами препаратов железа. Использование такой устаревшей фармакологической формы железа, как сульфат железа, обязательно приводит к отложению гемосидерина в гепатоцитах по ходу синусоидных капилляров, п также к дистрофическим изменениям гепатоцитов. Повреждение сульфатом железа паренхимы печени подтверждается повышением уровня печеночного фермента АЛТ в крови.
В ряде случаев гемосидероз печени сопровождается системным гемосидерозом, затрагивающим паренхиму почек, головного мозга и др. Полимальтозная форма железа при использовании даже в максимальных дозах и при длительном применении имеет преимущество в плане безопасности: не отмечено повреждения гепатоцитов, нарушений функции печени, отсутствует гемосидероз в мозге и в почках, таким образом, препарат обладает благоприятным профилем безопасности для различных категорий пациентов.


