Внастоящее время неалкогольная жировая болезнь печени (НАЖБП) считается одним из основных факторов риска сердечно-сосудистых заболеваний. Печень играет важную роль в развитии атерогенной дислипидемии [1, 2, 4]. При прогрессировании ожирения увеличивается поступление в печень свободных жирных кислот [3, 4, 9, 13], в результате происходит усиление процессов перекисного окисления липидов – ПОЛ [2, 5–7, 15, 17]. Воздействие токсических форм кислорода на ненасыщенные жирные кислоты (фосфолипидов, триглицеридов, эфиров холестерина) ведет к их разрушению и появлению таких токсичных альдегидов, как малоновый диальдегид (МДА). Накопление перекисей липидов в тканях сопровождается разрушением молекулярной структуры мембран. Фосфолипиды являются важнейшими компонентами клеточных мембран и пред-ставлены в основном фосфатидилхолинами. Фосфолипидный состав определяет жидкокристаллические свойства и проницаемость мембран [8, 16]. Мембраны обеспечивают нормальную работу белков-транспортеров, ферментов, катализирующих процессы окисления, клеточного дыхания, окислительного фосфорилирования. При НАЖБП наблюдается снижение содержания фосфатидилхолина в гепатоцитах [9 14]. Фосфатидилхолин синтезируется в гепатоцитах при достаточном уровне холина. Интенсификация процессов ПОЛ зависит от степени повреждения мембран гепатоцитов. Накопление ПОЛ в гепатоцитах играет большую роль в нарушении их ультраструктуры. Перекисный и фосфолипазный механизмы повреждения липидов тесно связаны. Липопротеин-ассоциированная фосфолипаза А2 (ФЛА2) связана в плазме с атерогенными частицами липопротеидов низкой плотности (ЛПНП), является высокоспецифичным маркером васкулярного воспаления [6, 7, 10]. Повышенный уровень ФЛА2 в сыворотке крови указывает на наличие бляшки, склонной к разрыву, и является независимым фактором риска сердечно-сосудистых заболеваний, в т.ч. коронарного атеросклероза, инфаркта миокарда и инсульта [11, 12, 18].
Свободнорадикальные реакции ПОЛ протекают во всех клетках и тканях живых организмов, в основном в биомембранах, и представляют собой каскад окислительных реакций деградации ненасыщенных жирных кислот, входящих в состав фосфолипидов.
В клетках здорового организма уровень ПОЛ является жизненно важным звеном в регуляции проницаемости и транспорта веществ через мембраны, в синтезе простагландинов, метаболизме стероидных гормонов и других клеточных механизмах [15]. Окислительные реакции с участием свободных радикалов рассматриваются в настоящее время как необ-ходимый процесс в регуляции клеточного метаболизма. Особо большое значение ПОЛ для организма заключается в обновлении мембран клеток. При нарушении структуры и функции клеточной мембраны изменяется концентрация ионов по обе стороны мембраны, повреждаются функции сигнальных и транспортных систем. Это приводит к развитию инсулинорезистентности. Полиненасыщенные жирные кислоты (ПНЖК) являются субстратом для синтеза простагландинов. Избыток кальция активирует фосфолипазу А2, что отражается на структуре фосфолипидов, в митохондриях уменьшается содержание фосфатидилхолина и фосфатидилэтаноламина.
При активации фосфолипаз из фосфолипидов высвобождаются ПНЖК и легко окисляются. Окисление ПНЖК с образованием эндоперекисей может происходить в процессе ПОЛ, необходимом для синтеза лейкотриенов, регуляции липидного состава мембран, метаболизма катехоламинов и фагоцитоза. Стационарный уровень протекания ПОЛ регулируется антиоксидантной системой, которая ограничивает образование липидных радикалов. Супероксиддисмутаза, каталаза и глутатионзависимые ферменты сохраняют клетки от окислительного стресса. Активность ферментов антиоксидантной защиты снижается при воспалении, а активация фосфолипазы увеличивается [5, 16]. Ингибировать глутатионзависимые ферменты могут продукты фосфолипазного гидролиза – свободные жирные кислоты. Важную роль в антиоксидантной защите организма играют пептиды, в состав которых входят SH-содержащие аминокислоты: цистеин, цистин и метионин. Особое место занимает глутатион, образованный аминокислотами цистеином, глицином и глутаминовой кислотой. SH-содержащие соединения защищают клетки от повреждающего действия свободных радикалов. Дефицит холина и метионина способствует угнетению фермента стеаторил-коэнзим А-десатураза-1 (SCD-1), который катализирует десатурацию пальмитиновой и стеариновой кислот, регулирует запасы триглицеридов в клетке и проявляет защитное действие на клетки печени. Низкая активность SCD-1 усугубляет тяжесть течения стеатогепатита [17].
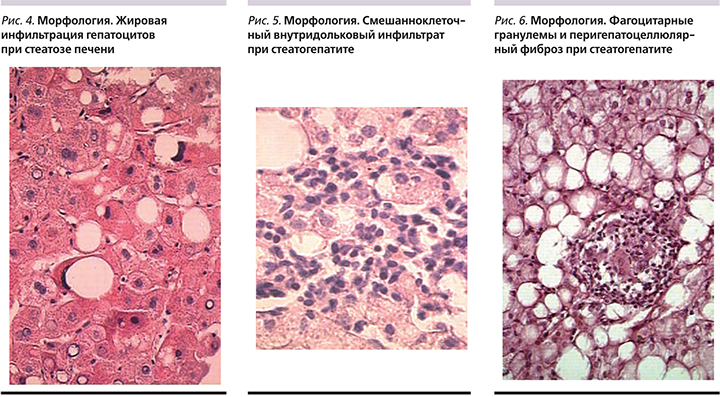
При стеатогепатите морфологические изменения характеризуются формированием гигантских митохондрий, что ведет к апоптозу клеток. Воспалительная реакция представ-лена внутридольковыми инфильтратами на фоне жировой дистрофии гепатоцитов. Также наблюдаются жировые кисты, «пустые» ядра гепатоцитов, липогранулемы [5].
Воспалительная реакция начинается с эндотелия. При воспалении, гипоксии, эндотоксиновой агрессии происходит нарушение функции эндотелия. Макрофаги под действием эндотоксина (Эт) выделяют NO, который легко проникает в клетки и взаимодействует с ферментами и белками. NO ингибирует калий-натрий-АТФазу, тем самым снижается чувствительность к инсулину, ингибируются митохондриальные ферменты, цитохром-Р450, который метаболизирует жирные кислоты и холестерин; происходит накопление свободных жирных кислот в клетках печени.
В условиях гипергликемии усиливаются процессы ПОЛ, что может индуцировать апоптоз за счет активации ядерного фактора транскрипции, повышающего экспрессию индуцибельной синтазы NO. Влияние липополисахаридов и других медиаторов воспаления на функцию печени вызывает экспрессию синтеза фосфолипазы А2 и усиление жировой инфильтрации печени. Усиление гепатоцитами и клетками эндотелия синтеза ФЛА2 формирует воспалительный процесс.
ФЛА2 гидролизует фосфолипиды в ЛПВП и ЛПНП в кровотоке. В результате гидролиза образуется лизофосфатидилхолин (лизо-ФХ) – активный провоспалительный липид, который стимулирует образование активных форм кислорода нейтрофилами, клетками эндотелия и макрофагами в интиме артерий. Лизо-ФХ также изменяет активность синтазы NO и количество синтезируемого NO.
Лизо-ФХ играет ключевую роль в атерогенезе, являясь цитотоксичным к клеткам сосудов, резко изменяет текучесть мембран, способствует высвобождению медиаторов воспаления, также изменяет активность синтазы NO и количество синтезируемого NO.
Происходит нарушение эндотелийзависимой вазодилатации за счет снижения биодоступности NO для гладкомышечных клеток артериол [14]. Липолитический фермент ФЛА2 проявляет свою активность в клетках печени. Особое значение имеет фосфолипазная активность митохондрий, которая играет ведущую роль в развитии некротических изменений в клетке.

Цель настоящего исследования – определить уровень МДА у больных НАЖБП в сыворотке крови и его связь с повреждением мембран гепатоцитов в зависимости от морфологической картины заболевания. Выявить взаимосвязь перекисного и фосфолипазного механизмов повреждения мембран гепатоцитов с другими маркерами воспаления, Эт и оксидом азота (NO).
Материал и методы
Обследованы 80 больных НАЖБП (59 женщин и 21 мужчина). Средний возраст составил 53,5±9,5 года. Индекс массы тела (ИМТ) – более 30 кг/м2. Диагноз был верифицирован с помощью клинических, биохимических, инструментальных и морфологических методов исследования. Основные морфологические изменения у обследованных больных характеризовались крупнокапельной жировой дистрофией гепатоцитов (рис. 4–6). При анализе биохимических показателей в 40% случаев отмечено повышение уровней аминотрансфераз и γ-глутамилтранспептидазы в 2–3 раза. Показатели липидного спектра обсле-дуемых больных характеризовались повышением уровней общего холестерина, ЛПНП, триглицеридов и снижением уровня липопротеидов высокой плотности (ЛПВП).
Содержание ФЛА2 определяли иммуноферментным методом с помощью диагностических наборов PLAC TEST Elisa Kit (CША). Метод позволяет проводить измерение содержания белка секретируемой ФЛА2 при использовании высокоспецифичных моноклональных антител. ПОЛ определяли по содержанию МДА с тиобарбитуровой кислотой [13]. Для определения Эт применяли хромогенный метод по конечной точке с использованием ЛАЛ-теста (Limulus amebocyte lysate, США). Уровень метаболитов NO определяли скрининг-методом в биологических жидкостях как маркер дисфункции эндотелия с хлоридом ванадия (Германия) [11, 14]. Статистическую обработку данных провели с использованием программ «Биостат» и «Статистика».
Результаты исследования и их обсуждение
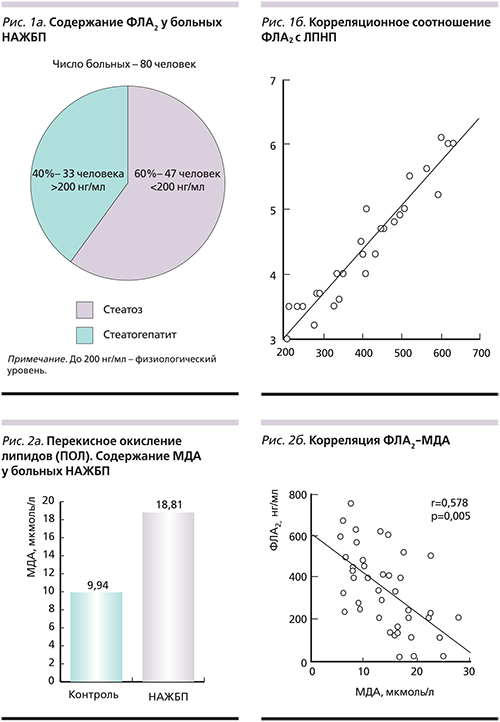
Верхней границей физиологического уровня принято считать 200 нг/мл. У 33 (40%) больных НАЖБП в стадии стеатогепатита (НАСГ – неалкогольный стеатогепатит) содержание ФЛА2 было повышено в 3,8 раза (медиана – 199,7–528,2 нг/мл) и составило 493,6±81,93 нг/мл, из них у 22 больных с высоким риском сердечно-сосудистых осложнений (медиана – 324,3–764,4) составило в среднем 488,9±25,86 нг/мл (рис. 1а).
При попадании в кровоток ФЛА2 связывается и транспортируется с ЛПНП, отмечена тесная корреляционная связь ФЛА2 с ЛПНП (r=0,957; р<0,001; рис. 1б). Ниже физиологического уровня было отмечено содержание ФЛА2 у 47 (60%) больных, в среднем 129,7±6,22 нг/мл. Активность фермента в плазме и тканях регулируется индукцией цитокинов и бактериальных токсинов и коррелирует со степенью развития патологических процессов при различных заболеваниях.
У 65 больных НАЖБП в стадии НАСГ в сыворотке крови было определено содержание МДА и ФЛА2. Содержание МДА у этих больных было увеличено в 2 раза и составило в среднем 18,81±1,24, в контроле – 9,94±1,62 мкмоль/л (рис. 2а).
Отмечен высокий уровень ФЛА2 (640 нг/мл) и МДА (15,98 мкмоль/л) у 26 больных НАСГ (рис. 3а, 3б) и низкий уровень ФЛА2 при нормальном содержании МДА у остальных больных (рис. 3в). НАЖБП и МДА находились в отрицательной корреляционной зависимости, коэффициент – 0,578 (рис. 2б).
При чрезмерном накоплении липидов в гепатоцитах усиливаются процессы ПОЛ, что ведет к некрозу гепатоцитов, нарушению функций митохондрий, постепенному развитию фиброза печени и формированию стеатогепатита.
Сравнительный анализ содержания стабильных метаболитов NO в сыворотке крови больных пациентов контрольной группы показал, что воспалительный процесс в группе стеатогепатита достоверно сопровождался повышенной продукцией NO. Уровень метаболитов возрастал параллельно концентрации аминотрансфераз. Отмечена корреляционная зависимость между NO и аланиаминотрансаминазой (АЛТ) (r=0,86; р=0,001). Уровень ФЛА2 возрастал при воспалении у больных НАСГ и коррелировал с уровнем NO (r=0,62; р=0,001).
У пациентов с висцеральным ожирением и инсулинорезистентностью усиление оксидативного стресса приводит к инактивации NO за счет накопления реактивных кислородных радикалов. Нарушается равновесие в системе NO в сторону увеличения концентрации сосудосуживающих факторов и снижения биодоступности NO. Повреждение эндотелия сосудов усугубляется воздействием окисленных форм ЛПНП.
Содержание Эт в сыворотке крови было повышено у больных НАСГ по сравнению с контролем и больными стеатозом печени. При попадании липополисахаридов в системный кровоток он связывается с белком и запускает каскад иммунных реакций. Эндотоксемия определяется как циркуляция в крови бактериальных Эт в концентрации выше 2,5 ЕЭ [8, 9]. Отмечена корреляционная связь между содержанием Эт и NO (r=0,62; р=0,001). Повышение уровней Эт и NO выявлено при прогрессировании воспалительной инфильтрации в печени, что доказывает участие маркеров воспаления в патогенезе НАЖБП.
При НАЖБП содержание маркеров воспаления было повышено при воспалительной стадии перехода стеатоза к стеатогепатиту параллельно повышению уровней печеночных ферментов и морфологической картине воспалительной инфильтрации в печени.
В настоящее время для больных НАЖБП используют препараты, сочетающие антиоксидантную защиту, стабилизацию мембран гепатоцитов, противовоспалительную терапию [8].
1. Гепатопротекторы (эссенциальные фосфолипиды, урсодезоксихолевая кислота, препараты липоевой кислоты, орнитин, таурин).
2. Антиоксиданты (витамин+ретинол, омега-3 триглицериды, Липостабил и др.).
3. Антибактериальные препараты (санация толстой кишки рифаксимин, метронидазол, макролиды и др.).
4. Пре- и пробиотики (Бифи-думбактерин, Лактумбактерин, Споробактерин бифиформкомплекс).
Результатом восстановления энтерогепатической циркуляции желчных кислот является нормализация процессов синтеза желчи в печени и адекватного поступления ее в кишечник [24].
Выводы
Выявлена связь между маркерами воспаления (ФЛА2, NO, Эт, МДА), морфологической картиной печени и активностью печеночных ферментов. Активность ФЛА2 при НАСГ у 40% больных была увеличена в 3,8 раза по сравнению с таковой в контрольной группе и у больных стеатозом, что сопровождалось повышением активности печеночных ферментов и тяжестью морфологических изменений.
При НАЖБП развивается недостаточность антиоксидантной системы в результате активации процессов ПОЛ. Содержание МДА в сыворотке крови было увеличено в 2 раза у больных НАЖБП при стеатогепатите в 30% случаев. Активность ФЛА2 и уровень МДА находились в корреляционной зависимости (r=-578).
Повышение уровней Эт, NO и активность ФЛА2 отмечались при прогрессировании воспалительной инфильтрации в печени.



