Ротавирусная инфекция (РВИ) характеризуется мировым распространением с развитием интенсивного эпидемического процесса – от регистрации спорадических случаев до вспышечной заболеваемости [1]. Высокий уровень заболеваемости поддерживается устойчивостью возбудителя к факторам окружающей среды, высокой контагиозностью, множеством путей передачи инфекции, широкой распространенностью бессимптомного вирусоносительства среди детей и взрослых, в т.ч. в постинфекционный период [2, 3].
Известно, что ротавирус (РВ) является ведущей причиной гастроэнтеритов у детей в возрасте до 5 лет в странах как с низким, так и с высоким уровнем экономического развития. При этом каждый ребенок до 5 лет успевает перенести от двух до пяти и даже более эпизодов заболевания с широким спектром клинических проявлений – от бессимптомного носительства и легких форм до развития тяжелых, осложненных вариантов болезни [4–6]. Разницу составляет лишь высокий уровень смертности от РВИ, наиболее характерный для развивающихся государств и достигающий почти 82% от всех смертельных случаев на планете. По данным Всемирной организации здравоохранения (ВОЗ), в довакцинальный период от тяжелых гастроэнтеритов ротавирусной этиологии ежегодно погибали до 527 тыс. человек, из них 440 тыс. детей младше пяти лет [7].
РВИ является одной из основных причин внутрибольничного инфицирования, особенно среди новорожденных и больных раннего возраста, составляя в разные сезоны от 31 до 87%. Внутрибольничному инфицированию способствуют длительность пребывания больных в стационаре, скученность в палатах; существенную роль в передаче инфекции играет медицинский персонал учреждений [8–10].
Учитывая повсеместное распространение РВИ, ее высокую контагиозность с преимуществом поражения детей раннего возраста, отсутствие средств этиотропной терапии, недостаточную эффективность неспецифических мер профилактики, единственным наиболее эффективным методом контроля заболеваемости на современном этапе признается вакцинация [9]. ВОЗ настоятельно предлагает включить вакцинацию против РВИ в национальные программы иммунизации всех стран мира с максимальным охватом вакцинируемых. Только универсальная массовая вакцинация может привести к снижению заболеваемости, вакцинация групп риска не несет значительной пользы для здравоохранения.
Согласно рекомендациям ВОЗ и Европейского общества по инфекционным болезням у детей (ESPID), введение первой дозы ротавирусной вакцины должно происходить как можно раньше (до достижения ребенком 6-недельного возраста) одновременно с вакцинами против дифтерии, коклюша и столбняка (АКДС), индуцируя защиту от естественного инфицирования, тем самым предотвращая развитие тяжелых форм и осложнений у здоровых детей [10, 11].
Существующие в настоящее время вакцины представляют собой препараты для приема внутрь, содержащие живые аттенуированные штаммы РВ человеческого или животного происхождения, репликация которых происходит в тонком кишечнике человека. На международном рынке используются две пероральные ротавирусные вакцины – моновалентная (RV1) Ротарикс (Rotarix; GlaxoSmithKline Biologicals, Rixensart, Бельгия) и пентавалентная (RV5) РотаТек (RotaTeq; Merck& Co. Inc,, West Point, РА, США).
В мировой практике накоплен большой опыт применения пентавалетной ротавирусной вакцины (ПВРВВ), подтверждена ее иммунологическая и клиническая эффективность [12–14]. При этом вакцинация не только приводит к снижению уровня заболеваемости РВИ в целом, но и защищает от тяжелых форм заболевания, что неоднократно доказано в ходе многочисленных клинических исследований. Согласно данным американских ученых, после начала массовой иммунизации против РВИ эффективность ПВРВВ в профилактике ротавирусного гастроэнтерита (РВГЭ) любой тяжести составила 68–75%, а в отношении тяжелой формы – 100% Уровень госпитализации пациентов с тяжелыми и среднетяжелыми формами РВГЭ также снизился на 86% [12].
В европейских странах вакцинация против РВИ снизила частоту тяжелых форм РВГЭ на 81–100%, РВИ любой тяжести – на 68–87%. Частота обращений детей раннего возраста в отделения неотложной помощи снизилась на 94%, госпитализации – на 96%, обращений в поликлиники – на 86%. Исследование случай–контроль показало, что введение трех доз ПВРВВ дает защиту от РВГЭ в 100% случаев, двух доз – в 81%, одной дозы в 69% случаев [13].
Необходимо отметить, что достижение широкого охвата вакцинацией способствует снижению заболеваемости не только в группах вакцинируемых, но и у детей более старшего возраста, не подлежащих вакцинации, и даже среди взрослого населения на 48,4%, что свидетельствует о развитии популяционного иммунитета [14, 15].
 Накопленные данные о безопасности и эффективности вакцинации послужили основанием для разработки экспертами ВОЗ совместно с ЮНИСЕФ Комплексного глобального плана действий по профилактике и контролю инфекционных заболеваний, одной из целей которого является максимальное снижение детской смертности от диареи до 2025 г., что возможно при обеспечении всеобщего охвата иммунизацией против РВИ [16].
Накопленные данные о безопасности и эффективности вакцинации послужили основанием для разработки экспертами ВОЗ совместно с ЮНИСЕФ Комплексного глобального плана действий по профилактике и контролю инфекционных заболеваний, одной из целей которого является максимальное снижение детской смертности от диареи до 2025 г., что возможно при обеспечении всеобщего охвата иммунизацией против РВИ [16].
По данным на 1 января 2016 г., вакцинация против РВИ внедрена в национальные программы иммунизации 83 стран мира. В 2016 г. организовать вакцинацию планируют еще 8 стран [17, 18].
В Российской Федерации (РФ) только за последние 15 лет показатель заболеваемости РВИ увеличился более чем в 10 раз (с 3,2 на 100 тыс. населения в 1993 г. до 74,95 в 2014-м). Результаты эпидемиологических исследований, проведенных в России в разные периоды, показали, что РВ служит причиной 44–47% случаев гастроэнтеритов у детей до 5 лет, госпитализированных в стационар, и 31% амбулаторных обращений к врачу по поводу гастроэнтерита, достигая в некоторых регионах РФ 75% [19].
Российские эксперты оценили затраты на 1 случай РВИ в 17 394 руб. [20, 21]. Ежегодная вакцинация 95% новорожденных позволит снизить затраты, обусловленные заболеванием, на 45,31 млрд руб., из них 18,98 млрд. руб. – затраты на амбулаторные случаи заболевания, 26,33 млрд. руб. – на случаи, потребовавшие госпитализации [22].
Первого октября 2012 г. в РФ зарегистрирована живая пероральная пентавалентная вакцина, РотаТек, содержащая пять живых реассортантных штаммов РВ. После полного курса вакцинации ПВРВВ у 92,5–100% вакцинированных в сыворотке крови наблюдается значительное повышение уровня нейтрализующих иммуноглобулинов класса А ко всем пяти капсидным белкам РВ человека, содержащихся в реассортантах вакцины (G1, G2, G3, G4и Р1А [8]), соответствующих циркулирующим в России серотипам, что в свою очередь позволяет контролировать заболеваемость РВИ [23, 24].
Реалии настоящего времени позволили включить вакцинацию против РВИ в Национальный календарь профилактических прививок по эпидемическим показаниям [25]. Кроме того, благодаря региональным программам ряд российских территорий, в т.ч. и Красноярский край, включили иммунизацию против РВИ в региональные календари профилактических прививок.
Членами Экспертного совета «Вакцинопрофилактика ротавирусной инфекции – вклад в снижение заболеваемости острыми кишечными инфекциями в Красноярском крае», который состоялся 25 ноября 2013 г. в Красноярске, было принято решение о проведении пилотного проекта по иммунизации против РВИ в одном из промышленных городов края – Ачинске, где благодаря сотрудничеству с Открытым акционерным обществом «РУСАЛ Ачинск», в рамках благотворительной акции было приобретено 3000 доз живой пероральной пентавалентной вакцины РотаТек (ПВРВВ).
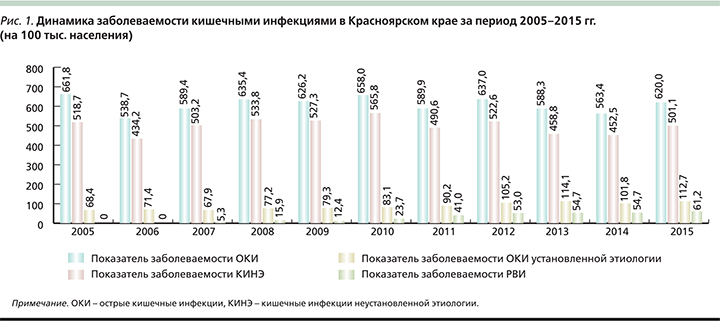
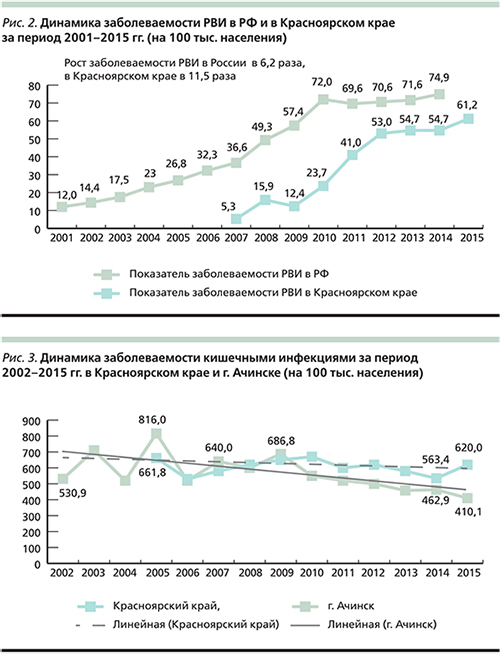
Красноярский край – это регион со стабильно высокой заболеваемостью кишечными инфекциями [26]. Динамика многолетней заболеваемости острыми кишечными инфекциями характеризуется циклическими колебаниями с интервалом 3–4 года и тенденцией к увеличению. В 2015 г. было зарегистрировано 17 724 случая острых кишечных инфекций, показатель заболеваемости составил 620,0 на 100 тыс. населения, что на 9,1% выше уровня 2014 г. (563,4 на 100 тыс. населения; рис. 1). Несмотря на низкий уровень этиологической расшифровки в группе кишечных инфекций установленной этиологии, вирусные диареи занимают 61,7%, среди которых 88,0% обусловлено РВ. Динамика многолетней заболеваемости РВИ имеет выраженную тенденцию к росту, показатель заболеваемости с 2007 г. вырос в 11,5 раз и составил в 2015 г. 61,2 на 100 тыс. населения (рис. 2).
Активность эпидемического процесса поддерживается в основном за счет детского населения, доля которого в возрастной структуре заболевших в 2015 г. составила 97,4%. При этом особенно уязвимы дети раннего возраста, наиболее высокие показатели заболеваемости РВГЭ отмечаются в возрастных группах от 0 до 1 года (1115,2 на 100 тыс. населения) и 1–2 лет (1043,7 на 100 тыс. населения).
Многолетняя динамика заболеваемости кишечными инфекциями в Ачинске Красноярского края характеризуется периодами спада и подъема, в целом показатель заболеваемости не превышает средний по Красноярскому краю (рис. 3). Несмотря на низкий уровень этиологической расшифровки с доминированием кишечных инфекций неустановленной этиологии (80,3%), показатель заболеваемости РВИ в Ачинске в период с 2010 по 2014 г. вырос в 4,3 раза: с 7,1 на 100 тыс. населения в 2010 г. до 30,3 на 100 тыс. населения в 2014 г. Удельный вес РВИ в структуре вирусных диарей увеличился с 29,2% в 2010 г. до 95,0% в 2015-м.
В целом по краю РВИ регистрируются во всех возрастных группах с преимущественным поражением детей от 0 до 1 года (46,7%) и 1–2 лет (30,0%). С возрастом восприимчивость к РВИ снижается, составляя у пациентов 2–3 и 3–5 лет 14,4 и 8,9% соответственно. Обращает на себя внимание не только частота РВГЭ среди детей первых двух лет жизни, но и его тяжесть, чаще всего обусловленная развитием кишечного эксикоза I–II и даже III cтепеней, гиповолемического шока, ацетонемического синдрома.
 Согласно проведенному нами анализу, удельный вес тяжелых форм РВИ среди больных, госпитализированных в стационар в возрасте от 0 до 1 года, составил 48,6%, 1–2 лет – 27,0% , 2–3 лет – 18,9% и только 5,4% – у детей 3–5 лет [27].
Согласно проведенному нами анализу, удельный вес тяжелых форм РВИ среди больных, госпитализированных в стационар в возрасте от 0 до 1 года, составил 48,6%, 1–2 лет – 27,0% , 2–3 лет – 18,9% и только 5,4% – у детей 3–5 лет [27].
Иммунизация детей Ачинска ПВРВВ началась 29.06.2015 и была организована в трех детских поликлинических объединениях на основании приказа главного врача КГБУЗ «Ачинская межрайонная детская больница» № 231-осн от 02.07.2015, в соответствии с действующими санитарными нормами и правилами по организации и проведению вакцинопрофилактики. В рамках пилотного проекта планируется иммунизировать 1000 детей, что составит 70,0% от когорты новорожденных Ачинска.
В соответствии с рекомендациями ВОЗ и инструкцией по медицинскому применению пероральной ПВРВВ, курс вакцинации состоит из трех доз препарата с интервалом между введениями от 4 до 10 недель. Первую дозу ПВРВВ вводят детям в возрасте от 8 до 12 недель, что обеспечивает максимальную безопасность пациенту. Все три дозы рекомендуется вводить до достижения ребенком возраста 32 недель.
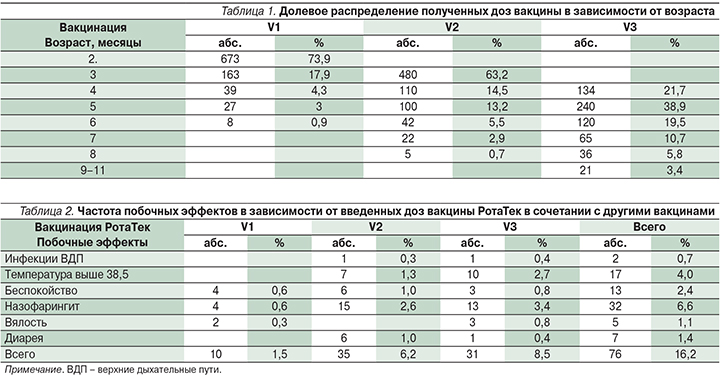
За период с июля 2015 по апрель 2016 г. полный курс вакцинации (V3) получили 616 человек: V1 – 910, V2 – 759, V3 – 616 человек. Таким образом, первую дозу ПВРВВ дети получают преимущественно в 2 месяца – 673 (73,9 %) ребенка, вторую дозу – в 3 месяца – 480 (63,2%) человек и завершают курс вакцинации в большинстве случаев к 5 месяцам – 240 (38,9%) человек (табл. 1).
Вакцинация ПВРВВ проводится как самостоятельно, так и одновременно (в один день) с любыми вакцинами Национального календаря профилактических прививок и прививок по эпидемическим показаниям, кроме вакцины БЦЖ/БЦЖ-м. Известно, что одновременное введение нескольких вакцин, в т.ч. оральной полиомиелитной вакцины (ОПВ), с ПВРВВ не влияет на выработку иммунного ответа.
Первая доза ПВРВВ в 51,5% случаев (469 человек) вводилась одновременно с ПКВ13. Получение второй дозы в 69,6% (528 человек) сочеталось с вакциной АКДС и вакциной против полиомиелита. Третью дозу препарата дети получали преимущественно в комбинации с вакциной АКДС, вакцинами против полиомиелита и пневмококковой инфекции (ПКВ13) – 31,5% (194 человека).
В соответствии с международными требованиями при изучении безопасности вакцины учитывались любые симптомы и заболевания (побочные эффекты), развивающиеся в поствакцинальном периоде в течение 1 месяца.
С целью изучения безопасности препарата после приема каждой дозы вакцины за всеми детьми проводился тщательный контроль в виде наблюдения в течение первых 30 минут и далее через 7 дней в виде опроса.
Через 30 минут после введения ПВРВВ побочных эффектов не было отмечено ни в одном из случаев.
В течение последующих 7 дней частота побочных эффектов в целом составила 16,2% и распределилась следующим образом в порядке уменьшения частоты встречаемости: назофарингит – 6,6%, повышение температуры тела выше 38°С – 4,0%, беспокойство – 2,4%, диарея – 1,4%, вялость – 1,1%, инфекции верхних дыхательных путей – 0,7% (табл. 2).
Длительность побочных эффектов варьировалась от 1 дня при регистрации изменения температуры тела, беспокойства, вялости; симптомы назофарингита сохранялись 5–6 дней, инфекции верхних дыхательных путей – до 10 дней, диарея отмечалась в течение 2 дней.
Необходимо отметить, что при самостоятельном введении ПВРВВ побочных эффектов отмечено не было ни в одном из случаев. Не исключается, что зарегистрированные реакции организма являются следствием введения других вакцин, используемых совместно, либо являются случайно совпавшими по времени заболеваниями в поствакцинальном периоде.
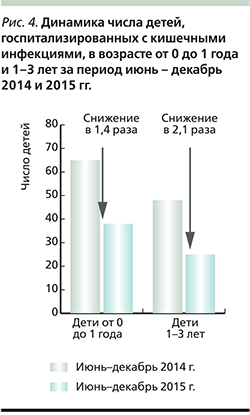
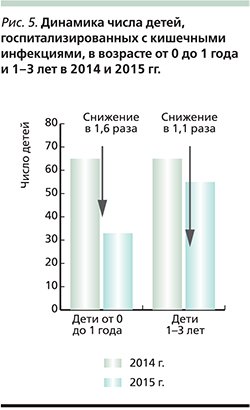
Несмотря на короткий период наблюдения, уже сегодня можно говорить об эффективности вакцинации ПВРВВ. Сравнивая временной период июнь – декабрь 2015 г., когда началась вакцинация против РВИ, и аналогичный период 2014 г., можно отметить, что число госпитализаций по поводу кишечных инфекций среди детей в возрасте от 0 до 1 года снизилось в 1,4 раза, а в возрастной группе 1–3 года – в 2,1 раза (рис. 4). В целом, оценивая эффективность вакцинации, можно отметить снижение числа госпитализаций по поводу кишечных инфекций в стационар в 2015 г. среди детей в возрасте от 0 до 1 года в 1,6 раза по сравнению с аналогичным периодом 2014 г.
В возрастной группе детей 1–3 года, не подлежащих вакцинации, также отмечено снижение числа госпитализаций в 2015 г. в 1,1 раза (рис. 5). Кроме того, в аналогичные периоды времени отмечено некоторое снижение числа обращений за неотложной медицинской помощью по поводу острой диареи среди как детского, так и взрослого населения Ачинска.
Таким образом, оценивая первый опыт применения живой ПВРВВ для профилактики РВИ и подводя предварительные итоги вакцинации, которая началась во втором полугодии 2015 г среди когорты новорожденных промышленного Ачинска, можно отметить:
- Возможность комбинации ПВРВВ с другими вакцинами, используемыми в рамках Национального календаря профилактических прививок.
- Безопасность и хорошую переносимость ПВРВВ, отсутствие побочных эффектов при самостоятельном введении препарата.
- Первые положительные результаты, полученные от внедрения вакцинации ПВРВВ: снижение числа госпитализаций по поводу кишечных инфекций в инфекционное отделение как в группе вакцинируемых (от 0 до 1 года), так и среди детей 1–3 лет, не подлежащих вакцинации. Снижение числа обращений за неотложной медицинской помощью по поводу острой диареи среди как детского, так и взрослого населения.


