Всовременном мире проблеме перинатальной патологии центральной нервной системы (ЦНС) уделяется большое внимание, однако она до сих пор остается основной причиной детской инвалидности [1, 2]. Зачастую в основе поражений головного мозга лежит гипоксически ишемическое повреждение нервных клеток [2], вызывающее усиление перекисного окисления липидов, активацию анаэробного гликолиза, медиаторные нарушения [1, 3]. Одним из главных нейротрансмиттеров, регулирующих процессы клеточной пролиферации, дифференциации, миграции, апоптоза и синаптогенеза в мозге человека, является серотонин (СН). Показано, что недостаток этого амина вызывает нарушение центральной регуляции болевой чувствительности и тонуса внутричерепных сосудов, которое может быть одной из причин развития мигрени и других цефалгий [4]. В свою очередь функционирование серотонинергической системы головного мозга требует достаточного количества макро- (МаЭ)- и микроэлементов (МиЭ) [5–7]. Дисбаланс минеральных веществ приводит к нарушению работы окислительно-восстановительных систем, клеточному энергодефициту, развитию дегенеративных процессов [8–11].
С целью снижения частоты перинатальной патологии ЦНС активно ведется поиск препаратов, направленных на предупреждение развития гипоксического повреждения [10, 12, 13]. С профилактической целью беременным женщинам назначают препараты магния (Мg), одним из вариантов является сочетание Мg и витамина В6 (пиридоксин), необходимого для усвоения МаЭ [7]. Кроме того, витамин В6 нужен в качестве кофактора для декарбоксилазы аминокислот, необходимой для синтеза СН. Совместно с витамином В12 и фолатами пиридоксин требуется для профилактики дефектов нервной трубки плода и других пороков развития.
Цель исследования: изучить содержание СН, МаЭ и МиЭ в головном мозге новорожденных крысят, развивавшихся в условиях нарушения маточно-плацентарного кровообращения (МПК) и его биохимической коррекции комплексом, содержащим лактат магния и пиридоксин (ЛМ/П).
Материал и методы
Нарушения МПК были воспроизведены по методике М.М. Вартановой на белых беспородных беременных крысах [14]. Часть самок после операции до конца периода гестации внутрижелудочно получали ЛМ/П в дозе 10–15 мг/кг/сут. Остальным крысам препарат не вводили. У новорожденных крысят, разделенных на 2 группы, на 2-е сутки после рождения исследовали содержание СН, МиЭ и МаЭ в головном мозге. В первую группу включили новорожденных крысят, развивавшихся в условиях нарушения МПК (опытная группа). Вторая группа состояла из новорожденных крысят, развивавшихся без нарушения МПК (контрольная группа).
Содержания СН в гомогенатах головного мозга определяли методом иммуноферментного анализа (ИФА) ELISA Fast Track, основанного на твердофазном конкурентном методе.
Микро- и макроэлементный статус количественно исследовали методом эмиссионной спектрометрии с индукционно связанной аргоновой плазмой сотрудники Независимого экспертно-аналитического совета по разработке и внедрению современных методов исследований и анализа на базе кафедры неорганической и аналитической химии ФГОУ ВПО РГАУ-МСХА им. К.А. Тимирязева и кафедры клинической и лабораторной диагностики ГОУ ВПО РГМУ Росздрава.
Статистическую обработку результатов проводили по общепринятым методикам параметрической и вариационной статистики.
Результаты и обсуждение
Результаты исследования показали, что в головном мозге новорожденных крысят нарушение МПК не вызывало достоверного изменения уровня СН, однако имелась тенденция к его повышению (табл. 1).

Выявленные результаты могут свидетельствовать о недостаточной выраженности или об отсутствии компенсаторной реакции организма новорожденных крысят на гипоксическое воздействие. Действие СН как стресс-лимитирующего фактора должно уравновешивать возбуждение стресс-реализующих адренергической и гипофизарно-адреналовой систем, развивающееся во время и после родов. Однако в условиях нарушения МПК у новорожденных крысят подобной реакции не происходит, что может явиться фактором, усугубляющим развитие гипоксии вследствие еще большего ухудшения кровоснабжения за счет преобладающего действия сосудосуживающих возбуждающих нейромедиаторов. Кроме того, СН оказывает системное адаптивное действие, включая т.н. гипоксическую дыхательную реакцию, что проявляется легочной вазоконстрикцией и гипертензией как адаптивный ответ на стресс. Исходя из полученных результатов, можно предположить, что у новорожденных крысят подобный защитный механизм не функционирует в должной мере и не способен обеспечивать адекватную реакцию на кислородную недостаточность.
Вместе тем были выявлены существенные изменения содержания минеральных веществ, которые могут оказывать значительное влияние на обмен СН (табл. 2).
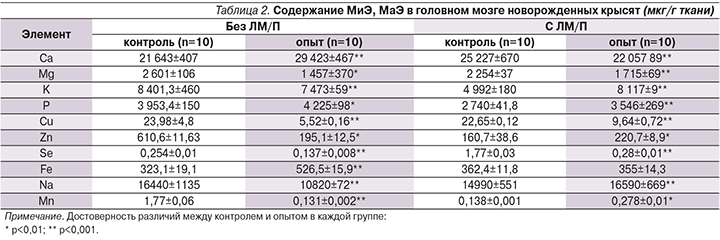
В метаболизме медиатора большое значение имеет кальций (Са). МаЭ посредством кальмодулин-зависимой протеинкиназы-II вызывает активацию ключевого фермента синтеза СН – триптофангидроксилазы (ТПГ), а также является пусковым сигналом для секреции нейротрансмиттера [15]. Наблюдаемый в условиях кислородной недостаточности прирост нейронального содержания Са, вероятно, вызывает увеличение скорости высвобождения амина. В нервной системе МаЭ оказывает модулирующее действие на активность рецепторов к СН, обладающему возбуждающим и сосудосуживающим эффектами. Поскольку Са сам оказывает прессорное действие на стенку сосудов, повышенное содержание минерала способствует ишемическому повреждению нейронов вследствие усиления вазоконстрикции и инициации каскада апоптоза. Непосредственное повреждение и гибель нейронов сопровождаются массивным выделением нейромедиаторов. При накоплении в клетке излишка МаЭ образуется малорастворимая соль фосфата Са, прекращается любая продукция и утилизация АТР, необходимого для депонирования и обратного нейронального захвата СН.
Известно, что естественным антагонистом Са являются ионы Мg, которые модулируют его внутриклеточную активность. Установлено, что интрацеллюлярный Mg2+ может ингибировать образование комплекса кальций–кальмодулин, тем самым тормозя активность кальций-зависимых ферментов. Выявленное нами понижение уровня Mg2+, вероятно, должно вызывать усиление биологического действия Са, таким образом оказывая опосредованное влияние на обмен СН. Доказано, что Мg участвует в синтезе нейромедиатора, поскольку он необходим для получения активной формы витамина В6 – пиридоксальфосфата, кофермента специфической декарбоксилазы, катализирующей образование амина. Участие Мg в энергетическом обмене [11, 13] определяет непосредственную роль МаЭ в осуществлении депонирования и обратного нейронального захвата СН. В естественных условиях значительная часть медиатора, освободившегося при нервном импульсе, возвращается обратно в клетку и хранится в цитоплазматических везикулах в комплексе с АТФ, ионами Мg, цинка (Zn), натрия (Na), калия. Дефицит Mg2+ и АТФ, возникающий в клетках головного мозга при нарушении МПК, вероятно, приводит к снижению интрацеллюлярного запаса медиатора, увеличению его выделения в синаптическую щель и уменьшению обратного высокоаффинного поглощения.
В условиях интенсификации образования СН, происходящего при гипоксии, дефицит Мg может способствовать переходу компенсаторного вазоспазма в патологический и развитию стойкого генерализованного перевозбуждения нейронов. Обладая сосудорасширяющим действием, в естественных условиях ионы Мg способствуют вазопротекции, снижают чувствительность клеток эндотелия к вазоконстрикторным влияниям, восстанавливают нормальную сосудистую реактивность и артериальное давление [13]. Физиологические концентрации Mg2+ вызывают торможение процессов возбуждения в коре головного мозга.
На скорость метаболизма и секрецию СН большое значение также имеют ионы марганца (Mn). Показано, что введение Mn2+ не только приводит к снижению экстрацеллюлярного содержания амина и продуктов его деградации [6], но и вызывает инактивацию декарбоксилазы ароматических аминокислот [16] – фермента, участвующего в синтезе медиатора. Кроме того, МиЭ за счет существования Mn-зависимой супероксиддисмутазы обеспечивает стабильность клеточной мембраны. Исходя из выявленного в ходе исследования понижения уровня ионов Mn, можно ожидать постсинаптического накопления и усиления высвобождения СН.
Существенную роль в метаболизме нейротрансмиттера имеют ионы железа (Fе). Дефицит МиЭ вызывает нарушение продукции медиатора и развитие энергетического кризиса. Образование амина происходит в цитоплазме клеток путем гидроксилирования с участием ключевого Fе2+-зависимого фермента ТПГ. С учетом обнаруженного повышения содержания Fе следует ожидать увеличения образования СН. В то же время избыток ионов двухвалентного Fе способен вызывать активацию перекисного окисления липидов (ПОЛ).
Для активации ТПГ используется реакция фосфорилирования. Наблюдаемый прирост уровня фосфора, необходимого для работы протеинкиназ, вероятно, является следствием недостатка кислорода, приводящего к разобщению окисления и фосфорилирования, а как следствие – к снижению синтеза АТФ.
В условиях антенатальной гипоксии может происходить нарушение обратного нейронального захвата СН, изменение содержания Na и калия. Обратный захват медиатора осуществляется специфическим переносчиком пресинаптических нервных окончаний, активность которого зависит от концентрации ионов Na+, от аэробного и анаэробного энергетического метаболизма. Нарушение МПК приводит к достоверному снижению содержания ионов Na и калия, что также может вызывать изменение работы электрогенного Na+-насоса, обеспечивающего проведение возбуждения, проницаемость мембран для некоторых веществ и синаптическую активность нейронов [5]. Следствием торможения Na+-, K+-АТФазы является повышение проводимости и возбудимости мембраны, что связано с увеличением числа рецепторов, непосредственно взаимодействующих с медиаторами [5].
На обмен СН в условиях нарушения МПК может опосредованно влиять выявленное снижение концентрации Zn. Дефицит элемента способен вызывать снижение активности Cu2+-, Zn2+-зависимой супероксиддисмутазы, нарастание процессов ПОЛ и как следствие – разрушение мембран клеток с массивным высвобождением нейротрансмиттеров. СН посредством активации 5НТ1В-рецепторов вызывает прямое или опосредованное сокращение гладких миоцитов и ингибирование эндотелиальной NO-синтазы (еNOS), активность которой зависит от содержания Zn2+ [4, 9]. Данный фермент вызывает вазодилатацию и увеличение кровотока за счет образования окиси азота (NO). Полученные нами данные о снижении уровня ионов Zn свидетельствуют о том, что при гипоксии процесс NO-зависимого расслабления нарушается, это может приводить к развитию устойчивого спазма сосудистой стенки и как следствие – к ухудшению оксигенации тканей.
Кроме того, ионы Zn2+ играют важную роль в формировании и развитии нервной системы, особенно в I триместре внутриутробного периода. Элемент необходим для инвазии цитотрофобласта, а также для контроля экспрессии большинства генов человека, что является важным условием для нормального развития плода и вынашивания беременности [9]. В условиях гипоксии этот МиЭ проявляет антиоксидантные свойства, уменьшает неспецифическую проницаемость клеточных мембран, предотвращает образование фиброза и оказывает антистрессорное действие.
Как указывалось выше, основным компонентом антиоксидантной системы является не только Zn-, но и медьзависимая супероксиддисмутаза. Выявленное уменьшение концентрации ионов меди приводит к понижению активности ферментов, содержащих этот МиЭ, – цитохром-С-оксидазы, аминооксидазы. Известно, что медь участвует в передаче нервного импульса, влияет на процессы биосинтеза и высвобождения нейропептидов.
Не менее важным компонентом, участвующим в нейротрансмиттерном обмене, является селен (Se), содержание которого в условиях антенатальной гипоксии понизилось. Se активирует окислительно-воосстановительные энзимы митохондрий и микросом, обладает защитным действием от тяжелых металлов, влияет на синтез АТФ, участвует в антиоксидантной защите клеток: минерал необходим для функционирования ферментов антиоксидантной защиты – глутатионпероксидазы, глутатионредуктазы, на чем основывается его нейропротективное действие [17, 18].
Таким образом, дисбаланс МЭ в головном мозге, возникающий при недостаточности МПК, способствует интенсификации синтеза и накоплению СН, пролонгированию и потенцированию его сосудосуживающего действия, что, с одной стороны, приводит к улучшению оксигенации ткани, с другой стороны, может явиться фактором, утяжеляющим степень кислородной недостаточности. Кроме того, понижение концентрации МиЭ – компонентов антиоксидантной системы может приводить к усилению процессов ПОЛ и как следствие – вызывать усиленное повреждение мембран клеток.
Применение ЛМ/П привело к достоверному увеличению содержания СН в головном мозге новорожденных крысят, развивавшихся как в естественных, так и в патологических условиях (табл. 1). Повышение концентрации СН – компонента стресс-лимитирующей системы, вероятно, направлено на предотвращение чрезмерного возбуждения стресс-реализующих адренергической и гипофизарно-адреналовой систем, способных усугублять развитие гипоксии. Выявленные изменения, возможно, можно рассматривать как один из механизмов нейропротекторного действия препарата.
На фоне применения ЛМ/П (табл. 2) в головном мозге новорожденных крысят, развивавшихся при нарушениях МПК, произошло уменьшение концентрации Са, Fe, фосфора и повышение уровней Mg, Na, K, Zn, Mn. Подобное изменение содержания МиЭ способно благоприятно влиять на обмен СН, восстанавливая баланс между активностью синтеза медиатора, его выделением в синаптическую щель и процессами депонирования, пресинаптического захвата и инактивации нейротрансмиттера. Выявленное на фоне применения ЛМ/П повышение концентрации МиЭ, оказывающих вазодилатирующее, антиокидантное, антистрессорное и нейропротективное действия, вероятно, направлено на ограничение избыточного сосудосуживающего действия СН, способного вызывать еще большее ухудшение кровоснабжения.
Выводы
- В головном мозге новорожденных крысят недостаточность МПК вызывает нарушение баланса МиЭ, интенсификацию обмена СН и пролонгирование его действия.
- Биохимическая коррекция ЛМ/П в условиях антенатальной гипоксии оказывает нейропротекторное действие на клетки головного мозга в эксперименте за счет изменения микроэлементного состава и содержания СН.



