Введение
В 1982 г. P.C. Walsh и P.J. Donker [1] впервые описали анатомию сосудисто-нервных пучков (СНП), расположенных по обе стороны от простаты. Данный факт послужил началом разработки методики нервосберегающей радикальной простатэктомии, что в последующем привело к значительному снижению частоты эректильной дисфункции (ЭД) в послеоперационном периоде. Анатомические особенности кавернозных нервов, а также недостаточная визуализация тканей могут в значительной степени затруднить локализацию СНП, что также может приводить к развитию ЭД. Технические характеристики роботизированных систем способствовали значительному улучшению визуализации, обеспечению стабильной и «точной» работы в ограниченном пространстве малого таза, снижению кровопотери, а также уменьшению количества послеоперационных осложнений.
Следующим этапом, обеспечившим улучшенное понимание хирургической анатомии вследствие модифицированной визуализации, явилось создание роботизированной техники, активное внедрение которой привело к необходимости детального изучения нейроанатомических структур органов малого таза. Данный факт позволил классифицировать методику нервосберегающей робот-ассистированной радикальной простатэктомии (НСРАРПЭ) на интерфасциальную и интрафасциальную [2, 3]. Помимо самой методики выполнения НСРАРПЭ (одно- или двусторонней) на частоту развития ЭД у пациентов, перенесших оперативное лечение по поводу рака предстательной железы (РПЖ), влияют такие факторы, как:
- возраст больного;
- характеристики опухоли;
- состояние эректильной функции (ЭФ) до операции;
- размер ПЖ;
- опыт хирурга [4].
Учитывая данные факторы, согласно рекомендациям EAU 2015 г., можно сформулировать основные показания к выполнению НСРАРПЭ [5]:
- нормальная ЭФ до операции (оцененная субъективно самим пациентом при заполнении шкалы IIEF);
- уровень ПСА≤ 0 нг/мл;
- клиническая стадия РПЖ≤T2;
- сумма баллов по Глисону≤7.
Некоторые авторы в дополнение к вышеперечисленным критериям прибегают к номограмме Партина [6], а также данным мультипараметрической магнитно-резонансной томографии (МРТ) [7]. Интраопераионная экспресс-биопсия замороженных срезов позволяет определиться с необходимостью проведения дополнительной резекции или сохранения СНП [8].
Материал и методы
Правильное понимание этапов выполнения РПЭ предопределило основные технические характеристики НСРАРПЭ у больных РПЖ [9]:
- Вскрытие эндопельвикальной фасции рекомендуется проводить без использования электроножа из-за возможности повреждения СНП, расположенных рядом [10]. На данном этапе важным является сохранение добавочных (аберрантных) половых артерий, принимающих участие в кровоснабжении кавернозных тел полового члена.
- На этапе рассечения шейки мочевого пузыря существует риск повреждения СНП во время диссекции в латеральном направлении [11].
- Диссекция и выделение семявыносящих протоков и семенных пузырьков по латеральной поверхности (тесное прилегание СНП) также должны проводиться атермально [12].
- Во время мобилизации задней поверхности ПЖ с целью сохранения нервных окончания важно рассекать фасцию Денонвилье по средней линии, не доходя до верхушки ПЖ [13].
- Четкая граница между ножками ПЖ и нервными волокнами практически отсутствует, в связи с этим диссекция ткани в данной области должна проводиться с исключительной осторожностью, атермально. Рассечение сосудов должно проводиться поэтапно острым путем с применением сосудистых клипов. Важно также отметить, что на каждом этапе выполнения НСРАРПЭ целесообразно использовать роботические инструменты с бóльшим запасом рабочего времени, предусматривающим наличие острых ножниц для диссекции.
В 2012 г. A. Takenaka и A.K. Tewari [14] описали «трехзонную концепцию», характеризующую распределение нервных волокон, находящихся вблизи ПЖ:
- первая зона располагается латерально по отношению к шейке мочевого пузыря, семенным пузырькам и ветвям нижней пузырной артерии;
- вторая зона – собственно СНП;
- третья зона – добавочные нервные волокна в области апикального отдела ПЖ.
Учитывая тот факт, что «классическое» представление о расположении СНП по заднелатеральной поверхности простаты было пересмотрено, в настоящее время считается, что должно быть сохранено как можно большее количество нервных окончаний на поверхности ПЖ.
Одновременно с внедрением в клиническую практику РАРПЭ в 2008 г. нами начато освоение методики выполнения нервосберегающей РАРПЭ. За тот период нами прооперировано около 1000 пациентов с диагнозом РПЖ, из которых 450 пациентам, согласно критериям включения Guidelines EAU [5], операция была выполнена по нервосберегающей методике с сохранением ≥1 СНП (рис. 1).
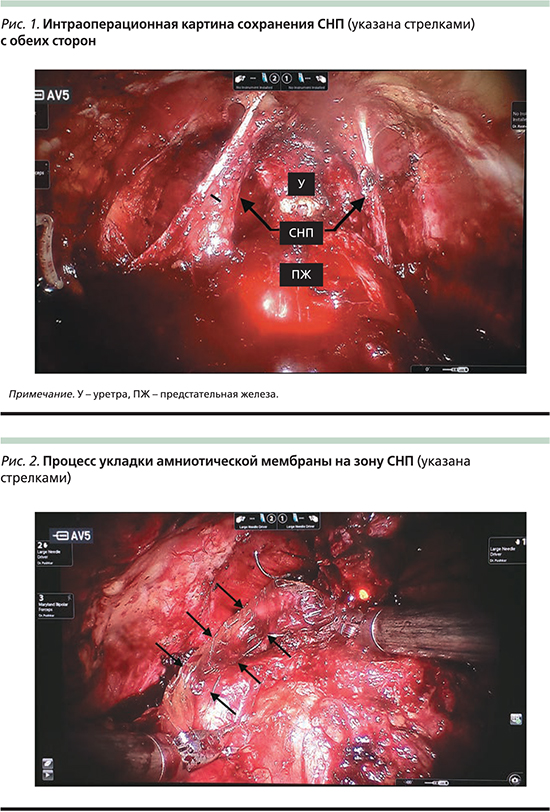
Пациентам молодого возраста на зону СНП интраоперационно была установлена амниотическая мембрана. Обладая нейропротективным, регенеративным и противовоспалительным эффектами [15, 16], данный аллотрансплантат предусматривает скорейшее восстановление ЭФ в послеоперационном периоде (рис. 2).
Всем пациентам перед операцией рекомендовалось выполнение эндоректальной МРТ, позволяющей более точно стадировать РПЖ и определять локализацию опухоли благодаря более качественной визуализации зональной анатомии простаты.
Всем пациентам по завершении операции мочевой пузырь был дренирован по уретре специально разработанным катетером, предусматривающим возможность контролируемого наполнения дополнительного баллона, располагающегося в области сформированного уретрошеечного анастомоза [24].
У всех прооперированных по нервосберегающей методике пациентов средний уровень общего ПСА сыворотки крови составил 5,2 (2,8–8,3) нг/мл, клиническая стадия РПЖ – Т1а–T2с, сумма баллов по Глисону не превышала 7. Средний объем ПЖ составил 48 (23–87) см3, индекс массы тела – 26,4 (23,8–37,9) кг/м2; ЭФ у всех пациентов была сохранена, средний балл по шкале IIEF составил 22,3 (15–30).
Все пациенты в день удаления уретрального катетера начинали принимать тадалафил в дозировке 5 мг ежедневно.
Результаты и обсуждение
Спустя полгода после оперативного лечения полностью восстановили ЭФ 320 пациентов, из которых 70 – в первые 3 месяца. Периоперационный период составил 8 (3–21) дней. После удаления уретрального катетера (в среднем на 6-е сутки) у всех пациентов восстановлено самостоятельное мочеиспускание. Серьезных периоперационных осложнений отмечено не было.
Анализ собственных данных позволил нам сформулировать основные этапы ретроградной атермальной техники сохранения СНП [17], которые основаны на минимально выраженной тракции и ранней диссекции нервных пучков в средней части ПЖ до лигирования «ножек» простаты и предварительно полностью осуществленной мобилизации прямой кишки вплоть до верхушки ПЖ. Диссекцию тканей правильно начинать вдоль латеральной поверхности средней части ПЖ, постепенно переходя в дистальном направлении к апикальному отделу. При помощи отведения простаты «третьей» рукой роботической системы или лапароскопического зажима, используемого ассистентом в ходе операции, происходит выделение СНП. При возникновении кровотечения в зоне диссекции целесообразно использовать гемостатические нерассасывающиеся клипы, позволяющие избегать термального поражения ткани СНП. Достаточная мобилизация «ножек» ПЖ служит основным предиктором правильного наложения гемостатических клипов. Крайне важным перед наложением гемостатических клипов считается визуализация СНП, проходящих вдоль латеральной поверхности ПЖ на 5 и 7 часах условного циферблата. С целью профилактики повреждения СНП при использовании клипов наложение последних должно проводиться таким образом, чтобы «ножку» можно было легко пересечь между гемостатическим клипом и поверхностью простаты.
Наряду с онкологическими результатами одной из важнейших задач в сохранении качества жизни больных, перенесших РПЭ по поводу РПЖ, является сохранение ЭФ. Реализация данной задачи возможна в рамках проведения пенильной реабилитации – совокупности мероприятий, предусматривающих использование лекарственных средств или устройств для максимально раннего восстановления ЭФ. Целью данной программы является предотвращение структурных повреждений гладкой мускулатуры и эндотелия и увеличение шансов возвращения ЭФ до предоперационного уровня.
Проведенные ранее рандомизированные плацебо-контролируемые клинические исследования по изучению эффективности ежедневного применения ингибиторов фосфодиэстеразы 5-го типа, таких как силденафил (25/50 мг), тадалафил (5 мг) и варде-нафил (10/20 мг), показали существен ное улучшение ЭФ по сравнению с плацебо в группе пациентов, перенесших билатеральную НСРАРПЭ [18–20]. Тем не менее, несмотря на разработку и внедрение новых селективных лекарственных препаратов, частота ЭД, по мнению ряда авторов, по-прежнему остается высокой [21, 22].
Предварительные клинические исследования показали эффективность интракавернозной фармакотерапии (альпростадил, папаверин, фентоламин, простагландин и пр.) в качестве «второго» этапа пенильной реабилитации. Благодаря усилению оксигенации и растяжению кавернозных тел данная группа препаратов позволяет предупреждать укорочение полового члена. По мнению I. Goldstein и соавт. [23], при использовании альпростадила улучшение ЭФ наблюдается в 83% случаев. Однако наличие побочных явлений, таких как приапизм, ограничивают его применение. Завершающим этапом пенильной реабилитации в лечении ЭД у больных, перенесших оперативное лечение РПЖ, следует считать фаллопротезирование. Причем наиболее предпочтительно устанавливать трехкомпонентный (гидравлический) фаллопротез.
Выводы
Внедрение в клиническую практику нервосберегающей методики выполнения РПЭ, безусловно, повысило качество жизни послеоперационных больных. Тем не менее интраоперационная травма СНП по-прежнему может приводить к резкому снижению ЭФ. Описана не так давно идеальная ситуация – «trifecta», предусматривающая отсутствие положительного хирургического края, наличие способности к удержанию мочи и сохранение ЭФ как от опыта хирурга, так и от критериев отбора и преимуществ той или иной методики операции. Подробное изучение анатомо-функциональных структур тазовых органов позволяет в итоге добиваться превосходного онкологического и функционального результатов операции.
Работа выполнена при поддержке РНФ, соглашение № 16-15-00233


