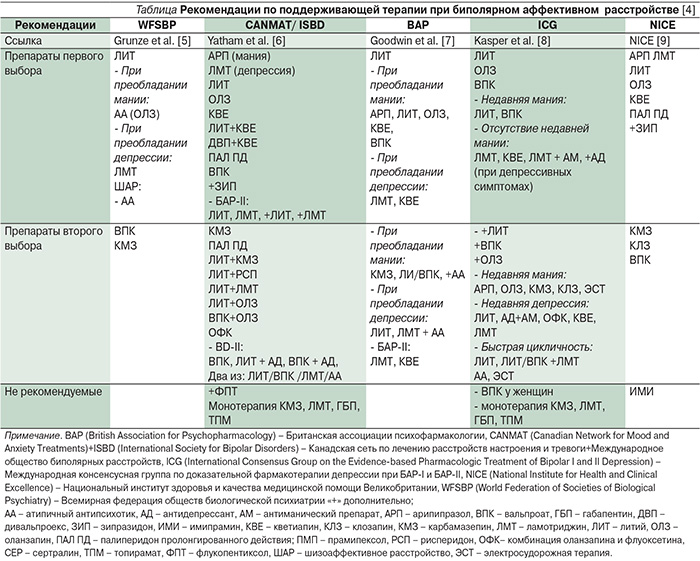
Риск развития рецидива после первого эпизода биполярного аффективного расстройства (БАР) составляет 95% [1], поэтому после купирования острого эпизода рекомендуется проведение длительной поддерживающей терапии. Ее целью является профилактика развития рецидива, устранение субсиндромальных симптомов и улучшение социального и профессионального функционирования пациентов [2, 3]. В идеальном случае длительная поддерживающая терапия должна обеспечить полное устранение симптомов депрессии, мании, смешанных эпизодов и негативного влияния заболевания на качество жизни, однако на практике часто удается достичь лишь вторичных целей лечения – снижения частоты, тяжести и продолжительности заболевания или облегчения симптомов [3]. Выбор оптимальной поддерживающей фармакотерапии затрудняет ограниченность имеющихся сравнительных доказательных данных, что обусловливает разницу в рекомендуемых препаратах первой и второй линий в различных руководствах по лечению БАР (см. таблицу).
Нормотимики
Наибольшая доказательная база имеется для ЛИТ, который рассматривается в качестве препарата первого ряда для поддерживающей терапии БАР во всех современных руководствах (см. таблицу), включая новое руководство NICE 2014 г. [10]. Эффективность ЛИТ была продемонстрирована в рандомизированных контролируемых исследованиях (РКИ) и мета-анализах [11–13]. Согласно результатам мета-анализа 5 РКИ (770 участников), риск развития рецидива в группе ЛИТ составлял 40% по сравнению с 60% в группе плацебо [13]. В том же мета-анализе было показано, что ЛИТ позволяет более эффективно предотвращать эпизоды мании, чем эпизоды депрессии. В первом случае риск развития рецидива при применении ЛИТ составил 14% и был достоверно ниже, чем в группе плацебо (24%), во втором случае разница между группами была на грани достоверности (25 и 32% соответственно). Более высокая эффективность ЛИТ в профилактике маний была показана и в других исследованиях [14], хотя его применение ассоциировалось со значительным удлинением времени до возникновения субсиндромальных симптомов любой полярности [15]. Селективность ЛИТ в отношении эпизодов мании пытались объяснять систематической ошибкой, связанной с дизайном многих исследований, использовавших модель «прекращения терапии» (discontinuation design), т.к. отмена препарата в большей степени предрасполагает к развитию мании, чем депрессии [11]. Кроме того, результаты исследований с прекращением терапии труднее интерпретировать вследствие их более короткой продолжительности и связанной с отменой ЛИТ рефрактерностью, которая возникает примерно у 15% пациентов [16]. Высказывалось предположение, будто неудача ЛИТ в профилактике депрессии может быть обусловлена вызываемыми им нарушениями функции щитовидной железы [17]. Ретроспективный анализ данных большого двойного слепого РКИ позволил предположить, что недостаточная эффективность ЛИТ в отношении эпизодов депрессии может быть вызвана применением неадекватных доз, не позволяющих достигать его терапевтических концентраций в крови [18]. В случае когда концентрации препарата в крови составляли 0,6–0,1 мЭкв/л, он эффективно предотвращал рецидивы эпизодов обеих полярностей, а при уровне концентраций в крови ниже 0,6 мЭкв/л его профилактический эффект не отличался от такового плацебо [18]. Применение ЛИТ в оптимальных дозах позволяло предотвращать до 50% всех рецидивов [19, 20]. Эффективность ЛИТ в качестве средства профилактики аффективных эпизодов в целом, эпизодов мании и эпизодов депрессии была продемонстрирована в большом исследовании – двойном слепом РКИ Weisler et al. [21], а также в двух мета-анализах, опубликованных в 2014 г. [22, 23]. Авторы обоих мета-анализов пришли практически к одинаковым выводам. Severus et al. указывают, что ЛИТ – единственный препарат, имеющий обширные и постоянные доказательства эффективности, в связи с чем остается наиболее клинически ценным для поддерживающей терапии БАР [22]. В мета-анализе Miura et al. вторым препаратом, который позволял предотвращать эпизоды любой полярности, оказался КВЕ [23]. Несмотря на то что КВЕ даже превосходил ЛИТ по профилактической эффективности в отношении эпизодов депрессии и аффективных эпизодов в целом, авторы рекомендовали интерпретировать эти результаты с осторожностью, т.к. они были получены преимущественно в исследованиях с расширенным включением пациентов (enriched design). Это позволило им рассматривать ЛИТ в качестве «самого рационального кандидата для длительной терапии БАР» [23].
В реальной медицинской практике эффективность ЛИТ ниже, чем в клинических исследованиях, вследствие коморбидности и недостаточной комплаентности пациентов, поэтому при его назначении рекомендуется учитывать предикторы терапевтического ответа на препарат [4], к которым относят наличие БАР в семейном анамнезе, отсутствие быстрой цикличности, полное восстановление в межприступном периоде, отсутствие злоупотребления психоактивными веществами и хорошую приверженность лечению [24]. Между тем эти критерии были разработаны в конце 1980-х гг., а исследования последних лет позволяют предположить, что ЛИТ эффективен при быстрой цикличности [25] и оказывает благоприятное влияние на симптомы, обусловленные сопутствующим злоупотреблением психоактивными веществами [26, 27]. По профилактическому эффекту у больных с быстрой цикличностью в 20-месячном двойном слепом РКИ ЛИТ не уступал ВПК [28].
Достоинством ЛИТ служит наличие у него антисуицидальных свойств, не зависимых от антирецидивного эффекта [29, 30]. Согласно результатам систематического обзора, он снижает риск суицида более чем на 50% [31]. Недостатки ЛИТ – его узкий терапевтический индекс и нежелательное действие на почки и щитовидную железу [32]. В последних двух мета-анализах показана хорошая переносимость ЛИТ, в т.ч. со стороны почек, однако период наблюдения в среднем составил всего 2 года [22, 23]. В то же время его применение в течение 10 лет ассоциируется с повышенным риском развития почечной дисфункции [33]. Кроме того, в последнее время беспокойство вызывает его неблагоприятное влияние на сексуальную сферу [34].
ЛМТ позволяет эффективно предотвращать депрессивные эпизоды, однако его роль в профилактике эпизодов мании остается неясной [35]. По результатам трех плацебо-контролируемых исследований у пациентов с БАР-I, недавно перенесших эпизод мании или гипомании, ЛМТ в суточных дозах 50–400 мг позволяет существенно пролонгировать время до развития любого аффективного эпизода [14]. Доказательные данные о профилактическом эффекте ВПК остаются ограниченными и неоднозначными [36]. В одном РКИ он не превосходил по эффективности плацебо, уступая ЛИТ по показателю «время до развития любого аффективного эпизода» [37]. Вторичный анализ результатов этого исследования показал, что ВПК превосходит плацебо в предотвращении рецидивов депрессии у тяжелых пациентов. В исследовании BALANCE по способности предотвращать аффективный эпизод ВПК уступал ЛИТ (относительный риск – 0,71, 95% ДИ – 0,51–1,00) [38]. В других сравнительных исследованиях с активными компараторами ВПК по противорецидивной активности был сопоставим с ЛИТ и ОЛЗ [39, 40]. В недавно опубликованном мета-анализе было сделано заключение, согласно которому «ограниченные доказательства поддерживают эффективность ВПК при длительной терапии БАР» [38]. В систематическом обзоре 34 РКИ была показана эффективность ВПК в предупреждении эпизодов депрессии [39]. По антисуицидальной активности ВПК сопоставим с ЛИТ [40]. Применение ВПК значительной частью больных – женщинами детородного возраста – ограничивает его тератогенный эффект и повышенный риск развития синдрома поликистозных яичников [41–43].
КМЗ традиционно рассматривался в качестве препарата второго выбора для пациентов, не отвечающих на терапию ЛИТ. Его преимущество перед плацебо было продемонстрировано в небольшом исследовании с участием 32 пациентов (60 против 22,2 % в группе плацебо) [44]. В нескольких сравнительных исследованиях с ЛИТ не наблюдалось достоверной разницы между препаратами сравнения, однако прослеживалась тенденция к большей эффективности ЛИТ [4]. Гетерогенность исследований не позволяет сформулировать определенное заключение об эффективности КМЗ в качестве средства поддерживающей терапии [4]. Имеются ограниченные данные об эффективности окскарбазепина при поддерживающей терапии БАР. В однолетнем двойном слепом плацебо-контролируемом исследовании с участием 55 больных БАР-I и БАР-I–II он статистически не отличался от ЛИТ [45].
Антипсихотики
Антипсихотики I поколения не эффективны в профилактике депрессивных эпизодов и могут сами провоцировать их развитие [46]. Напротив, эффективность препаратов II поколения продемонстрирована в ряде исследований, и их применение в низких дозах для поддерживающей терапии БАР является давно установившейся практикой [47]. Регуляторными органами Евросоюза и США одобрены для применения в качестве препаратов поддерживающей терапии ОЛЗ, АРП и КВЕ.
По результатам мета-анализа 5 РКИ, ОЛЗ превосходил плацебо в профилактике рецидива мании только у пациентов с хорошим ответом на лечение этим препаратом в остром маниакальном или смешанном эпизоде, ранее не ответивших на терапию ЛИТ или ВПК [48]. Разницы между плацебо и ОЛЗ при применении как в виде монотерапии, так и в комбинации с ЛИТ или ВПК в предупреждении аффективных эпизодов в целом выявлено не было. В сравнительных исследованиях с ЛИТ ОЛЗ статистически не отличался от препарата сравнения по способности предотвращать рецидив депрессивного эпизода, но превосходил его по способности предотвращать маниакальные и смешанные эпизоды [50]. В профилактике эпизодов мании он также проявлял сходный эффект с ВПК, но несколько превосходил препарат сравнения при оценке по шкале маний Янга [51].
Протективный эффект АРП показан в отношении рецидивов мании, однако в отношении рецидивов депрессии он не отличался о плацебо [52–54]. Согласно результатам мета-анализа 33 РКИ, в которых изучалось 17 видов терапии БАР, КВЕ является единственным препаратом помимо ЛИТ, эффективным в профилактике как аффективных эпизодов в целом, так и эпизодов депрессии и мании [23]. В большом (n=1226) двойном слепом РКИ поддерживающая терапия КВЕ позволяла пациентам, стабилизированным данным препаратом в остром периоде, существенно увеличивать время до развития рецидива аффективного эпизода любой полярности [55]. Монотерапия КВЕ также эффективно предупреждала рецидив депрессии у пациентов с быстрой цикличностью [56]. В большом (n=766) плацебо-контролируемом РКИ ПАЛ ПД значительно пролонгировал время до развития рецидива любой полярности у пациентов, для которых данный препарат оказался эффективным в качестве лечения острой мании или смешанного эпизода, однако дизайн исследования не позволяет распространять полученные результаты на других пациентов [57]. Инъекционный РСП пролонгированного действия в длительном (24 месяца) РКИ позволял предупреждать развитие маниакальных и смешанных, но не депрессивных эпизодов [58]. Его более высокая эффективность в отношении маниакальных и смешанных эпизодов подтверждается и результатами обзора клинических исследований препарата [59]. Азенапин в качестве средства поддерживающей терапии пациентов, ответивших на лечение этим препаратом в острой фазе, не отличался по эффективности от ОЛЗ [60, 61].
Антидепрессанты
Доказана эффективность ИМИ в профилактике эпизода депрессии [39]. Есть данные об эффективности флуоксетина в качестве препарата поддерживающей терапии пациентов с БАР-I, ответивших на лечение препаратом в острой фазе. В двух исследованиях продолжительностью 12 и 6 месяцев рецидив наблюдался у 43–45% пациентов в группе флуоксетина по сравнению с 100% в группе плацебо [62, 63]. У больных БАР-II, перенесших депрессивный эпизод, было выявлено преимущество флуоксетина перед ЛИТ и ВПК [64, 65]. Однако применение АД, особенно в виде монотерапии, не рекомендуется в связи с риском инверсии фазы [4]. При БАР-II этот риск ниже, чем при БАР-I, но выше, чем при рекуррентной депрессии [66]. В целом нет сильных доказательств преимуществ какого-либо препарата перед другими при применении в качестве препаратов поддерживающей терапии. Исключение составляет ЛМТ для профилактики депрессий [14]. Имеются достаточные доказательства, подтверждающие эффективность ЛИТ, КВЕ, ОЛЗ, АРП и инъекционного РСП пролонгированного действия в профилактике эпизода мании и КВЕ, ВПК и ИМИ – в профилактике эпизода депрессии [39]. Число пациентов, которых необходимо пролечить для предотвращения 1 случая рецидива (NNT) на основании результатов 15 РКИ, колебалось от 3 при применении ОЛЗ до 8 при применении зипразидона (при применении ЛИТ – 4) [67]. Однако сделать определенные выводы о преимуществах какого-либо препарата не позволяют методологические недостатки клинических исследований [67, 68].
Комбинированная и адъювантная терапия
В клинических исследованиях изучались различные комбинации разных психотропных препаратов. Единственной комбинацией, при применении которой было продемонстрировано снижение частоты рецидивов аффективных эпизодов обеих полярностей вне зависимости от типа индексного эпизода, остается комбинация КВЕ с нормотимиком (ЛИТ или дивальпроексом) [14, 69–71]. Эта комбинация в рекомендациях CANMAT/ ISBD 2013 г. отнесена к препаратам первого выбора для поддерживающей терапии БАР.
В ряде исследований показана более высокая эффективность при поддерживающей терапии комбинаций нормотимиков между собой по сравнению с монотерапией их ингредиентами. В частности, достаточная доказательная база, подтверждающая профилактический эффект в отношении эпизодов депрессии, имеется для комбинаций ЛМТ с ЛИТ и ВПК [72]. Добавление ЛМТ к ЛИТ позволяло существенно удлинять время до развития рецидива [73].
Эффективность ЛИТ в составе комбинированной/адъювантной терапии изучалась в сочетании с препаратами разных групп. В ряде руководств его комбинации рассматриваются в качестве терапии второй линии поддерживающей терапии БАР (см. таблицу). В частности, в руководстве ICG применение комбинаций ЛИТ или ВПК с ЛМТ рекомендуется больным с быстрой цикличностью. Доказаны преимущества комбинации ЛИТ и ВПК перед монотерапией ВПК [37], однако преимущества данной комбинации перед монотерапией ЛИТ пациентов с быстрой цикличностью и сопутствующим злоупотреблением психоактивными веществами вызывают сомнения [74]. Неэффективными оказались комбинации ЛИТ с КМЗ, окскарбазепином, ИМИ и перфеназином, а также КМЗ с ВПК [14]. Добавление ОЛЗ к ЛИТ или ВПК улучшает исход лечения и может снижать суицидальность [45, 75, 76].
В одном РКИ показано, что добавление к стандартной терапии КЛЗ позволяет предотвращать манию у пациентов, резистентных к предшествующей терапии [77]. Положительные результаты также получены при добавлении к нормотимикам ЗИП, АРП и РСП [78–82]. В частности, у пациентов, рефрактерных к лечению ЛИТ или ВПК в острой фазе, эффективной оказалась поддерживающая терапия тем же нормотимиком в сочетании с АРП [80].
При поддерживающей терапии также изучались комбинации, включающие АД. Комбинация ОЛЗ с флуоксетином в дозах 6/25, 6/50, 12/25 или 12/50 мг/сут в 25-недельном РКИ приводила к более выраженному улучшению симптомов у больных БАР-I по сравнению с ЛМТ, однако разницы в частоте рецидивов не наблюдалось [83]. При этом в группе комбинированной терапии чаще встречались прибавка в массе тела и гиперхолестеринемия. В открытом исследовании с участием пациентов с БАР-I, недавно перенесших депрессивный эпизод, длительная терапия ОЛЗ/флуоксетином (24 недели) в большей степени предотвращала эпизоды мании (частота рецидивов – 5,9%), чем депрессии (частота рецидивов – 27,4%) [84].
Показано, что добавление ВПК к АД позволяет более эффективно, чем монотерапия ЛИТ, предотвращать эпизоды депрессии [39]. В другом исследовании добавление АД (бупропиона, СЕР или велафаксина) к нормотимику улучшало исход у больных с биполярной депрессией в остром периоде и в течение года наблюдения без повышения риска инверсии фазы [85].
В целом, несмотря на положительные результаты, полученные при применении комбинированной/адъювантной терапии во многих исследованиях, веские доказательства ее преимуществ перед монотерапией отсутствуют [14, 39]. Комбинированная терапия может быть показана пациентам, стабилизированным при ее применении в острой фазе, т.к. у таких пациентов переход на монотерапию обычно сопровождается ухудшением состояния. Пользу от добавления ОЛЗ, ВПК, АД или ЛМТ (в зависимости от индексного острого эпизода) могут получать больные, проявившие резистентность к монотерапии [14].
Таким образом, большинству пациентов с БАР для поддерживающего лечения показана монотерапия одним из препаратов первой линии, доказавшим свою эффективность в качестве профилактического средства. Имеющиеся на сегодняшний день данные позволяют рекомендовать в качестве препаратов первой линии для поддерживающей терапии ЛИТ, ЛМТ, ВПК, ОЛЗ, КВЕ и АРП [4].



