Введение
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) относится к числу наиболее распространенных заболеваний верхних отделов желудочно-кишечного тракта. Проведенные в западных популяциях эпидемиологические исследования свидетельствуют: до 40% лиц (с различной частотой) испытывают изжогу – основной симптом ГЭРБ [1, 2]. В России, согласно данным многоцентрового исследования МЭГРЕ (многоцентровое исследование «Эпидемиология гастроэзофагеальной рефлюксной болезни в России»), распространенность заболевания в крупных городах варьируется от 11,6 до 23,6% [3]. Отдельно стоит отметить, что истинная распространенность ГЭРБ в несколько раз превышает все статистические данные, что обусловлено высокой вариабельностью симптоматики и низкой обращаемостью пациентов за медицинской помощью [4].
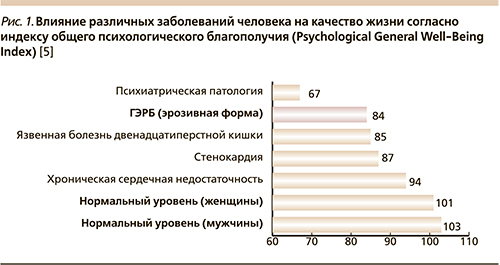
В целом же полиморфная клиническая картина ГЭРБ с учетом хронического течения заболевания приводит к значительному снижению многих параметров качества жизни больных – в большей степени, чем хроническая сердечная недостаточность, стенокардия и др. (рис. 1) [5]. Наличие нетипичных внепищеводных проявлений ГЭРБ нередко затрудняет диагностику, приводит к диагностическим ошибкам и неадекватным лечебным мероприятиям, которые могут приводить к осложнениям заболевания (пищевод Барретта, язвы, стриктуры пищевода) [4, 6, 7].
Помимо этого ГЭРБ рассматривается как ведущий фактор риска развития аденокарциномы пищевода, ассоциированной с неблагоприятным прогнозом и высокой смертностью [4, 8]. Таким образом, вопросы своевременного, адекватного и оптимального лечения ГЭРБ в настоящее время без преувеличения являются актуальной задачей современной медицины.
Принципы фармакотерапии ГЭРБ
ГЭРБ представляется классическим кислотозависимым заболеванием – патологией, ассоциируемой с кислотной агрессией желудочного сока, причинами которой служат дисбаланс между механизмами кислотопродукции и кислотонейтрализации, включая недостаточность нижнего пищеводного сфинктера и учащение его спонтанных релаксаций [4, 9]. Исходя из данной характеристики заболевания, на сегодняшний день в рамках фармакотерапии ГЭРБ базисным средством служат антисекреторные препараты класса ингибиторов протонной помпы (ИПП) [10, 11].
Действительно, появление ИПП на рынке средств антисекреторной терапии в конце 1980-х гг. стало значительным достижением в области как фармакологии, так и практической гастроэнтерологии. Сегодня можно без сомнения утверждать, что ИПП занимают передовое место в структуре антисекреторных препаратов и являются «золотым» стандартом в терапии кислотозависимых заболеваний, в частности ГЭРБ [12].
По химической природе ИПП относятся к слабым основаниям, в этой форме они не активны, но накапливаясь в кислой среде канальцев париетальных клеток, где происходит их протонирование, они преобразуются в активную форму – сульфенамид. Последний способен связываться с помощью дисульфидных связей с цистеиновыми группами протонной помпы, что приводит к необратимому ингибированию фермента и угнетению секреции соляной кислоты. Кислотосупрессивный эффект ИПП по отношению как к базальной, так и к стимулированной секреции длится в течение 24 часов и более [12]. Примерно за такое время париетальная клетка синтезирует новые молекулы протонной помпы. Показано, что однократный прием ИПП в средней терапевтической дозе приводит к угнетению желудочной кислотопродукции на 80–98%, что существенно больше по сравнению с блокаторами гистаминовых Н2-рецепторов [13].
Применение ИПП пациентами с ГЭРБ делает желудочный рефлюктат менее агрессивным за счет снижения кислотопродукции в желудке. Более высокая эффективность ИПП в рамках терапии ГЭРБ по сравнению с блокаторами гистаминовых Н2-рецепторов была неоднократно продемонстрирована в разных клинических исследованиях и мета-анализах [14, 15]. Применение ИПП в большинстве случаев оказывается высокоэффективным в купировании симптоматики ГЭРБ, заживлении эрозивных повреждений пищевода и предотвращении осложнений [10].
Вариативная эффективность терапии ГЭРБ
Однако в ряде случаев терапия ИПП оказывается малоэффективной или полностью безуспешной (рефрактерная ГЭРБ) [16]. Причины рефрактерной ГЭРБ представляют собой довольно большую группу гетерогенных факторов, обусловливающих неэффективность применения ИПП в адекватной дозировке [17]. Исключая комплаенс пациента, конкретизируясь на факторах, зависящих непосредственно от лекарственной терапии, необходимо отметить, что рефрактерность или недостаточная эффективность лечения может быть обусловлена фармакологическими причинами, отражающимися в вариативной эффективности ИПП для различных пациентов.
Действительно, предиктивность эффективности антисекреторного действия ранних поколений ИПП зачастую бывает субоптимальной. В частности, при применении ИПП в ряде случаев характерны т.н. эпизоды ночного кислотного прорыва (НКП), которые характеризуются снижением интрагастрального pH<4,0 в ночное время продолжительностью более часа [18]. Данное явление вызывает ночную симптоматику у пациентов, существенно снижая качество жизни больных [4, 19]. Согласно западной практике, эпизоды НКП наблюдаются примерно у 70% пациентов, получающих терапию ИПП [20]. По нашим наблюдениям, около 20% пациентов, получающих адекватную терапию ИПП, продолжают испытывать эпизоды НКП, что нередко требует корректировки назначенного лечения.
При применении большинства ИПП максимальный антисекреторный эффект достигается лишь к 5-м суткам приема препарата. В свою очередь оптимальная эффективность ИПП во многом зависит от времени приема препарата, которое в идеале должно происходить за 15–60 (в среднем 30) минут до первого приема пищи [21, 22].
Помимо этого скорость метаболизма, а соответственно, и эффективность ИПП детерминированы полиморфизмом гена, кодирующего изоформу цитохрома P450 2С19 (CYP2C19). Так, пациенты с фенотипом «быстрых» метаболизаторов осуществляют быстрый метаболизм ИПП, а следовательно, антисекреторный эффект от приема ИПП у них имеет меньшую продолжительность и выраженность, чем у пациентов с фенотипами «промежуточных» и «медленных» метаболизаторов [23]. Данное явление менее характерно для одних из последних генераций ИПП – рабепразола и эзомепразола, отличающихся меньшей зависимостью от полиморфизма гена СYР2С19 [23, 24].
Специфичный печеночный метаболизм ИПП может быть причиной нежелательных лекарственных взаимодействий [25]. Действительно, в рамках конкурентного ингибирования CYP2C19 ИПП могут снижать метаболизм других лекарств, в котором участвует данная изоформа, в частности клопидогрела [25, 26]. Этот феномен приводит к уменьшению биотрансформации клопидогрела в его активный метаболит, что ведет к супрессии его антитромбоцитарного эффекта [26, 27].
Декслансопразол – новый ИПП в терапии ГЭРБ
Декслансопразол (Дексилант®, Takeda Pharmaceutical Co Ltd, Япония) – новый представитель класса ИПП. Препарат был зарегистрирован в России в 2014 г. Декслансопразол представляет собой R-энантиомер молекулы лансопразола [28, 29]. Как известно, стереоселективное взаимодействие с оптически активными биологическими макромолекулами имеет ряд отличий, в частности, в рамках печеночного метаболизма, что проявляется в изменении профиля фармакодинамики и фармакокинетики энантиомеров [29, 30]. Так, метаболизм лансопразола как рацемата (смесь энантиомеров) происходит под действием как CYP2C19, так и CYP3A4 примерно в равной степени [28].
В свою очередь биотрансформация S- и R-энантиомеров лансопразола катализируется преимущественно CYP2C19. При этом R-энантиомер имеет меньшую аффинность к этому ферменту, а следовательно, замедленный клиренс [31, 32]. Именно поэтому декслансопразол был выбран для дальнейшей разработки и внедрения в клиническую практику.
К отличительным особенностям коммерческого варианта декслансопразола (Дексилант®) относится его лекарственная форма: капсулы с инновационной технологией двойного высвобождения [33]. Каждая капсула состоит из двух типов гранул, высвобождающих активное вещество на различных уровнях рН (5,5 и 6,75) [34, 40]. Первый тип гранул (25% дозы препарата) был разработан для быстрого высвобождения декслансопразола, после того как гранулы достигнут проксимальной части двенадцатиперстной кишки, в то время как гранулы второго типа (75% дозы препарата) проводятся дальше по пищеварительному тракту до дистального отдела тонкой кишки [35, 40].
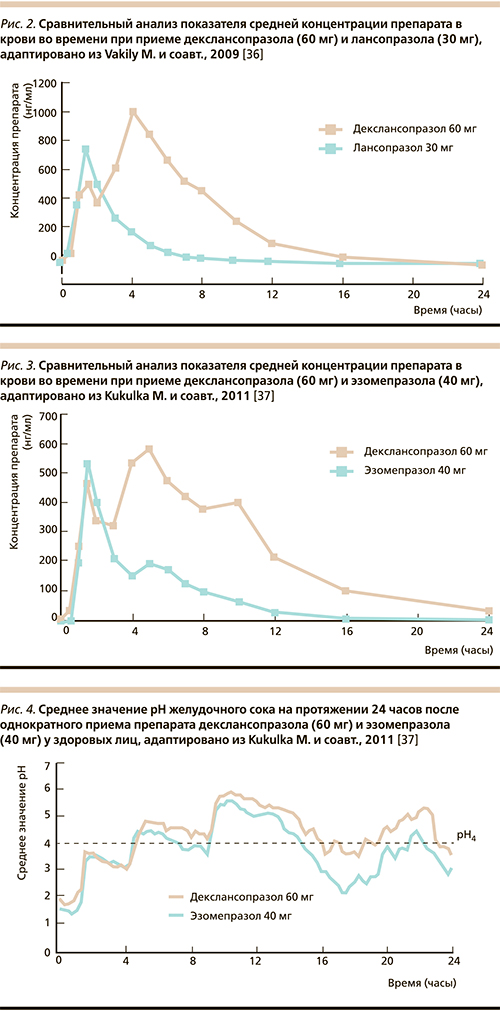
В результате фармакокинетический профиль декслансопразола характеризуется наличием двух пиков в отличие от традиционных ИПП, для которых характерно наличие лишь одного пика. Формирование двух пиков Tmax: через 1–2 и 4–5 часов после приема обеспечивает устойчивую концентрацию препарата в крови до 6,4 часа, в то время как для традиционной лекарственной формы лансопразола с однократным высвобождением этот показатель равен 2,8–3,2 часа (рис. 2) [34, 36]. В результате технология двойного отсроченного высвобождения формы выпуска декслансопразола обеспечивает пролонгированное действие препарата. Подобные результаты демонстрируются и при сравнении профиля концентрации препарата в крови с эзомепразолом (рис. 3), что позволяет декслансопразолу обеспечивать более длительное снижение секреции желудочного сока по сравнению с указанным ИПП (рис. 4) [37].
Таким образом, пролонгированный профиль антисекреторного действия декслансопразола позволяет рассматривать его как эффективное средство терапии ГЭРБ даже при однократном приеме препарата. С учетом того что двукратный прием снижает приверженность к терапии и чаще сопровождается прекращением лечения, прием препарата один раз в день может способствовать улучшению комплаенса [38].
Важно отметить, что антисекреторный эффект декслансопразола не зависит от времени приема пищи, что характерно для ИПП ранних поколений [39, 40]. При этом декслансопразол обеспечивает одинаковый уровень контроля секреции желудочного сока при приеме в разное время в течение дня. Так, независимо от времени приема препарата pH>4,0 поддерживается в желудке на протяжении 57–66% 24-часового периода после его приема [39]. Помимо этого в отличие от омепразола и эзомепразола декслансопразол в меньшей степени снижает биотрансформацию клопидогрела в его активный метаболит при совместном приеме препаратов, что было продемонстрировано в рандомизированном перекрестном исследовании на здоровых добровольцах [41].
Эффективность декслансопразола в рамках терапии ГЭРБ была доказана в рандомизированных контролируемых исследованиях. В одной работе декслансопразол в дозе 60 мг/сут оказался более эффективным при лечении эрозивных форм ГЭРБ по сравнению с лансопразолом в дозе 30 мг/сут [42]. Эффективность декслансопразола в дозе 30 мг/сут была продемонстрирована в популяции пациентов с неэрозивной формой ГЭРБ [44]. При этом терапия декслансопразолом позволяла успешно нивелировать в т.ч. и ночную симптоматику, а также была ассоциирована с улучшением качества жизни пациентов [44]. В ретроспективном анализе исследований декслансопразола было показано, что препарат снижает частоту и тяжесть изжоги в течение суток у пациентов с ГЭРБ независимо от исходного индекса массы тела [43].
Во всех исследованиях был продемонстрирован хороший профиль безопасности декслансопразола. Нежелательные побочные реакции, ассоциированные с приемом препарата, в основном были слабой или умеренной интенсивности, а частота их возникновения была сопоставимой с таковой для лансопразола [35, 40, 42].
Для лечения эрозивного эзофагита рекомендуемая доза декслансопразола составляет 60 мг один раз в сутки в течение 4 недель. Если за этот период заживления не произошло, терапия может быть продолжена в той же дозе еще 4 недели. При поддерживающей терапии рекомендуемая доза составляет 30 мг один раз в сутки длительностью до 6 месяцев. Пациентам с эрозивным эзофагитом средней и тяжелой степени рекомендуемая доза для поддерживающей терапии составляет 60 мг один раз в сутки длительностью до 6 месяцев. Для краткосрочного лечения изжоги и регургитации содержимого желудка, связанных с симптоматической неэрозивной формой ГЭРБ, рекомендуется доза 30 мг один раз в сутки, длительность приема – до 4 недель.
Заключение
Таким образом, новый ИПП декслансопразол за счет своих фармакодинамических и фармакокинетических характеристик, обеспечиваемых стереоселективностью молекулы в сочетании с уникальной формой выпуска (капсулы с инновационной технологией двойного высвобождения), может рассматриваться как препарат выбора для лечения ГЭРБ наряду с рабепразолом и эзомепразолом, в т.ч. и осложненных форм заболевания.



