Рассеянный склероз (РС) – прогрессирующее аутоиммунное заболевание центральной нервной системы (ЦНС) с дегенеративным компонентом, поражающее преимущественно пациентов молодого возраста и зачастую приводящее к инвалидизации [1].
За последнее время в мире достигнут значительный прогресс в разработке и внедрении препаратов, изменяющих течение рассеянного склероза (ПИТРС), влияющих на снижение частоты обострений РС. К ПИТРС, зарегистрированным в Российской Федерации [2], относятся интерфероны, глатирамера ацетат, натализумаб, финголимод и внутривенные иммуноглобулины, разрабатываются и готовятся к регистрации новые препараты. Однако вопросы симптоматической терапии, стандарты купирования обострения (экзацербации) заболевания до настоящего времени полностью не разрешены. Наибольшую эффективность при этом показали методы массивной иммуносупрессии – пульс-терапия метилпреднизолоном, использование обменного плазмафереза, в меньшей степени назначают большие дозы глюкокортикоидов и иммуносупрессантов перорально [2]. В то же время появляются данные о возможности воздействия на отдельные патогенетические механизмы для купирования обострения РС, в частности при помощи антиоксидантной терапии [3]. Причем различные авторы предлагают применять альтернативные подходы как наряду с международными стандартами лечения обострения, так и вместо них (например, при «мягких» обострениях либо сопровождающихся лишь чувствительной симптоматикой). Большая значимость данного направления состоит и в том, что при частом применении гормонотерапии эффективность повторных курсов иммуносупрессии неуклонно снижается, а возможность применения альтернативных препаратов для купирования обострений умеренной тяжести позволит сохранить эффективность стандартной схемы пульс-терапии.
Тикотовая (α-липоевая) кислота (АЛК) – эндогенный антиоксидант, который является коферментом, входящим в состав энзимов группы кокарбоксилаз, участвующим в углеводном и жировом обменах [4]. АЛК, обладающая выраженным антиоксидантным действием, по результатам многочисленных исследований показала свою эффективность при лечении заболеваний периферической нервной системы и ЦНС [5]. При лечении диабетической полиневропатии тиоктовая кислота на основании мета-анализа признана единственным препаратом с уровнем доказательности класса А [6–9]. Проведено много исследований эффективности тиоктовой кислоты при заболеваниях ЦНС: рассеянного склероза [10, 11], острого нарушения мозгового кровообращения [12], черепно-мозговой травмы [14], болезни Альцгеймера [15], болезни Паркинсона [16]. Показана значительная эффективность препаратов при лечении экспериментального аутоиммунного энцефалита – основной модели демиелинизирующих заболеваний у лабораторных животных [9].
В качестве биохимических показателей эффективности антиоксиданной терапии предлагаются [10, 11] степень ингибирования индуцируемой нитроксидсинтазы, матриксная металлопротеаза-9 (MMP-9), растворимые внутриклеточные молекулы адгезии-1 (sICAM-1), оксид азота и др. Данные показатели не только связаны с оксидативным стрессом, но и кореллируют с активностью процесса миграции активированных Т-лимфоцитов через гематоэнцефалический барьер в ЦНС. Несколько независимых исследовательских групп выявили значимое снижение MMP-9, sICAM-1 при применении как ПИТРС, так и тиоктовой кислоты [10, 11].
С учетом роли окислительного стресса в патогенезе демиелинизации и поддержания аутоиммунного процесса у больных РС перспективными направлениями оптимизации терапии этого заболевания являются замедление процессов образования оксида азота, введение извне молекул-«мусорщиков» или же усиление энзиматических путей инактивации свободных радикалов. Известно, что некоторые из общеизвестных методов лечения больных РС оказывают патогенетическое воздействие на эти процессы. Так, одним из эффектов пульс-терапии метилпреднизолоном является достоверное снижение образования супероксида.
В настоящее время выпускается несколько препаратов, содержащих различные соли тиоктовой кислоты (этилендиаминовую, трометамоловую, меглюминовую). При введении меглюминовой соли тиоктовой кислоты частота побочных эффектов ниже, чем при инфузии других солей тиоктовой кислоты.
Ряд авторов считают необходимыми дальнейшие исследования применения тиоктовой кислоты в качестве препарата, снижающего вероятность обострения, средства симптоматической терапии, а также лечения экзацебраций в виде монотерапии или в составе комплексной терапии.
Целью нашей работы стала оценка эффективности применения препарата α-липоевой кислоты при купировании экзацербации у больных РС.
Материал и методы
Было проведено одномоментное проспективное исследование с участием пациентов неврологического отделения с обострением РС. Состояние больных оценивали по шкале Куртцке EDSS (Expanded Disability Status Scale).
Критерии включения в исследование: возраст от 18 до 45 лет, наличие обострения РС, поступление в отделение в течение 10 дней от начала обострения, наличие сенсорных нарушений в структуре заболевания, информированное добровольное согласие на участие в исследовании. Всего в исследование были включены 42 пациента с обострением РС, разделенных на две группы случайным образом.
I группа – 22 пациента с обострением РС, имеющих сенсорные нарушения, в возрасте от 19 до 36 лет. В среднем 24,27±2,61 года. Среди обследованных были 15 (68,18%) женщин и 7 (31,82%) мужчин. II группа – 20 пациентов с обострением РС, имеющих сенсорные нарушения, в возрасте от 18 до 42 лет.
В среднем 23,93±1,55 года. Среди обследованных были 14 (70%) женщин и 6 (30%) мужчин.
Терапия всех пациентов с обострением РС осуществлена с учетом клинических рекомендаций по схеме: метилпреднизолон 1000 мг внутривенно, капельно, 5–7 дней в зависимости от тяжести обострения.
К лечению пациентов II группы добавили препарат АЛК по схеме: 600 мг (24 мл) α-липоевой кислоты внутривенно, капельно, медленно на 200 мл физиологического раствора ежедневно в течение 5 суток, затем прием α-липоевой кислоты 600 мг 1 раз в сутки перорально в течение 5 недель.
Оценка клинической симптоматики проведена до начала лечения, через 2 и 6 недель от начала терапии по расширенной шкале инвалидизации при РС Курцтке EDSS.
Статистическая обработка полученных результатов и построение диаграмм осуществлены с использованием программ Microsoft Excel 5,0 for Windows»и SPSS 15.0 for Windows.
Оценка эффективности вмешательства – по клинически значимому исходу лечения (отсутствие или сохранение остаточной клинической симптоматики обострения РС). Сравнивались группы больных в зависимости от применяемой схемы лечения с последующим построением таблицы сопряженности [17].
Результаты исследования
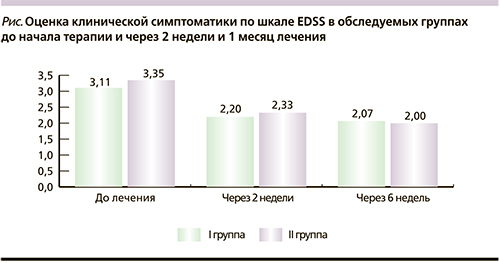
На рисунке представлена динамика клинической симптоматики по шкале EDSS в обследуемых группах до начала терапии, через 2 недели и 1 месяц после начала лечения. Степень инвалидизации по шкале EDSS на момент начала лечения обострения была выше во II группе по сравнению с I группой (среднее значение – 3,35 и 3,11 балла соответственно). Несмотря на случайное распределение пациентов по группам, группы были абсолютно сопоставимыми по полу и возрасту и к моменту окончания исследования; среднее EDSS практически не различалось (2,07 балла в I группе и 2,0 – во II). Однако наблюдалась значительно лучшая динамика уменьшения симптоматики по оценке общего балла по EDSS у пациентов II группы, получавших наряду с пульс-терапией метилпреднизолоном препараты АЛК. Динамика за время госпитализации (в среднем 14 дней) составила для I группы -0,91 балла по шкале EDSS, во II группе снижение составило -1,02 балла. Через месяц после выписки (через 6 недель от начала терапии): общая динамика по EDSS для I группы – -1,04 балла, для II группы – -1,35. При анализе динамики показателей отдельных функциональных систем статистически достоверных закономерностей выявить не удалось в связи с малой выборкой пациентов.
У пациентов I группы (22 человека) ожидаемый положительный результат (отсутствие новой клинической симптоматики по отношению к неврологическому статусу до обострения) наблюдали у 6 (27,27%) человек; вероятный неудовлетворительный исход (сохранение остаточной клинической симптоматики) – у 16 (72,73%).
У пациентов II группы (20 человек) ожидаемый положительный результат (отсутствие резидуальной клинической симптоматики по отношению к неврологическому статусу до обострения) наблюдали у 15 (75%) человек; вероятный неудовлетворительный исход (сохранение остаточной клинической симптоматики) – у 5 (25%).
ЧИЛ (частота исходов в экспериментальной группе)=А/(А+В)=5/20=0,25=25,0%.
ЧИК (частота исходов в группе сравнения)=С/(С+D)=16/22=0,727≈72,7%.
САР (снижение абсолютного риска)=/ЧИЛ-ЧИК/=/0,25-0,727/=0,477≈0,48≈48%.
СОР (снижение относительного риска)=/ЧИЛ-ЧИК/ЧИК≈ 0,477/0,727≈0,656≈65,6%.
ЧБНЛ (число больных, которых необходимо лечить определенным методом в течение заданного времени, чтобы предупредить наступление неблагоприятного исхода у одного больного)=1/САР=1/0,48≈1,92.
ОШ (отношение шансов)=(А/В)/(С/D)=(5/15)/(16/6)=0,33/2,67≈0,12.
Полученные показатели свидетельствуют о том, что схема терапии обострения РС сопровождается клинически значимым положительным эффектом, отражающимся в показателях СОР, составляющим 65,6%, ОШ, равным ≈ 0,12. Значение ЧБНЛ, равное в нашем исследовании 1,92, доказывает возможность предотвратить неблагоприятный исход (сохранения остаточной клинической симптоматики) не менее чем у каждого третьего пациента с РС при применении схемы лечения заболевания с применением АЛК.
Обсуждение
В настоящее время все шире обсуждается роль препаратов α-липоевой кислоты в лечении заболеваний нервной системы, в патогенезе которых активную роль играет оксидативный стресс. Одним из наиболее активно исследуемых направлений служит применение АЛК при рассеянном склерозе. Несколько проведенных исследований показали хорошую переносимость как пероральных, так и инъекционных форм препаратов АЛК и их эффективность в качестве средства симптоматической терапии сенсорных расстройств [10, 11]. Доказан эффект в плане значительного снижения в сыворотке маркеров оксидативного стресса, уменьшения проницаемости гематоэнцефалического барьера в эксперименте [10].
В проведенном нами небольшом проспективном исследовании проведена оценка переносимости и эффективности препаратов АЛК для пациентов с обострением РС и возможность улучшения прогноза. Выявлена более выраженная динамика снижения EDSS в группе пациентов, получавших препараты тиоктовой кислоты наряду с гормональной пульс-терапией. Причем эта динамика наблюдалась как в острый период – 14 дней с момента начала лечения, так и при продолжении приема препаратов тиоктовой кислоты в течение 4 недель после выписки из стационара. Результаты многих проведенных исследований дают надежду на эффективное применение препаратов АЛК в комплексной терапии РС, однако необходимы дальнейшие более крупные исследования.
Препараты АЛК продемонстрировали хорошую переносимость со стороны всех пациентов, ни одного случая отказа от терапии в связи с побочными эффектами зарегистрировано не было. С позиции классической доказательной медициной СОР, равное 65,6%, уровень ОШ – 0,12 и ЧБНЛ≈1,92 позволяют говорить о высокой степени эффективности α-липоевой кислоты в схеме терапии обострения РС. Однако с учетом малой выборки пациентов и неоднородности их по тяжести обострения и длительности заболевания необходимо проведение больших контролируемых исследований по всем правилам доказательной медицины для обоснования необходимости назначения исследуемого препарата в составе комплексной терапии обострения РС.



