Исследование ORIGIN (Outcome Reduction with Initial Glargine INtervention – уменьшение последствий сахарного диабета путем раннего назначения инсулина гларгин), результаты которого впервые были представлены в 2012 г. на 72-й научной сессии Американской диабетической ассоциации (ADA), было и остается самым крупномасштабным и длительным исследованием в диабетологии. Оно проводилось в 40 странах, в т.ч. в Российской Федерации, средняя длительность наблюдения пациентов составила 6,2 года.
Основной целью этого многоцентрового исследования была оценка эффектов терапии инсулином гларгин (ИГ) по сравнению со стандартной сахароснижающей терапией (в комбинации с ω-3-полиненасыщенными жирными кислотами [ПНЖК] или плацебо) в отношении снижения риска сердечно-сосудистых заболеваний (ССЗ) и/или смертности среди пациентов с предиабетом (нарушение толерантности к глюкозе и нарушение гликемии натощак) или «ранним» сахарным диабетом (СД) 2 типа (СД2) и высоким риском возникновения ССЗ [1].
В исследование (рандомизированное плацебо-контролируемое факториального дизайна 2×2) были включены 12 537 пациентов (средний возраст – 63,5 года, 35 % женщин) с предиабетом, «ранним» СД2 и высоким риском ССЗ, которые были рандомизированы в группы стандартной терапии ω-3-ПНЖК или плацебо, а также в группы терапии ИГ в сочетании с ω-3-ПНЖК или плацебо. Доза ИГ титровалась до достижения уровня гликемии натощак <5,3 ммоль/л. Необходимо отметить, что приверженность к терапии ИГ была достаточно высокой: 86,3 % пациентов продолжали лечение спустя 5 лет после включения в исследование.
Результаты исследования ORIGIN оказались одновременно долгожданными и в некоторой степени неожиданными. Неожиданными, поскольку была опровергнута одна из основных гипотез исследования ORIGIN – о снижении риска ССЗ/смертности при достижении нормогликемии путем сверхраннего назначения базального инсулина. Вместе с тем эта неожиданность весьма условна: результат исследования не может быть положительным или отрицательным, поскольку в любом случае мы получаем ответ на поставленный вопрос, а это оказывает существенное влияние на рутинную клиническую практику. Долгожданными, потому что инсулин гларгин (Лантус®) был первым аналогом инсулина длительного действия, вошедшим в клиническую практику в 2000 г., и вплоть до настоящего времени остается самым широко используемым базальным аналогом в мире, что предъявляет особые требования к безопасности препарата, в т.ч. долгосрочной. И благодаря результатам исследования ORIGIN в настоящее время ИГ (Лантус®) является наиболее изученным аналогом инсулина в лечении СД.
Основные результаты ORIGIN говорят о следующем [1–3]:
- терапия ИГ обеспечивает стойкий, долгосрочный гликемический контроль при нейтральном влиянии на сердечно-сосудистые исходы, относительно низком риске гипогликемии и незначительной прибавке массы тела;
- длительное лечение ИГ не влияет на частоту развития рака по сравнению со стандартным лечением;
- раннее назначение ИГ ассоциируется с достоверным снижением частоты прогрессирования предиабета в явный СД2.
В дальнейшем исследование ORIGIN было расширено посредством проведения нескольких дополнительных исследований и субанализов, о которых и пойдет речь в этом обзоре:
- Изучение риска развития микроваскулярных осложнений [4].
- CC-исходы в подгруппах пациентов, перенесших легкую или тяжелую гипогликемию во время исследования [5].
- Субисследование ORIGIN-GRACE, изучившее эффекты использовавшихся в исследовании ORIGIN видов лечения на толщину комплекса интима-медиа (ТКИМ) сонных артерий (СА) [6].
- Субисследование влияния терапии, применявшейся в исследовании ORIGIN, на когнитивную функцию [7].
- Исследование ORIGINALE, разработанное с целью выявления любых долгосрочных эффектов терапии, применявшейся в исследовании ORIGIN при пассивном последующем наблюдении длительностью как минимум 2 года [8].
Микроваскулярные осложнения у пациентов в исследовании ORIGIN
Хорошо известно, что частота возникновения микроваскулярных осложнений находится в прямой линейной зависимости от уровня гликемии при СД 1 или 2 типа (рис. 1) [9, 10]. Именно поэтому достаточно сложно оценить влияние снижения уровня гликемии на развитие микроваскулярных осложнений, когда он лишь незначительно превышает нормальные значения. Кроме того, нелегко оценить значимость гликемического контроля при незначительных различиях в динамике гликемии в основной и контрольной группах. Исследовательская группа ORIGIN попыталась найти ответы в.т.ч. и на эти вопросы.
В качестве микроваскулярных осложнений были выбраны удвоение уровня креатинина по сравнению с исходным значением, необходимость заместительной почечной терапии, ухудшение альбуминурии (от нормо- к микро- или к протеинурии или от микро- к протеинурии), смерть вследствие почечной недостаточности, проведение витрэктомии или лазерной фотокоагуляции сетчатки.
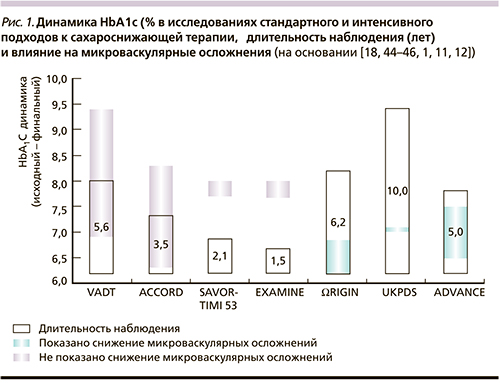
Из 12 537 пациентов, включенных в исследование, микроваскулярные осложнения были зарегистрированы у 2686 (21 %). При общем анализе частота развития микроваскулярных осложнений была одинаковой в группе ИГ и контрольной группе: относительный риск (ОР) – 97 [95 % доверительный интервал (ДИ) – 90, 1,05 ]; р = 0,43. Однако при более тщательном анализе стало очевидно, что терапия ИГ привела к снижению частоты микроваскулярных осложнений у пациентов с исходным уровнем гликозилированного гемоглобина (HbA1с) ≥6,4 % (ОР – 90 [95 % ДИ – 0,81; 0,99]) и не повлияла на частоту микроваскулярных осложнений у пациентов с исходным уровнем HbA1с <6,4 % (ОР – 1,07 [95 % ДИ – 0,95, 1,20]; p = 0,031). При этом необходимо отметить, что у пациентов с исходным уровнем HbA1с ≥6,4 % после рандомизации медиана снижения HbA1с составила -0,65 % [-0,16, -0,91 %] в группе ИГ и -0,33 % [-0,13, 0,83] в группе стандартной терапии (разница между медианами – 0,32 %), т.е. в течение 7 лет различие в гликемическом контроле между группами было незначительным. Однако даже такая умеренная разница у пациентов с исходным HbA1с ≥ 6,4 % была ассоциирована со снижением риска развития микроваскулярных осложнений на 10 %.
Влияние улучшения гликемического контроля на риск развития микроваскулярных осложнений у пациентов с СД2 впервые было продемонстрировано в исследовании UKPDS [11]. В этом исследовании в течение 10 лет медиана HbA1с в группе интенсивного гликемического контроля составила 7,1 %, а в группе стандартной терапии – 7,9 %, что значительно превышает нормальные показатели гликемии [9]. В исследовании ORIGIN исходный уровень HbA1с составил 6,4 % с минимальным повышением до 6,5 % в группе стандартной терапии и снижением до 6,2 % в группе ИГ в течение 7 лет [1].
Снижение риска микроваскулярных осложнений при столь незначительном снижении уровня HbA1с, с одной стороны, кажется удивительным, с другой – этот результат вполне сопоставим с таковыми не менее известных и значимых исследований: в уже упомянутом исследовании UKPDS снижение HbA1с на 0,9 % было ассоциировано со снижением частоты микроваскулярных осложнений на 25 %, в исследовании ADVANCE снижение HbA1с на 0,6 % – со снижением частоты микроваскулярных осложнений на 14 % [11, 12]. Вместе с тем в других не менее значимых для диабетологии исследованиях – VADT [18] и ACCORD [44–46], а также недавно завершенных SAVOR–TIMI-53 и EXAMINE [44–46] не было отмечено снижения риска развития микроваскулярных осложнений. К принципиальным различиям этих исследований от ORIGIN, UKPDS и ADVANCE относятся прежде всего более высокий исходный уровень HbA1c и меньшая продолжительность, а также более длительный анамнез СД. Таким образом, полученные результаты подтверждают необходимость своевременной диагностики СД2 и достижения амбициозных целей лечения (HbA1c < 6,5 %) на самых ранних этапах для снижения риска развития микроваскулярных осложнений.
Сильными сторонами исследования ORIGIN, несомненно, являются его длительность, высокий уровень приверженности пациентов к лечению и достаточное число микроваскулярных исходов. Эти факторы в добавление к проспективному сбору данных, в т.ч. с учетом анализа частоты гипогликемий и увеличения веса, позволяют выявлять клинически значимые эффекты, даже несмотря на то что оценка риска развития микроваскулярных осложнений не стала основной целью этого исследования. Вместе с тем у исследования есть и ряд ограничений. В частности, снижение частоты микроваскулярных осложнений скорее всего обусловлено не применением ИГ, а снижением уровня гликемии. Отсутствие этого влияния в подгруппе пациентов с уровнем HbA1с < 6,4 % может быть связано как с небольшой разницей в гликемическом контроле между группами ИГ и стандартной терапии, так и с незначительным числом микроваскулярных исходов в этой подгруппе.
Вместе с тем проведенный анализ демонстрирует, что достижение тощаковой нормогликемии в результате терапии ИГ у пациентов с исходно близким к удовлетворительному гликемическим контролем (HbA1с ≥ 6,4 %) позволяет снижать риск развития микроваскулярных осложнений. Будет ли аналогичный результат получен при применении иной сахароснижающей терапии пациентов со столь же низким уровнем HbA1с, остается неизвестным.
Сердечно-сосудистые исходы в подгруппах пациентов, перенесших легкую или тяжелую гипогликемию в течение исследования ORIGIN
Гипогликемия является основным нежелательным явлением терапии инсулином, производными сульфонилмочевины (ПСМ) и глинидами. Клиническая значимость гипогликемии обусловлена прежде всего непосредственным влиянием на повседневную жизнь пациентов. Вместе с тем в экспериментальных исследованиях показано, что гипогликемия может приводить к желудочковым аритмиям, увеличению длительности QT-интервала, нарушению реполяризации и ишемии миокарда [13–15]. Взаимосвязь гипогликемии и СС событий была неоднократно подтверждена в эпидемиологических и клинических исследованиях [16, 17].

В исследовании ORIGIN, самом крупномасштабном исследовании пациентов с предиабетом и СД2, была возможность изучения влияния гипогликемии на СС события.
Под легкой гипогликемией понимали развитие соответствующих симптомов, подтвержденное снижением уровня гликемии ≤ 3,0 ммоль/л, под тяжелой гипогликемией – необходимость посторонней помощи для купирования этого состояния или снижение уровня гликемии ≤ 2,0 ммоль/л.
В качестве СС исходов были выбраны: 1) совокупный исход – СС смерть, нефатальный инфаркт миокарда или инсульт; 2) смерть от любой причины; 3) СС смерть; 4) смерть вследствие развития аритмии. Оценка ОР развития СС событий проведена после анализа предрасположенности к гипогликемии.
В течение исследования (медиана длительности – 6,2 года) легкая гипогликемия была зарегистрирована у 41,7 % пациентов в группе ИГ и 14,4% – в группе стандартной терапии, в то время как тяжелая гипогликемия – у 5,7 и 1,8 % пациентов соответственно.
Легкая гипогликемия не была ассоциирована ни с одним СС исходом. Напротив, тяжелая гипогликемия привела к увеличению риска развития любого СС исхода: первичного совокупного (ОР – 1,58; 95 % ДИ – 1,24, 2,02; р = 0,001), смерти от любой причины (ОР – 1,74; 95 % ДИ – 1,39, 2,19; р = 0,001), СС смерти (ОР – 1,71; 95 % ДИ – 1,27, 2,30; р = 0,001) и смерти вследствие аритмии (ОР – 1,77; 95 % ДИ – 1,17, 2,67; р = 0,007). Тяжелая гипогликемия, перенесенная в ночное время, увеличила риск развития совокупного исхода и общую смертность (табл. 1).
Однако, хотя частота обоих типов гипогликемии была выше в группе ИГ, ОР развития всех СС исходов на фоне тяжелой гипогликемии был выше в группе стандартной терапии. Например, ОР развития первичного совокупного исхода, ассоциированного с тяжелой гипогликемией, в группе ИГ составил 1,38 (95 % ДИ – 1,03; 1,86), а в группе стандартной терапии – 2,39 (95 % ДИ – 1,55; 3,70; р = 0,047). Таким образом, у перенесших тяжелую гипогликемию пациентов группы стандартной терапии вероятность первичного совокупного исхода была в 1,7 раза выше (95 % ДИ – 1,01; 2,87), чем у перенесших тяжелую гипогликемию пациентов группы ИГ. Еще более выраженная ассоциация была выявлена для других СС исходов, которые с вероятностью, в 2–3 раза большей, развивались в группе стандартной терапии, нежели в группе ИГ.
Известно, что гипогликемия вследствие активации симпатоадреналовой системы увеличивает частоту сердечных сокращений, способствует повышению артериального давления и сократимости миокарда, увеличивает сердечный выброс [15]. В сочетании с повышением свертываемости и вязкости крови гипогликемия может приводить к ишемии миокарда и другим серьезным СС исходам, особенно пациентов со множеством СС рисков или ССЗ и пожилых больных [18–20]. Результаты исследования ORIGIN, продемонстрировавшие, что тяжелая и ночная тяжелая гипогликемии являются фактором риска СС событий, сходны с таковыми других исследований по изучению сахароснижающей терапии [18–20]. Связь между тяжелой ночной гипогликемией и СС исходами представляет особый интерес в свете сообщений о внезапной смерти во время сна пациентов с СД 1 типа [15].
Помимо известных патофизиологических механизмов, лежащих в основе ассоциации тяжелой гипогликемии и СС исходов, вполне возможно, что у пациентов, предрасположенных к развитию гипогликемии, имеются какие-либо иные факторы, вносящие вклад в повышение риска развития СС событий [16, 17, 21]. Более выраженная взаимосвязь между тяжелой гипогликемией и СС исходами в группе стандартной терапии, где современные рекомендации по тактике ведения пациентов соблюдались, но нормогликемия достигнута не была, по сравнению с группой терапии ИГ, где была достигнута тощаковая нормогликемия, позволяет предполагать, что тяжелая гипогликемия может быть скорее маркером, чем триггером СС исходов.
И что вероятность развития СС исхода выше в случае, когда тяжелая гипогликемия развивается у пациента, не достигшего нормогликемии, чем у пациента с идеальным гликемическим контролем.
Более высокая частота СС исходов в группе стандартной терапии при меньшем количестве тяжелых гипогликемий может быть также связана с терапией ПСМ, стимулирующих секрецию инсулина β-клетками поджелудочной железы, взаимодействуя с рецепторами к СМ и блокируя АТФ-зависимые калиевые каналы. Рецепторы к СМ и АТФ-зависимые калиевые каналы расположены в различных тканях, в т.ч. в кардиомиоцитах, где они отвечают за адаптацию миокарда к ишемии («ишемическое прекондиционирование») [22].
Еще одним объяснением может служить более высокая частота легких гипогликемий в группе ИГ, что могло привести к увеличению толерантности миокарда к ишемии при возникновении тяжелой гипогликемии и снижению числа (и риска) СС событий у перенесших тяжелую гипогликемию пациентов в группе ИГ.
Таким образом, исследование ORIGIN продемонстрировало ассоциацию тяжелой гипогликемии и СС исходов у пациентов с предиабетом и ранним СД2. Вместе с тем, несмотря на большую частоту всех видов гипогликемии в группе терапии ИГ по сравнению с группой стандартной терапии, ОР любых СС исходов был выше в группе стандартной терапии.
Субисследование ORIGIN-GRACE: эффекты использовавшихся в исследовании ORIGIN видов лечения на толщину комплекса интима-медиа сонных артерий
Субисследование GRACE (Glucose Reduction and Atherosclerosis Continuing Evaluation Study) в рамках исследования ORIGIN было спланировано для оценки прогрессирования атеросклероза.
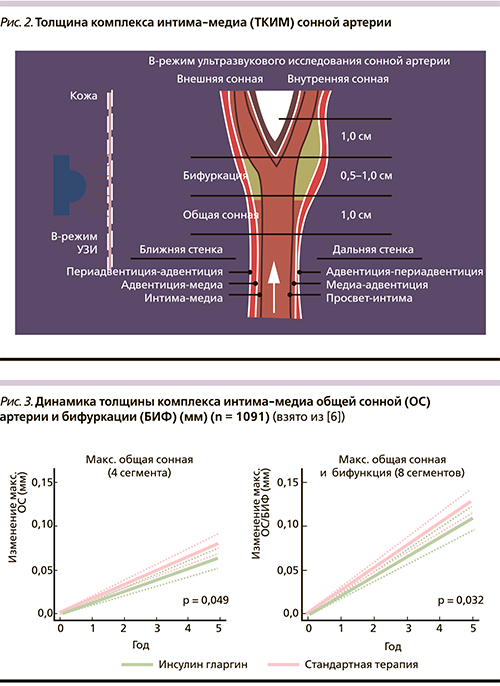
С этой целью у 1184 участников исследования ORIGIN исходно и в последующем ежегодно проводилось количественное ультразвуковое исследование СА с измерением ТКИМ (рис. 2).
Характеристики пациентов, вошедших в субисследование GRACE, представлены в табл. 2.
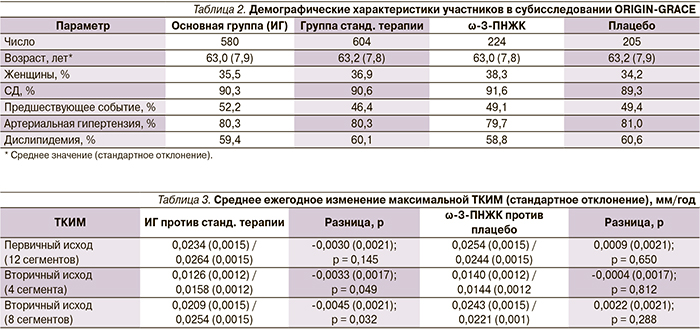
Первичным исходом стало среднее ежегодное изменение максимальной ТКИМ ближней и дальней стенок общей СА, бифуркации и внутренней СА (12 сегментов). Вторичные исходы включали среднее ежегодное изменение максимальной ТКИМ общей СА (4 сегмента, ближняя и дальняя стенка правой и левой общей СА) и общей СА+бифуркации (8 сегментов, ближняя и дальняя стенка правой и левой общей СА и бифуркации).
В результате терапии ИГ отмечено меньшее ежегодное увеличение ТКИМ по сравнению со стандартной терапий, однако для первичного исхода (ТКИМ 12 сегментов) разница оказалась статистически незначимой (0,003 ± 0,0021 мм/год; p = 0,145), в то время как для обоих вторичных исходов (ТКИМ 4 сегментов и ТКИМ 8 сегментов) разницы были статистически значимыми (0,0033 ± 0,0017 мм/год; p = 0,049 и 0,0045 ± 0,0021 мм/год; p = 0,032 соответственно; табл. 3, рис. 3).
Не было выявлено статистически значимых различий ни в первичном, ни во вторичных исходах между группами пациентов, получавших ω-3-ПНЖК и плацебо.
Если говорить о клинически значимых проявлениях атеросклероза, то за время исследования ORIGIN частота «больших» СС событий (СС мерть, нефатальный инфаркт миокарда, нефатальный инсульт, госпитализация по поводу сердечной недостаточности) была одинаковой в группах ИГ (29,5 %) и стандартной терапии (29,0 %), а также в группах ω-3-ПНЖК (28,4 %) и плацебо (29,9 %). Кроме того, не было выявлено разницы в частоте общей и СС смерти, инфаркта миокарда, инсульта, реваскуляризации и стенокардии между группами, за исключением случаев впервые выявленной стенокардии, которых было статистически значимо меньше в группе ИГ [3, 4].
В течение длительного времени СС безопасность инсулинотерапии была одним из наиболее широко дискутируемых вопросов. С одной стороны, в экспериментальных исследованиях инсулин снижал уровень маркеров атеросклеротического воспаления и атерогенных липидов, а также улучшал состояние эндотелия [23–26].
C другой стороны, описывалось проатерогенное действие экзогенного инсулина в условиях инсулинорезистентности и эндогенной гиперинсулинемии за счет стимулирования клеточной пролиферации [27, 28]. Клинических исследований по изучению влияния экзогенной инсулинотерапии до настоящего времени было немного, и одним из наиболее значимых является исследование EDIC – последующее наблюдение за 1229 пациентами с СД 1 типа, которые принимали участие в исследовании DCCT в течение 6 лет.
В исследовании DCCT-EDIC ТКИМ была статистически значимо ниже в группе пациентов, находившихся на интенсифицированной инсулинотерапии [29]. В ряде работ было показано, что ТКИМ у пациентов с предиабетом или СД2 увеличена по сравнению с лицами без нарушений углеводного обмена. Вместе с тем крупномасштабные исследования по влиянию инсулинотерапии на СС исходы у пациентов с СД2 до исследования ORIGIN не дали однозначных результатов. При последующем наблюдении за пациентами с СД2, участвовавшими в исследовании UKPDS, был обнаружен эффект «метаболической памяти»: снижение на 15 % ОР развития инфаркта миокарда и на 13 % – смерти при лечении инсулином и ПСМ пациентов с впервые выявленным СД2 [30]. Однако проведенный относительно недавно мета-анализ нескольких больших исследований не выявил подобного эффекта [31].
Доказательство СС безопасности служит в настоящее время основным требованием Food and Drug Administration США для одобрения клинического применения любого нового сахароснижающего препарата, поскольку пациенты с СД2 получают терапию десятилетиями [32]. Отсутствие увеличения частоты СС событий на фоне терапии ИГ в течение 6,2 года, а также замедление прогрессирования атеросклероза СА (замедление увеличения ТКИМ) подтверждают СС безопасность ИГ и свидетельствуют о том, что долгосрочное лечение ИГ может иметь некоторые преимущества. В частности, нельзя не отметить снижение риска развития стенокардии в группе ИГ по сравнению со стандартной терапией.
Поскольку в субисследовании GRACE были найдены доказательства замедления прогрессирования атеросклероза СА, сопоставимые с результатами исследования EDIC, совершенно логичным продолжением ORIGIN стало исследование ORIGINALE, спланированное для выявления долгосрочных эффектов терапии ИГ.
Субисследование влияния эффектов терапии, применявшейся в исследовании ORIGIN, на когнитивную функцию у пациентов с дисгликемий и впервые выявленным СД2
Когнитивная функция с возрастом проградиентно ухудшается, однако скорость снижения и степень когнитивной дисфункции зависят от многих факторов, в т.ч. от состояния углеводного обмена [33]. Доказано, что наличие СД или предиабет в 1,5–2,5 раза увеличивает риск развития умеренной когнитивной дисфункции, болезни Альцгеймера или сосудистой деменции [34–36]. В нескольких небольших рандомизированных контролируемых исследованиях местное (интраназальное) введение инсулина пациентам без СД с предеменцией или деменцией способствовало улучшению когнитивной функции [37, 38], однако влияние системного введения инсулина до настоящего времени изучено не было. Кроме того, в нескольких проспективных исследованиях были получены доказательства, согласно которым приверженцы средиземноморской диеты или те, кто употребляет массу антиоксидантов или ω-3-ПНЖК, в меньшей степени подвержены риску развитию деменции [40]. В одном из субисследований ORIGIN был проведен анализ влияния терапии базальным ИГ и ω-3-ПНЖК на когнитивную функцию пациентов.
Для оценки когнитивной функции были использованы два вопросника. Краткая шкала оценки психического статуса (Mini-Mental State Examination, MMSE) – вопросник из 30 пунктов, используется для выявления возможных когнитивных нарушений, в частности деменции, а также для оценки изменений, произошедших при прогрессировании болезни или на фоне терапии. Для прохождения теста обычно требуется около 10 минут, в ходе которых происходит краткая оценка арифметических способностей человека, ориентации во времени и пространстве, внимания и др. [41]. Тест на замену цифровых символов (Digit Symbol Substitution Test – DSST) – нейропсихологический тест, позволяющий оценивать широкий спектр когнитивных функций, в частности внимание, кратковременную память, способность к обучению, координацию, концентрацию и т.д. [42, 43].
В окончательный анализ вошли лишь пациенты, заполнившие вопросники при включении в исследование и хотя бы на одном из последующих визитов: оценка психического статуса при помощи MMSE была произведена 11 685 участникам, при помощи DSST – 3392.
Исследование ORIGIN не выявило различий в динамике значений когнитивных тестов между пациентами, получавшими терапию ИГ и стандартную терапию: MMSE – 0,0046 ([95 % ДИ – 0,0132; 0,0224]; p = 0,39) и DSS – 0,0362 ([95 % ДИ – 0,2180; 0,1455]; p = 0,34), так же как и между пациентами, получавшими ω-3-ПНЖК, и пациентами, леченными плацебо: MMSE – 0,0013 ([95 % ДИ – 0,0165; 0,0191]; p = 0,21) и DSS – 0,0605 ([95 % ДИ – 0,2422; 0,1212]; p = 0,72). Вероятность возникновения когнитивной дисфункции в дальнейшем также не различалась между группами ИГ и стандартной терапии (p = 0,065), так же как и между группами пациентов, получавших ω-3-ПНЖК и плацебо (p = 0,070). Вместе с тем терапия ИГ у пациентов с предиабетом в отличие от стандартной терапии была ассоциирована с меньшей скоростью снижения когнитивной функции (при проведении MMSE-, но не DSS-теста; p = 0,024).
Таким образом, в относительно молодой когорте пациентов с предиабетом или СД2 нормогликемия в течение почти 7 лет на фоне терапии ИГ и/или прием ω-3-ПНЖК не оказали влияния ни на скорость прогрессирования когнитивных нарушений, ни на их возникновение. Вместе с тем влияние нормогликемии на когнитивную функцию может иметь значение для пациентов преклонного возраста, что требует дальнейшего изучения.
Исследование ORIGINALE
С целью выявления долгосрочных эффектов терапии, применявшейся в исследовании ORIGIN (как это осуществлялось ранее в исследованиях UKPDS, DCCT, ADVANCE), было спланировано расширенное исследование ORIGINALE (ORIGIN And Legacy Effects). Исследование ORIGINALE представляет собой двухлетнее пассивное проспективное последующее наблюдение за участниками исследования ORIGIN после завершения активной терапии (или терапии исследования). В этот период участникам не будут предоставляться какие-либо лекарственные препараты или добавки и любые лекарственные препараты будут использоваться исключительно по усмотрению пациента и его лечащего врача.
Основная задача исследования ORIGINALE – изучение влияния терапии ИГ на СС заболеваемость и смертность в популяции пациентов ORIGIN в течение периода последующего наблюдения длительностью до 9 лет (6,2 года активного лечения и 2 года постинтервенционного наблюдения). Кроме того, изучалось влияние достижения нормального уровня гликемии натощак (< 5,3 ммоль/л) на частоту развития микроваскулярных осложнений, новообразований и впервые выявленных случаев СД в группах ИГ и стандартной терапии.
В исследовании ORIGINALE также проводилось последующее наблюдение за потенциальными эффектами ω-3-ПНЖК в отношении снижения частоты основных сердечно-сосудистых событий, а также комбинированного исхода (внезапная смерть, смерть вследствие аритмии, смерть без свидетелей, обратимая с помощью реанимационных мероприятий остановка сердца) по сравнению с плацебо. Участники исследования были приглашены на исходный визит, затем были проведены промежуточный телефонный звонок и окончательный визит. Период последующего наблюдения завершен в марте 2014 г.
Заключение
Итак, исследование ORIGIN продемонстрировало, что терапия ИГ обеспечивает стойкий, долгосрочный гликемический контроль при нейтральном влиянии на СС исходы, относительно низком риске гипогликемии и незначительной прибавке массы тела. Длительное лечение ИГ не влияет на частоту развития рака, а раннее назначение препарата ассоциируется с достоверным снижением частоты прогрессирования предиабета в явный СД2.
Достижение тощаковой нормогликемии в результате терапии ИГ у пациентов с исходно близким к удовлетворительному гликемическим контролем позволяет снижать риск развития микроваскулярных осложнений. Тяжелые гипогликемии на фоне терапии ИГ в меньшей степени, чем в группе стандартной терапии, ассоциированы с СС исходами. Терапия ИГ способствует замедлению прогрессирования атеросклероза СА, однако не влияет на прогрессирование когнитивной дисфункции.
Наличие долгосрочных эффектов терапии, применявшейся в исследовании ORIGIN, будет известно после анализа результатов исследования ORIGINALE.


